 第四讲物质结构与化学键
第四讲物质结构与化学键


《第四讲物质结构与化学键》由会员分享,可在线阅读,更多相关《第四讲物质结构与化学键(63页珍藏版)》请在装配图网上搜索。
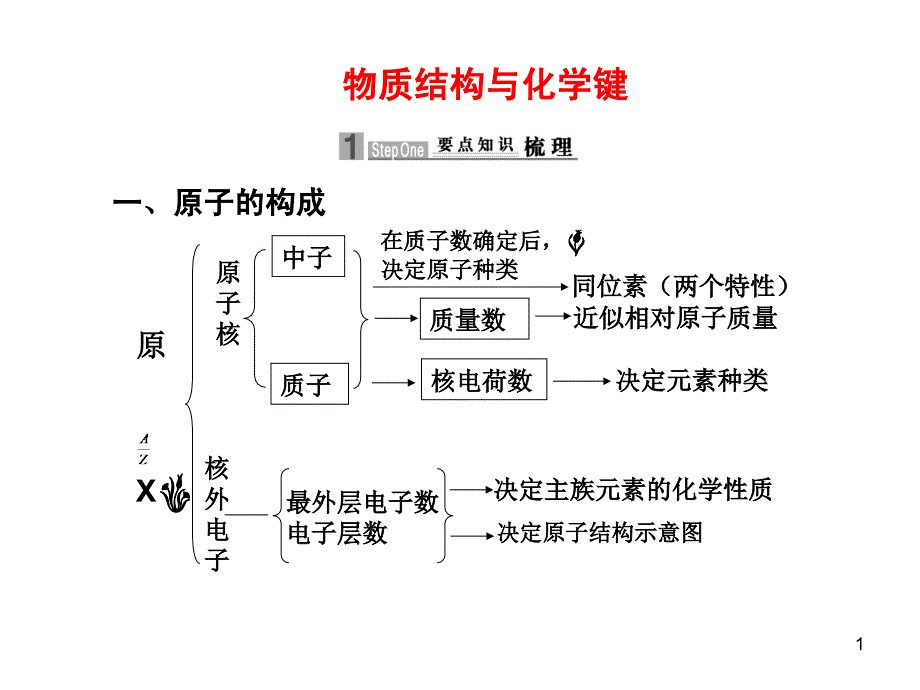
1、 物质结构与化学键物质结构与化学键一、原子的构成一、原子的构成原原 X原原子子核核核核外外电电子子中子中子质子质子在质子数确定后,在质子数确定后,决定原子种类决定原子种类同位素(两个特性)同位素(两个特性)质量数质量数近似相对原子质量近似相对原子质量核电荷数核电荷数决定元素种类决定元素种类最外层电子数最外层电子数电子层数电子层数决定主族元素的化学性质决定主族元素的化学性质决定原子结构示意图决定原子结构示意图11.核电荷数核电荷数=2.质量数(质量数(A A)=+。核内质子数核内质子数核外电子数核外电子数质子数质子数中子数中子数二、原子核外电子排布规律二、原子核外电子排布规律1.每一电子层所容纳
2、的电子数最多为每一电子层所容纳的电子数最多为 。2n n22.最外层电子数最多不超过最外层电子数最多不超过 ,若最外层为若最外层为K 层,电子数最多不超过层,电子数最多不超过 。823.次外层电子数最多不超过次外层电子数最多不超过 。184.能量能量 的电子离原子核近,能量的电子离原子核近,能量 的电子离的电子离 原子核远。原子核远。低低高高2三、元素与同位素的比较三、元素与同位素的比较原子原子原子原子质子数质子数化学化学1121313四、离子键与共价键的比较四、离子键与共价键的比较阴、阳离子间阴、阳离子间通过静电作用通过静电作用原子间通过共用电子对原子间通过共用电子对4成键成键条件条件 与与
3、 元元素原子化合素原子化合不同不同 结结合合相同非金属原子结相同非金属原子结合合存在存在 化合物化合物中中及某些及某些 中中大多数单质、部分大多数单质、部分 、部分、部分中中实例实例NaCl、Na2CO3、NaOHH2SO4、CO2、NaOH、Na2CO3O2、H2、H2O2、Na2O2共价化合物共价化合物离子离子化合物化合物离子离子 活泼活泼金属、活泼金属、活泼非非 金金 属属 非金属非金属元素原子元素原子离子离子共价化合物共价化合物离子化合物离子化合物5【例【例1】氕化锂、氘化锂、氚化锂都可作为发射氕化锂、氘化锂、氚化锂都可作为发射“嫦嫦 娥一号娥一号”卫星的火箭引燃剂。下列说法正确的是卫
4、星的火箭引燃剂。下列说法正确的是 ()A.1H、D+、T2互为同位素互为同位素 B.LiH、LiD、LiT含有的电子总数分别为含有的电子总数分别为3、4、5 C.7LiH、7LiD、7LiT的摩尔质量之比为的摩尔质量之比为1 1 1 D.它们都是离子化合物,常作还原剂它们都是离子化合物,常作还原剂考点一考点一 原子构成及各微粒的功能原子构成及各微粒的功能解析解析 本题主要考查了同位素、元素、核素的概念和本题主要考查了同位素、元素、核素的概念和质量数、质子数、中子数之间的关系及各粒子的性质量数、质子数、中子数之间的关系及各粒子的性质。质。6H H、D D、T T为不同的三种核素,互为同位素,都为
5、氢元为不同的三种核素,互为同位素,都为氢元素,应具有相同的质子数和电子数。故素,应具有相同的质子数和电子数。故A A、B B错;元素错;元素的摩尔质量在数值上等于其质量数,原子的质量数的摩尔质量在数值上等于其质量数,原子的质量数=质子数质子数+中子数,因此中子数,因此7 7LiHLiH、7 7LiDLiD、7 7LiTLiT的摩尔质量分的摩尔质量分别为别为8 8、9 9、1010,故,故C C错误;锂元素为金属元素,与氢错误;锂元素为金属元素,与氢元素通过得失电子化合生成氢化锂,故三种物质都是元素通过得失电子化合生成氢化锂,故三种物质都是离子化合物,因作火箭引燃剂,说明三种物质为还原离子化合物
6、,因作火箭引燃剂,说明三种物质为还原剂,故剂,故D D项正确。项正确。答案答案 D7 X中各数量之间的关系一直是高考的重点和中各数量之间的关系一直是高考的重点和热点。此类题常考常新,常常结合新发现的元素热点。此类题常考常新,常常结合新发现的元素或同位素来考查,题目翻新,但题型不变,考查或同位素来考查,题目翻新,但题型不变,考查的知识点不变。解答这类试题时,一是要掌握好的知识点不变。解答这类试题时,一是要掌握好原子的组成和表示方法;二是要掌握好各基本粒原子的组成和表示方法;二是要掌握好各基本粒子之间的关系,即原子序数子之间的关系,即原子序数=核电荷数核电荷数=核内质子核内质子数数=核外电子数(原
7、子中)、质量数核外电子数(原子中)、质量数=中子数中子数+质质子数。子数。8 简单原子的原子结构可用如下图的表示方法形象地简单原子的原子结构可用如下图的表示方法形象地 表示:其中表示:其中表示质子或电子,表示质子或电子,表示中子,则下表示中子,则下 列有关列有关的叙述正确的是的叙述正确的是 ()A.互为同位素互为同位素 B.互为同素异形体互为同素异形体 C.是三种化学性质不同的粒子是三种化学性质不同的粒子 D.具有相同的质量数具有相同的质量数解析解析 从图示知从图示知、中的质子数等于电子数且中的质子数等于电子数且都等于都等于1 1,可知分别为,可知分别为 H H、H H、H H。1 11 12
8、 21 13 31 1A9 某元素的一种同位素某元素的一种同位素X的质量数为的质量数为A A,含,含N N个中个中 子,它与子,它与1H原子组成原子组成Hm mX分子。在分子。在a a g Hm mX中所含中所含 质子的物质的量是质子的物质的量是 ()A.(A A-N N+m m)mol B.(A A-N N)mol C.(A A-N N)mol D.(A A-N N+m m)mol解析解析 同位素同位素X X的质量数为的质量数为A A,中子数为,中子数为N N,因此其质,因此其质子数为子数为A A-N N。故。故H Hm mX X中的质子数为中的质子数为m m+A A-N N,又由于,又由于
9、 H Hm mX X中中H H为为 H H,故,故a a g H g Hm mX X中所含质子的物质的量为:中所含质子的物质的量为:(A A-N N+m m)molmol。1 11 1A10【例例2】用用A+、B-、C2-、D、E、F、G和和H分别表分别表 示含有示含有18个电子的八种微粒(离子或分子),请个电子的八种微粒(离子或分子),请 回答:回答:(1)A元素是元素是 、B元素是元素是 、C元素是元素是 (用元素符号表示)。(用元素符号表示)。(2)A元素的原子结构示意图为元素的原子结构示意图为 。(3)D是由两种元素组成的双原子分子,其分子式是由两种元素组成的双原子分子,其分子式 是是
10、 。(4)E是所有含是所有含18个电子的微粒中氧化能力最强的个电子的微粒中氧化能力最强的 分子,其分子式是分子,其分子式是 。考点二考点二 核外电子排布及等电子数的微粒核外电子排布及等电子数的微粒11(5)F是由两种元素组成的三原子分子,其分子式是由两种元素组成的三原子分子,其分子式 是是 ,电子式是,电子式是 。(6)G分子中含有分子中含有4个原子,其分子式是个原子,其分子式是 。(7)H分子中含有分子中含有8个原子,其分子式是个原子,其分子式是 。解析解析 含有含有1818个电子的微粒:个电子的微粒:单核微粒:单核微粒:ArAr、K K+、CaCa2+2+、ClCl-、S S2-2-,可见
11、可见A A+、B B-、C C2-2-分别为分别为K K+、ClCl-、S S2-2-;A;A、B B、C C元素分别为元素分别为K K、ClCl、S S。双原子分子有:双原子分子有:HClHCl、F F2 2,可见(可见(3 3)、()、(4 4)分别为)分别为HClHCl、F F2 2。三原子分子有:三原子分子有:H H2 2S S。12四原子分子有:四原子分子有:H H2 2O O2 2、PHPH3 3八原子分子有:八原子分子有:C C2 2H H6 6答案答案 (1)K Cl S (2)(3)HCl (4)F2 (5)H2S H S H(6)H2O2(答(答PH3同样给分)同样给分)(
12、7)C2H6 1.原子核外电子排布规律原子核外电子排布规律 (1)能量最低原理;()能量最低原理;(2)每一电子层最多排)每一电子层最多排2n n2个电子,最外层不超过个电子,最外层不超过8个电子(个电子(K层为最外层为最外层时不超过层时不超过2个),次外层不超过个),次外层不超过18个电子,倒个电子,倒数第三层不超过数第三层不超过32个电子。个电子。132.核外电子数相等的微粒核外电子数相等的微粒(1)“10电子电子”的微粒的微粒-2+4 414(2)“18电子电子”的微粒的微粒2-2+52+2+6 615 (3)其他等电子数的微粒)其他等电子数的微粒 “9电子电子”的微粒:的微粒:F、OH
13、、NH2、CH3(取代基)(取代基)“14电子电子”的微粒:的微粒:Si、N2、CO、C2H2“2电子电子”的微粒:的微粒:He、H-、Li+、Be2+、H2 (4)质子数及核外电子总数均相等的粒子)质子数及核外电子总数均相等的粒子 Na+、NH 、H3O+HS-、Cl-F-、OH-、NH N2、CO、C2H2+4-2 216 A、B分别为第三周期、第四周期同一主族的不同分别为第三周期、第四周期同一主族的不同 元素的原子,它们原子核内质子数均等于中子数。元素的原子,它们原子核内质子数均等于中子数。若若A为为A族,其质量数为族,其质量数为x x,则,则B的质子数为的质子数为Z;若若A为为A族,其
14、质子数为族,其质子数为y y,则,则B的质量数为的质量数为N。Z 和和N为为 ()A.Z:+18,N:2y y+18 B.N:+18,Z:2y y+18 C.Z:+8,N:2y y+36 D.N:+18,Z:2y y+36C17 已知某粒子的结构示意图为:已知某粒子的结构示意图为:请回答:请回答:(1)当)当x x-y y=10时,该粒子为时,该粒子为 (填(填“原子原子”、“阳离子阳离子”或或“阴离子阴离子”)。)。(2)当)当y y=8时,粒子可能为(不少于时,粒子可能为(不少于5种)种)。(3)写出)写出x x+y y=12与与x x+y y=16的元素最高价氧化物对的元素最高价氧化物对
15、 应水化物相互反应的离子方程式应水化物相互反应的离子方程式 。原子原子K+、Ca2+、Ar、S2-、Cl-等等Al(OH)3+OH-AlO +2H2O-218【例【例3】下列说法正确的是】下列说法正确的是 。在水中氢、氧原子间均以化学键相结合在水中氢、氧原子间均以化学键相结合 金属金属 和非金属化合形成离子键和非金属化合形成离子键 离子键是阳离子、离子键是阳离子、阴离子的相互吸引阴离子的相互吸引 两个非金属原子间不可能两个非金属原子间不可能 形成离子键形成离子键 非金属原子间不可能形成离子键非金属原子间不可能形成离子键 离子化合物中可能有共价键离子化合物中可能有共价键 共价化合物中可共价化合物
16、中可 能有离子键能有离子键考点三考点三 离子键、共价键的形成及特征离子键、共价键的形成及特征解析解析 看原子间是否形成化学键,需注意两个前提看原子间是否形成化学键,需注意两个前提条件:条件:“相邻相邻”“”“强烈强烈”。对于一个水分子内的。对于一个水分子内的H H、O O原子间以化学键结合,而水分子间相邻的原子间以化学键结合,而水分子间相邻的H H、O O原原子间则以分子间作用力(或氢键)结合,故子间则以分子间作用力(或氢键)结合,故错。错。19离子键的形成条件是活泼金属和活泼非金属间,并不离子键的形成条件是活泼金属和活泼非金属间,并不是所有的金属和非金属,如是所有的金属和非金属,如AlClA
17、lCl3 3则存在共价键,故则存在共价键,故错。离子键的本质是阴、阳离子的静电作用,这种错。离子键的本质是阴、阳离子的静电作用,这种静电作用包括静电吸引和静电排斥两个方面,故静电作用包括静电吸引和静电排斥两个方面,故错。错。两个非金属原子间往往以共用电子对结合而形成共价两个非金属原子间往往以共用电子对结合而形成共价键,难以通过得失电子而形成离子键,但非金属原子键,难以通过得失电子而形成离子键,但非金属原子间也可能形成离子键,如间也可能形成离子键,如NHNH4 4ClCl,故,故正确,正确,错误。离子化合物一定含有离子键,也可错误。离子化合物一定含有离子键,也可能含有共价键,如能含有共价键,如N
18、aOHNaOH固体中固体中NaNa+、OHOH-以离子键结合,以离子键结合,OHOH-中的中的O O、H H原子以共价键结合;共价化合物中一定原子以共价键结合;共价化合物中一定含有共价键,一定不含有离子键,故含有共价键,一定不含有离子键,故正确,正确,错误。错误。答案答案 20 1.物质中化学键的存在规律物质中化学键的存在规律 (1)离子化合物中一定有离子键)离子化合物中一定有离子键,可能还有共价键。可能还有共价键。如如(NH4)2SO4、NH4NO3、NaOH、Na2O2等。等。(2)共价化合物中只有共价键,一定没有离子键,)共价化合物中只有共价键,一定没有离子键,如如HCl、CH4、CO2
19、、H2SO4等。等。(3)在非金属单质中只有共价键,如)在非金属单质中只有共价键,如Cl2、O2、金、金刚石等。刚石等。(4)构成稀有气体的单质分子,由于原子已达到稳)构成稀有气体的单质分子,由于原子已达到稳定结构,是单原子分子,分子中不存在化学键。定结构,是单原子分子,分子中不存在化学键。(5)非金属元素的原子间也可以形成离子键,如)非金属元素的原子间也可以形成离子键,如NH4Cl中的中的NH 与与Cl-。+421 2.化学键与物质类别关系化学键与物质类别关系 (1)只含非极性共价键的物质:同种非金属元素)只含非极性共价键的物质:同种非金属元素构成的单质,如构成的单质,如I2、N2、P4、金
20、刚石、晶体硅等。、金刚石、晶体硅等。(2)只含有极性共价键的物质:一般是不同非金)只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物,如属元素构成的共价化合物,如HCl、NH3、SiO2、CS2等。等。(3)既有极性键又有非极性键的物质:如)既有极性键又有非极性键的物质:如H2O2、C2H2、CH3CH3、C6H6(苯)等。(苯)等。(4)只含有离子键的物质:活泼非金属元素与活)只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物,如泼金属元素形成的化合物,如Na2S、CsCl、K2O、NaH等。等。22 (5)既有离子键又有非极性键的物质,如)既有离子键又有非极性键的物质,
21、如Na2O2、CaC2等。等。(6)由强极性键构成但又不是强电解质的物质:)由强极性键构成但又不是强电解质的物质:如如HF。(7)只含有共价键,而无范德华力的化合物:)只含有共价键,而无范德华力的化合物:如原子晶体如原子晶体SiO2、SiC等。等。(8)无化学键的物质为稀有气体,如)无化学键的物质为稀有气体,如Ar等。等。23 下列各组给定原子序数的元素下列各组给定原子序数的元素,不能形成原子数之不能形成原子数之 比为比为1 1且含共价键的稳定化合物的是且含共价键的稳定化合物的是 ()A.3和和17 B.1和和8 C.1和和6 D.8和和11解析解析 首先根据原子序数写出各元素符号,再根据常首
22、先根据原子序数写出各元素符号,再根据常见组成的化合物,找出符合题意要求的化合物。见组成的化合物,找出符合题意要求的化合物。A A项项形成的形成的LiClLiCl为离子化合物,不存在共价键;为离子化合物,不存在共价键;B B项可形项可形成成H H2 2O O2 2;C C项可形成项可形成C C2 2H H2 2、C C6 6H H6 6等物质;等物质;D D项可形成项可形成NaNa2 2O O2 2,其结构中既含离子键也含共价键。,其结构中既含离子键也含共价键。A24 固体固体A的化学式为的化学式为NH5,它的所有原子的最外层都,它的所有原子的最外层都 符合相应稀有气体原子的最外电子层结构,则下
23、列符合相应稀有气体原子的最外电子层结构,则下列 有关说法中,不正确的是有关说法中,不正确的是 ()A.1 mol NH5中含有中含有5N NA A个个NH键(键(N NA A表示阿伏加表示阿伏加 德罗常数)德罗常数)B.NH5中既有共价键又有离子键,它形成的晶体是中既有共价键又有离子键,它形成的晶体是 离子晶体离子晶体 C.NH5的电子式为的电子式为H N H+H -D.它与水反应的化学方程式为它与水反应的化学方程式为 NH5+H2O NH3H2O+H2 HH 25解析解析 因为它所有的原子最外层都符合相应稀有气体因为它所有的原子最外层都符合相应稀有气体原子的最外层电子层结构,即原子的最外层电
24、子层结构,即2 2个或个或8 8个。假设个。假设A A正确正确的话,对的话,对N N原子来说,最外层应是原子来说,最外层应是1010个电子,不合题个电子,不合题意。其他选项均符合题意,且一致。故选意。其他选项均符合题意,且一致。故选A A。答案答案 A26高考失分警示高考失分警示 1.高考题常以制取或发现的新物质、新元素或特高考题常以制取或发现的新物质、新元素或特征用途的物质作为背景材料,进行有关原子结构的判征用途的物质作为背景材料,进行有关原子结构的判断和计算,考生容易出现的问题是看不到新物质与常断和计算,考生容易出现的问题是看不到新物质与常见物质的本质的相同点,被新情境所迷惑。如见物质的本
25、质的相同点,被新情境所迷惑。如:(1)O4、N5等其实它们分别属氧和氮元素的一等其实它们分别属氧和氮元素的一种单质,种单质,O4与与O2、O3,N5与与N2属于同素异形体。属于同素异形体。(2)NH5其电子式应为其电子式应为H N H+H-,属离子化合物,与属离子化合物,与H2O反应生成反应生成NH3H2O和和H2。HN3与与NH3同属共价化合物。同属共价化合物。HH 27 (3)氦元素在地球上主要以)氦元素在地球上主要以 He形式存在,而形式存在,而在月球上丰富存在的是在月球上丰富存在的是 He,两种原子差别就是中子,两种原子差别就是中子数不同,属同位素。数不同,属同位素。2.由极性键所组成
26、的分子可以是极性分子,也可由极性键所组成的分子可以是极性分子,也可以是非极性分子,这主要取决于分子的对称性,如果以是非极性分子,这主要取决于分子的对称性,如果分子属于对称性分子,则应该为非极性分子,如分子属于对称性分子,则应该为非极性分子,如CO2、CH4、BF3等;反之则应为极性分子,如等;反之则应为极性分子,如NH3、H2O等。等。3.(1)氢键属于分子间作用力,其强度介于化)氢键属于分子间作用力,其强度介于化学键和范德华力之间,如学键和范德华力之间,如NH3、H2O、HF等分子间存等分子间存在氢键。在氢键。(2)稀有气体粒子是单原子分子、原子间作用)稀有气体粒子是单原子分子、原子间作用力
27、是范德华力,故其晶体为分子晶体。力是范德华力,故其晶体为分子晶体。4.活泼金属与活泼非金属形成的化合物不一定属活泼金属与活泼非金属形成的化合物不一定属于离子化合物,如于离子化合物,如AlCl3属共价化合物。属共价化合物。4232281.P是我国最近合成的一种新核素,是我国最近合成的一种新核素,P表示的磷原表示的磷原 子是子是 ()A.核外有核外有25个电子,其中有个电子,其中有5个电子能参与成键个电子能参与成键 B.P是一种新元素是一种新元素 C.核内有核内有15个质子,核外有个质子,核外有10个电子个电子 D.质量数为质量数为25,原子序数为,原子序数为15,核内有,核内有10个中子个中子2
28、51525152515解析解析 原子一般由质子、中子、电子构成,本题以原子一般由质子、中子、电子构成,本题以 P P为素材,考查学生对同位素中各粒子个数关系的为素材,考查学生对同位素中各粒子个数关系的了解。原子结构是高考出现频率极高的内容,此类了解。原子结构是高考出现频率极高的内容,此类问题概念性强、计算简单,预计今年高考选择题中问题概念性强、计算简单,预计今年高考选择题中仍会出现这类内容。仍会出现这类内容。251529 P P原子核外只有原子核外只有1515个电子,有个电子,有5 5个电子能参与成个电子能参与成 键,键,A A项中前一句错误,后一句正确;项中前一句错误,后一句正确;P P只是
29、一只是一 种新核素,不是新元素,种新核素,不是新元素,B B项错误;项错误;P P的质子数的质子数 为为1515,核外电子数为,核外电子数为1515,C C项错误;原子符号左项错误;原子符号左 上角标出的是质量数,其值等于质子数与中子上角标出的是质量数,其值等于质子数与中子 数之和,故核内中子数为数之和,故核内中子数为1010,选,选D D。2525151525251515252515152.下列反应过程中,同时有离子键、极性共价键下列反应过程中,同时有离子键、极性共价键 和非极性共价键的断裂和形成的反应是和非极性共价键的断裂和形成的反应是 ()A.NH4Cl NH3+HCl B.NH3+CO
30、2+H2O NH4HCO3答案答案 D30C.2NaOH+Cl2 NaCl+NaClO+H2OD.2Na2O2+2CO2 2Na2CO3+O2解析解析 本题以四个化学反应为载体综合考查了学生本题以四个化学反应为载体综合考查了学生对离子键、极性共价键和非极性共价键的认识程度。对离子键、极性共价键和非极性共价键的认识程度。A A、B B中无非极性键的断裂和形成;中无非极性键的断裂和形成;C C中有非极性键中有非极性键(Cl-ClCl-Cl)的断裂但无非极性键的形成;)的断裂但无非极性键的形成;D D中中NaNa2 2O O2 2既有离子键又有非极性共价键,既有离子键又有非极性共价键,COCO2 2
31、中有极性共价中有极性共价键,键,O O2 2中有非极性共价键,故选中有非极性共价键,故选D D。答案答案 D313.下列有关化学键与晶体结构说法正确的是下列有关化学键与晶体结构说法正确的是()A.两种元素组成的分子中一定只有极性键两种元素组成的分子中一定只有极性键 B.离子化合物的熔点一定比共价化合物的高离子化合物的熔点一定比共价化合物的高 C.非金属元素组成的化合物一定是共价化合物非金属元素组成的化合物一定是共价化合物 D.含有阴离子的化合物一定含有阳离子含有阴离子的化合物一定含有阳离子解析解析 由两种元素组成的双原子分子只含极性键,但由两种元素组成的双原子分子只含极性键,但多原子分子就不一
32、定,如多原子分子就不一定,如H H2 2O O2 2中就含有中就含有OOOO非极性键,非极性键,所以所以A A错;共价化合物中有些熔点很高如原子晶体,错;共价化合物中有些熔点很高如原子晶体,B B错;由非金属元素组成的化合物不一定全是共价化合错;由非金属元素组成的化合物不一定全是共价化合物,如物,如NHNH4 4ClCl是离子化合物,是离子化合物,C C错;根据物质所含正负错;根据物质所含正负电荷相等判断电荷相等判断D D正确。正确。D324.今有今有A、B两种原子,两种原子,A原子的原子的M层比层比B原子的原子的M层层 少少3个电子,个电子,B原子的原子的L层电子数恰为层电子数恰为A原子原子
33、L层电层电 子数的子数的2倍。倍。A和和B分别是分别是 ()A.硅原子和钠原子硅原子和钠原子 B.硼原子和氮原子硼原子和氮原子 C.氯原子和碳原子氯原子和碳原子 D.碳原子和铝原子碳原子和铝原子解析解析 本题考查学生对原子核外电子排布规律的理本题考查学生对原子核外电子排布规律的理解和综合运用能力。解和综合运用能力。设设x x、y y分别为原子分别为原子A A的的L L、M M两层的电子数,依题意,两层的电子数,依题意,A A、B B两原子的电子层结构为:两原子的电子层结构为:33 K L M K L MA 2 x yx yB 2 2x x y y+3原子原子B B的的M M层至少有层至少有3
34、3个电子,因而其个电子,因而其L L层的电子数必然层的电子数必然是是8 8个,求得个,求得x x=4=4。对于原子。对于原子A A来说,来说,L L层有层有4 4个电子的个电子的只能是最外层,即只能是最外层,即y y=0=0,y y+3=3+3=3。因此,这两个原子。因此,这两个原子为:为:K L MK L MA A 2 4 0 A A是碳原子是碳原子B B 2 8 3 B B是铝原子是铝原子答案答案 D345.通常情况下,微粒通常情况下,微粒A和和B为分子,为分子,C和和E为阳离子,为阳离子,D为阴离子,它们都含有为阴离子,它们都含有10个电子;个电子;B溶于溶于A后所后所 得的物质可电离出
35、得的物质可电离出C和和D;A、B、E三种微粒反应三种微粒反应 后可得后可得C和一种白色沉淀。请回答:和一种白色沉淀。请回答:(1)用化学符号表示下列)用化学符号表示下列4种微粒:种微粒:A:;B:;C:;D:。(2)写出)写出A、B、E三种微粒反应的离子方程式:三种微粒反应的离子方程式:。35解析解析 常见的常见的1010电子分子有电子分子有H H2 2O O、NHNH3 3、CHCH4 4、HFHF等,常等,常见的见的1010电子阳离子有电子阳离子有NaNa+、MgMg2+2+、AlAl3+3+、NH NH、H H3 3O O+,常常见的见的1010电子阴离子有电子阴离子有F F-、OHOH
36、-,根据,根据“B“B溶于溶于A A后所得后所得的物质可电离出的物质可电离出C C和和D”D”,可推出,可推出A A为为H H2 2O O、B B为为NHNH3 3、C C为为NH NH、D D为为OHOH-,再根据,再根据A A、B B、E E反应后可得反应后可得C C和一种和一种白色沉淀,可推出白色沉淀,可推出E E为为MgMg2+2+或或AlAl3+3+,从而得出答案。从而得出答案。+4 4+4 4答案答案 (1)H2O NH3 NH OH-(2)Al3+3NH3+3H2O Al(OH)3+3NH 或或Mg2+2NH3+2H2O Mg(OH)2+2NH +4 4+4 4+4 4361.中
37、国地质大学郑建平教授借助同位素测定方法,发中国地质大学郑建平教授借助同位素测定方法,发 现了一块来自现了一块来自36亿年前地球亿年前地球20 km30 km深处的深处的 地壳岩石,为人类研究地球早期形成及演化提供了地壳岩石,为人类研究地球早期形成及演化提供了 极为重要的科学依据。同位素测定方法中应用较多极为重要的科学依据。同位素测定方法中应用较多 的是的是13C、15N分析方法,下列关于分析方法,下列关于13C、15N的叙述的叙述 中正确的是中正确的是 ()A.13C、15N具有相同的中子数具有相同的中子数 B.0.012 kg13C所含碳原子数为阿伏加德罗常数的所含碳原子数为阿伏加德罗常数的
38、 数值数值 C.等物质的量的等物质的量的13C17O和和15N2两种气体具有相同的两种气体具有相同的 质子数、原子数和质量质子数、原子数和质量 D.13C和和C60、15N和和N70分别互为同位素分别互为同位素37 解析解析 A A项中项中1313C C、1515N N具有的中子数分别为具有的中子数分别为7 7、8 8,故,故 A A错误;错误;B B项中应为项中应为1212C C,故,故B B错误;错误;D D项中同位素针项中同位素针 对原子而言,不是单质,故对原子而言,不是单质,故D D错误。错误。答案答案 C2.下列关于指定粒子构成的叙述中,不正确的下列关于指定粒子构成的叙述中,不正确的
39、 是是 ()A.37Cl与与39K具有相同的中子数具有相同的中子数 B.第第114号元素的一种核素号元素的一种核素 X与与 Pb具有具有 相同的最外层电子数相同的最外层电子数 C.H3O+与与OH-具有相同的质子数和电子数具有相同的质子数和电子数 D.O 与与S2-具有相同的质子数和电子数具有相同的质子数和电子数2-2298114207 8238解析解析 3737ClCl和和3939K K具有的中子数都是具有的中子数都是2020,A A正确;正确;X X与与 Pb Pb的核电荷数之差为的核电荷数之差为114-82=32114-82=32,即相差一个电子,即相差一个电子层,属于同一主族元素,最外
40、层有相同的电子数,层,属于同一主族元素,最外层有相同的电子数,B B正确;正确;H H3 3O+O+与与OHOH-具有相同的电子数但质子数不同,具有相同的电子数但质子数不同,C C错误;错误;O O 与与S S2-2-的电子数都是的电子数都是1818,质子数都是,质子数都是1616,D D正确。故选正确。故选C C。298298114114207207 82 82答案答案 C2-2-2 2393.A、B两原子分别获得两个电子形成两原子分别获得两个电子形成8电子稳定结构电子稳定结构 时,时,A放出的能量大于放出的能量大于B放出的能量。放出的能量。C、D两原子两原子 分别失去一个电子形成分别失去一
41、个电子形成8电子稳定结构时,电子稳定结构时,D吸收吸收 的能量大于的能量大于C吸收的能量。则吸收的能量。则B、A和和C、D分别形分别形 成的化合物,属于离子化合物的可能性最大的是成的化合物,属于离子化合物的可能性最大的是 ()A.C2A B.C2B C.D2A D.D2B解析解析 由题意可知,由题意可知,A A、B B为为AA族元素,且非金属性族元素,且非金属性ABAB。C C、D D为为AA族元素,且金属性族元素,且金属性CDCD。故属于离。故属于离子化合物的可能性最大的是子化合物的可能性最大的是C C2 2A A,选,选A A项。项。A404.我国探月的目的之一是探测月球土壤厚度和我国探月
42、的目的之一是探测月球土壤厚度和 He 的储量。的储量。He是最安全最清洁的能源,地球上仅有是最安全最清洁的能源,地球上仅有 15 t左右,而月球上的左右,而月球上的 He估计在估计在1.01061.5 106 t。地球上氦元素主要以。地球上氦元素主要以 He的形式存在。已的形式存在。已 知一个知一个12C原子的质量为原子的质量为a a g,一个,一个 He原子的质量原子的质量 为为b b g,N NA A为阿伏加德罗常数。下列说法正确的是为阿伏加德罗常数。下列说法正确的是 ()A.He和和 He互为同素异形体互为同素异形体 B.氦元素的近似相对原子质量为氦元素的近似相对原子质量为3 C.He的
43、相对原子质量为的相对原子质量为 D.He的摩尔质量为的摩尔质量为2bNbNA A32323242323232324241解析解析 A A中中 He He与与 He He互为同位素;互为同位素;B B中氦元素的近似相中氦元素的近似相对原子质量是由各核素的质量数和各核素在自然界中对原子质量是由各核素的质量数和各核素在自然界中的原子百分含量(丰度)共同决定的,现不知道丰度的原子百分含量(丰度)共同决定的,现不知道丰度的值,因此不能计算氦元素的近似相对原子质的值,因此不能计算氦元素的近似相对原子质量;量;D D中中 He He的摩尔质量应为的摩尔质量应为bNbNA A g/mol g/mol。3242
44、32答案答案 C425.已知已知X、Y是原子核电荷数不大于是原子核电荷数不大于18的元素。的元素。X原原 子的最外层电子数为子的最外层电子数为a a,次外层电子数为,次外层电子数为a a+2;Y原原 子的最外层电子数为子的最外层电子数为b b-5,次外层电子数为,次外层电子数为b b。判。判断断 X、Y两元素形成化合物组成是两元素形成化合物组成是 ()A.XY2 B.Y4X C.Y2X3 D.YX3解析解析 X X、Y Y的次外层(的次外层(a a0,0,a a+23;+23;b b-50,-50,b b55)不)不可能是可能是K K层,即最外层为第层,即最外层为第3 3层(层(X X、Y Y
45、核电荷数小于核电荷数小于1818),这样得出),这样得出X X核外电子排布为核外电子排布为2 2、8 8、6 6,为硫,为硫,Y Y核外电子排布为核外电子排布为2 2、8 8、3 3,为铝,形成化合物为,为铝,形成化合物为AlAl2 2S S3 3,所以选所以选C C。C436.在第在第n n电子层中,当它作为原子的最外层时,其最电子层中,当它作为原子的最外层时,其最 多容纳的电子数与第(多容纳的电子数与第(n n-1)层相同,当它作为原)层相同,当它作为原 子的次外层时,其最多容纳的电子数比(子的次外层时,其最多容纳的电子数比(n n-1)层)层 最多能多最多能多10个,此电子层是个,此电子
46、层是 ()A.K层层 B.L层层 C.M层层 D.N层层 解析解析 第第n n电子层作为原子最外层时,最多容纳电子电子层作为原子最外层时,最多容纳电子数为数为8 8(K K层最多层最多2 2个),作为原子次外层时,最多容个),作为原子次外层时,最多容纳电子数为纳电子数为1818。根据核外电子排布规律,最外层不。根据核外电子排布规律,最外层不超过超过8 8个电子,次外层不超过个电子,次外层不超过1818个电子,而个电子,而K K层最多层最多可容纳可容纳2 2个电子,个电子,L L层最多可容纳层最多可容纳8 8个电子,个电子,44M M层最多可容纳层最多可容纳1818个电子。当个电子。当n n层为
47、最外层时,最多可层为最外层时,最多可容纳容纳8 8个电子,则第(个电子,则第(n n-1-1)层也可容纳)层也可容纳8 8个电子,而个电子,而(n n-1-1)层为次外层,则)层为次外层,则n n层应为层应为M M层;当层;当n n层为次外层为次外层时,其最多容纳的电子数比(层时,其最多容纳的电子数比(n n-1-1)层多)层多1010个,则个,则证明证明n n层最多可容纳层最多可容纳1818个电子,也就为个电子,也就为M M层。层。7.NaH是一种离子化合物是一种离子化合物,它跟水反应的方程式为它跟水反应的方程式为:NaH+H2O NaOH+H2,它也能跟液氨、乙醇等它也能跟液氨、乙醇等 发
48、生类似的反应,并都产生氢气。下列有关发生类似的反应,并都产生氢气。下列有关NaH 的叙述错误的是的叙述错误的是 ()答案答案 C45A.跟水反应时,水作氧化剂跟水反应时,水作氧化剂B.NaH中中H-半径比半径比Li+半径小半径小C.跟液氨反应时,有跟液氨反应时,有NaNH2生成生成D.跟乙醇反应时,跟乙醇反应时,NaH被氧化被氧化解析解析 将将NaH+HNaH+H2 2O NaOH+HO NaOH+H2 2的信息上升至的信息上升至NaHNaH与液与液氨、乙醇反应。氨、乙醇反应。NaH+NHNaH+NH3 3 NaNHNaNH2 2+H+H2 2、NaH+CNaH+C2 2H H5 5OHOH
49、C C2 2H H5 5ONa+HONa+H2 2。据。据NaH+HNaH+H2 2O NaOH+HO NaOH+H2 2化合价变化合价变 化,可知化,可知A A、C C、D D均正确。均正确。H H-与与LiLi+核外电子数相同,核外电子数相同,但但H H-核电荷数小,故核电荷数小,故H H-半径大于半径大于LiLi+半径。半径。答案答案 B-1+10 0468.R为短周期元素,其原子所具有的电子层数为最外为短周期元素,其原子所具有的电子层数为最外 层电子数的层电子数的1/2。它可能形成的含氧酸根离子有。它可能形成的含氧酸根离子有 R2O 、RO 、R2O 、RO 。下列判断正。下列判断正
50、确的是确的是 ()A.当它形成当它形成时,不可能形成时,不可能形成 B.当它形成当它形成时,可以形成时,可以形成 C.当它形成当它形成时,不可能形成时,不可能形成 D.当它形成当它形成时,可以形成时,可以形成解析解析 短周期元素中,短周期元素中,电子层数为最外层电子数的电子层数为最外层电子数的1/21/2的元素有碳和硫,二者有相同的化合价,但也的元素有碳和硫,二者有相同的化合价,但也有不同的化合价。如:碳可以形成有不同的化合价。如:碳可以形成CO CO、C C2 2O(O(草酸草酸根根)等,而硫可以形成等,而硫可以形成SO SO、SO SO 和和S S2 2O(O(硫代硫酸根硫代硫酸根)等。等
51、。2-42-42-32-32-32-42-42-32-3BC479.不具有放射性的同位素称之为稳定同位素,稳定同不具有放射性的同位素称之为稳定同位素,稳定同 位素分析法在近位素分析法在近20年来植物生理学、生态学和环年来植物生理学、生态学和环 境科学研究中获得广泛应用。如在陆地生态系统研境科学研究中获得广泛应用。如在陆地生态系统研 究中,究中,2H、13C、15N、18O、34S等常用作环境分析等常用作环境分析 指示物。下列有关说法正确的是指示物。下列有关说法正确的是 ()A.34S原子核内中子数为原子核内中子数为16 B.1H216O和和1H218O的相对分子质量不同的相对分子质量不同 C.
52、13C和和15N原子核内的质子数相差原子核内的质子数相差2 D.2H+结合结合OH-的能力比的能力比1H+的更强的更强解析解析 A A项中项中3434S S的中子数为的中子数为1818,不正确;,不正确;B B项中项中H H2 2O O的的相对分子质量由相对分子质量由H H和和O O的质量数决定,两个分子中的质量数决定,两个分子中O O的的质量数不同,故质量数不同,故B B项正确;项正确;C C项中原子序数之差项中原子序数之差由质由质48子数决定,应该为子数决定,应该为1 1,C C项不正确;项不正确;D D中中2H2H+和和1 1H H+化学性化学性质相同,故质相同,故D D项不正确。项不正
53、确。10.闪电时空气中有臭氧生成,下列说法正确的是闪电时空气中有臭氧生成,下列说法正确的是 ()A.O3和和O2互为同位素互为同位素 B.O2比比O3稳定稳定 C.等体积等体积O3和和O2含有相同质子数含有相同质子数 D.O3与与O2的相互转变是物理变化的相互转变是物理变化答案答案 B解析解析 O O2 2和和O O3 3应属于同素异形体而不是同位素,应属于同素异形体而不是同位素,A A错;等体积的错;等体积的O O3 3和和O O2 2具有相同分子数,原子数具有相同分子数,原子数O O3 3比比O O2 2多,因此质子数也多,多,因此质子数也多,C C错;错;O O3 3与与O O2 2的相
54、互转的相互转化属化学变化,化属化学变化,D D错。错。B4911.据中国石油网报道,加利福尼亚大学的研究人员据中国石油网报道,加利福尼亚大学的研究人员 发现了世界上最强的酸,这种强酸的化学式是发现了世界上最强的酸,这种强酸的化学式是 CB11H6Cl6,结构式如图所示,由,结构式如图所示,由11个硼原子和个硼原子和1 个碳原子排列成个碳原子排列成20面体。该强酸中原子间的化学面体。该强酸中原子间的化学 键类型是键类型是 ()50A.只有共价键只有共价键B.只有离子键只有离子键C.既有离子键又有共价键既有离子键又有共价键D.是一种介于共价键与离子键之间的一种键是一种介于共价键与离子键之间的一种键
55、解析解析 题目提示这是一种酸,联系所学酸的类型题目提示这是一种酸,联系所学酸的类型可知,酸为共价化合物,共价化合物中不可能可知,酸为共价化合物,共价化合物中不可能有离子键,只有共价键。有离子键,只有共价键。答案答案 A5112.A、B、C、D、E五种元素,它们的核电荷数依五种元素,它们的核电荷数依 次增大,且都小于次增大,且都小于20。其中。其中A为非金属元素,为非金属元素,C 是金属元素;是金属元素;A、C元素原子的最外层都只有一个元素原子的最外层都只有一个 电子;电子;B和和D元素原子的最外层电子数相同,且元素原子的最外层电子数相同,且B 元素原子元素原子L层电子数是层电子数是K层电子数的
56、层电子数的3倍,倍,E元素原元素原 子最外层电子数比次外层电子数少子最外层电子数比次外层电子数少1。回答下列问。回答下列问 题:题:(1)A有有 种核素,其中质子数是中子数种核素,其中质子数是中子数 的核素名称为的核素名称为 ,是用于制造,是用于制造 的原料。的原料。(2)C的离子结构示意图为的离子结构示意图为 。(3)E的原子结构示意图为的原子结构示意图为 。(4)A、B、C、D组成化合物的化学式为组成化合物的化学式为 。52解析解析 由由A A是最外层电子数为是最外层电子数为1 1的非金属元素,知的非金属元素,知A A为为氢元素;由氢元素;由B B元素原子元素原子L L层电子数是层电子数是
57、K K层电子数的层电子数的3 3倍,倍,知知B B为氧元素;为氧元素;D D和和B B元素原子的最外层电子数相同,元素原子的最外层电子数相同,核电荷数小于核电荷数小于2020,知,知D D为硫元素;由为硫元素;由C C的核电荷数介于的核电荷数介于B B(O O)与)与D D(S S)之间,其原子的最外层电子数为)之间,其原子的最外层电子数为1 1,知知C C为钠元素;由为钠元素;由E E的核电荷数大于的核电荷数大于D D(S S)而小于)而小于2020,且该元素原子最外层电子数比次外层电子数少且该元素原子最外层电子数比次外层电子数少1 1,知,知E E为氯元素。为氯元素。答案答案 (1)3 氚
58、氚 氢弹氢弹 (2)(3)(4)NaHSO4(或或NaHSO3)5313.现有部分元素的原子结构特点如表:现有部分元素的原子结构特点如表:XL层电子数是层电子数是K层电子数的层电子数的3倍倍Y核外电子层数等于原子序数核外电子层数等于原子序数ZL层电子数是层电子数是K层和层和M层电子数之和层电子数之和W共用三对电子形成双原子分子,常温共用三对电子形成双原子分子,常温下为气体单质下为气体单质54(1)画出)画出W原子结构示意图原子结构示意图 。(2)元素)元素X与元素与元素Z相比,非金属性较强的是相比,非金属性较强的是 ,写出一个能表示写出一个能表示X、Z非金属性强弱关系的化学反应非金属性强弱关系
59、的化学反应 方程式方程式 。(3)X、Y、Z、W四种元素形成的一种离子化合四种元素形成的一种离子化合 物,其水溶液显强酸性,该化合物的化学式为物,其水溶液显强酸性,该化合物的化学式为 。(4)元素)元素X和元素和元素Y以原子个数比以原子个数比1 1化合形成的化化合形成的化合物合物Q,元素,元素W和元素和元素Y化合形成的化合物化合形成的化合物M,Q和和M的电子总数相等。以的电子总数相等。以M为燃料,为燃料,Q为氧化剂,可做为氧化剂,可做 火火箭推进剂,最终生成无毒的,且在自然界中稳定存在箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式的物质,写出该反应的化学方程式 。
60、55解析解析 L L层电子数是层电子数是K K层电子数的层电子数的3 3倍,即倍,即L L层有层有6 6个电个电子,故子,故X X为氧元素;核外电子层数等于原子序数的元为氧元素;核外电子层数等于原子序数的元素只有氢,故素只有氢,故Y Y为氢元素;为氢元素;Z Z元素的元素的K K、L L层分别有层分别有2 2个个和和8 8个电子,则个电子,则M M层上有层上有6 6个电子,故个电子,故Z Z为硫元素;常温为硫元素;常温下为气态双原子分子,且原子间以叁键结合的只有下为气态双原子分子,且原子间以叁键结合的只有N N2 2,故,故W W为氮元素。问题(为氮元素。问题(2 2)中能说明氧比硫非金属性)
61、中能说明氧比硫非金属性强的事实有很多,其中较为直观的是强的事实有很多,其中较为直观的是O O2 2置换置换H H2 2S S中的中的S S。问题(问题(4 4)中)中H H、O O形成的原子个数比为形成的原子个数比为1111的化合物的化合物是是H H2 2O O2 2,N N、H H形成的化合物分子中电子数也为形成的化合物分子中电子数也为1818的分的分子只能是子只能是N N2 2H H4 4。答案答案 (1)56 (2)X(或氧或氧)2H2S+O2 2H2O+2S (3)NH4HSO4 (4)N2H4+2H2O2 N2+4H2O点燃点燃14.科学家们在探索生命奥秘的过程中,认识到生科学家们在
62、探索生命奥秘的过程中,认识到生 命细胞的组成和元素周期律有着密切的关系,命细胞的组成和元素周期律有着密切的关系,约占人体总质量约占人体总质量99.97%的的11种大量元素全种大量元素全 部位于周期表前部位于周期表前20号元素,其余号元素,其余0.03%是由十是由十 多种人体不可缺少的微量元素组成的。现有多种人体不可缺少的微量元素组成的。现有 ag 7种短周期元素种短周期元素,是除氧、硫、钾、钙外是除氧、硫、钾、钙外 的其他大量元素的其他大量元素,它们在周期表中的位置如下。它们在周期表中的位置如下。据此完成下列问题:据此完成下列问题:57(1)元素的原子间反应最容易形成离子键的是下列)元素的原子
63、间反应最容易形成离子键的是下列 中的中的 ,元素的原子间反应容易形成共,元素的原子间反应容易形成共价键的是下列中的价键的是下列中的 。A.c和和f B.b和和g C.d和和g D.b和和e(2)下列由)下列由ag形成的各分子中所有原子都满足最形成的各分子中所有原子都满足最 外层为外层为8电子结构的是电子结构的是 ()A.ea3 B.ag C.fg3 D.dg458(3)均由)均由a、b、h和氧四种元素形成的两种离子化和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体。这两种合物,相互反应可生成有刺激性气味的气体。这两种化合物中有一种式量为化合物中有一种式量为120,该化合物熔化
64、时破坏的,该化合物熔化时破坏的是是 (填化学键类型,下同),溶于水(填化学键类型,下同),溶于水时破坏的是时破坏的是 。解析解析 由元素在周期表中的位置可推知:由元素在周期表中的位置可推知:a a为为H H,b b为为Na,cNa,c为为MgMg,d d为为C C,e e为为N N,f f为为P P,g g为为Cl,hCl,h为为S S。(1 1)非金属性最强的)非金属性最强的ClCl和金属性最强的和金属性最强的NaNa最易形成最易形成离子键,故选离子键,故选B B。非金属元素间易形成共价键,而四。非金属元素间易形成共价键,而四个组合中只有碳氯完全为非金属元素,故选个组合中只有碳氯完全为非金属
65、元素,故选C C。(2 2)写出各选项所对应的分子,其中)写出各选项所对应的分子,其中NHNH3 3和和HClHCl中的中的氢不是氢不是8 8电子结构,只有电子结构,只有C C、D D符合题意。符合题意。59(3 3)均由)均由H H、NaNa、S S、O O四种元素构成的能相互反应的四种元素构成的能相互反应的离子化合物猜测是离子化合物猜测是NaHSONaHSO3 3和和NaHSONaHSO4 4,其中式量为,其中式量为120120的为的为NaHSONaHSO4 4,熔化时破坏的是离子键熔化时破坏的是离子键,电离方程式为:电离方程式为:NaHSONaHSO4 4 NaNa+HSO+HSO;溶于
66、水时破坏的是离子键和共价;溶于水时破坏的是离子键和共价键:键:NaHSONaHSO4 4 NaNa+H+H+SO+SO。-42-415.在在2008年初我国南方遭遇的冰雪灾害中,使用年初我国南方遭遇的冰雪灾害中,使用 了一种融雪剂,其主要成分的化学式为了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前均为周期表前20号元素,其阳离子和阴离号元素,其阳离子和阴离 子的电子层结构相同,且子的电子层结构相同,且1 mol XY2含有含有54 mol 电子。电子。答案答案 (1)B C (2)CD(3)离子键)离子键 离子键和共价键离子键和共价键60(1)该融雪剂的化学式是)该融雪剂的化学式是 ;X与氢元素与氢元素 形成的化合物的电子式是形成的化合物的电子式是 。(2)元素)元素D、E原子的最外层电子数是其电子层数原子的最外层电子数是其电子层数 的的2倍,倍,D与与Y相邻,则相邻,则D的离子结构示意图是的离子结构示意图是 ;D与与E能形成一种非极性分子,能形成一种非极性分子,该分子的结构式为该分子的结构式为 ;D所在族元素的所在族元素的 氢化物中,沸点最低的是氢化物中,沸点最低的是
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
