 高三化学一轮复习第一章从实验学化学本章体系构建课件
高三化学一轮复习第一章从实验学化学本章体系构建课件


《高三化学一轮复习第一章从实验学化学本章体系构建课件》由会员分享,可在线阅读,更多相关《高三化学一轮复习第一章从实验学化学本章体系构建课件(23页珍藏版)》请在装配图网上搜索。
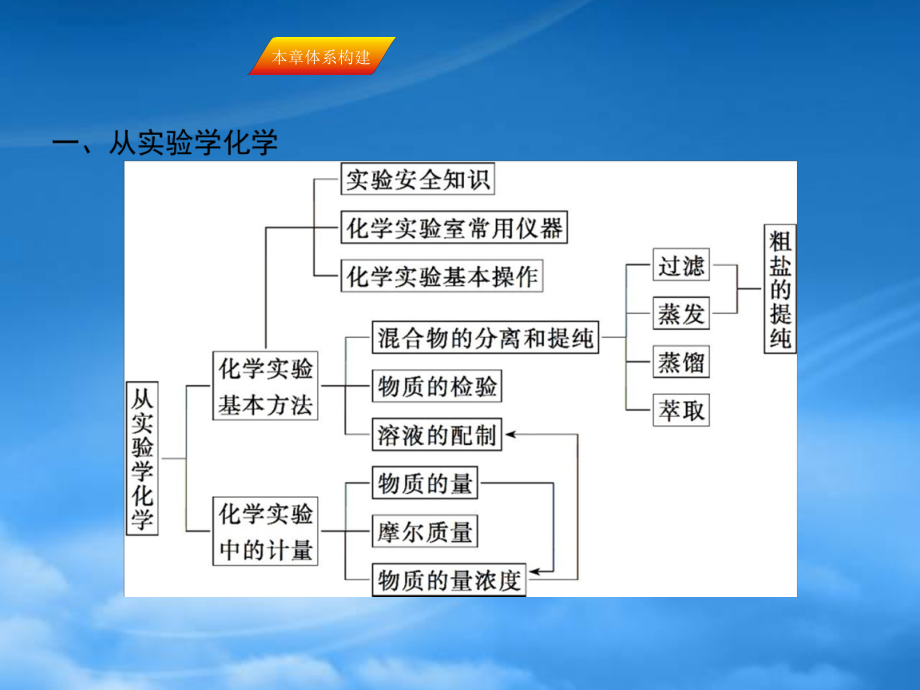
1、本章体系构建本章体系构建基础专题整合【对点训练对点训练】(2015湘中名校湘中名校)柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。盐体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K、Mg2+、Br-、SO2-4、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:请根据以上流程,回答相关问题:(1)操作是_;操作是_;操作是_;操作所需要的玻璃仪器有_。(2)参照如图所示溶解度曲线,欲得到较纯净的氯化钾晶体需用少量的_(填“热水”或“冷水”)洗涤固体_(填“A”或“B”)。(3)在实验室常用减压的方法进行过
2、滤,俗称抽滤,试猜想这种过滤方法的优点是_。解析:开始加的氧化剂将Br-氧化生成Br2,由加入的CCl4可知,是用萃取剂萃取Br2,所以操作是萃取;将CCl4层和水层分开的过程叫做分液;利用蒸馏(操作)从溴的CCl4溶液中分离得到CCl4和液溴。由溶解度图像可知,将得到的溶液进行蒸发浓缩至90 后进行结晶,再将固体和液体进行分离的操作叫过滤,此时所用的玻璃仪器有玻璃棒、烧杯、漏斗;在90 时得到的固体A为MgSO4,而30 时得到的固体B为KCl,所以应用冷水洗涤固体B,才可以得到较纯净的氯化钾。在减压条件下进行过滤,可使过滤的速度加快。答案:(1)萃取分液蒸馏玻璃棒、漏斗、烧杯(2)冷水 B
3、 (3)过滤速度快基础专题整合化学计算中的常用方法化学计算中的常用方法一、差量法一、差量法1.所谓“差量”就是指反应过程中反应物的某种物理量之和(始态量)与同一状态下生成物的相同物理量之和(终态量)的差,这种物理量可以是质量、物质的量、气体体积、气体压强、反应过程中的热效应等。2.计算依据:化学反应中反应物或生成物的量与差量成正比。3.解题关键:一是明确产生差量的原因,并能根据方程式求出理论上的差值(理论差量)。二是结合题中的条件求出或表示出实际的差值(实际差量)。4.差量法的类型及应用(1)体积差法【对点训练】(2015成都模拟成都模拟)16 mL由NO与NH3组成的混合气体在催化剂作用下于
4、400 左右可发生反应:6NO4NH35N26H2O(g),达到平衡时在相同条件下气体体积变为17.5 mL,则原混合气体中NO与NH3的物质的量之比有四种情况:5 3 3 2 4 3 9 7。下列正确的是()A.B.C.D.(2)质量差法【对点训练】(2015珠海调考)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是 ()A.84w2-53w1/31w1 B.84(w1-w2)/31w1C.73w2-42w1/31w1 D.115w2-84w1/31w11.解析:由于已知反应前后气体的总体积,故可用差量法直接求解。
5、6NO4NH3=5N26H2O(g)V(气体的体积差)6 mL 4 mL 5 mL 6 mL (56)-(46)1(mL)(理论差量)9 mL 6 mL 17.5-161.5(mL)(实际差量)由此知共消耗15 mL气体,还剩余1 mL气体,假设剩余的气体全部是NO,则V(NO)V(NH3)(9 mL1 mL)6 mL53,假设剩余的气体全部是NH3,则V(NO)V(NH3)9 mL(6 mL1 mL)97,但因反应是可逆反应,剩余气体实际上是NO、NH3的混合气体,故V(NO)V(NH3)介于53与97之间,对照所给的数据知32与43在此区间内。答案:C 2.解析:样品加热发生的反应为2Na
6、HCO3 Na2CO3H2OCO2 m168 106 62m(NaHCO3)g (w1-w2)g故样品中NaHCO3质量为168(w1-w2)/62g,样品中Na2CO3质量为w1 g-168(w1-w2)/62g,其质量分数为m(Na2CO3)/m(样品)答案:A112121131538462)(168wwwgwgwww二、关系式法二、关系式法 多步连续反应计算的特征是化学反应原理中多个反应连续发生,起始物与目标物之间存在定量关系。解题时应先写出有关反应的化学方程式,依据方程式找出连续反应的过程中不同反应步骤之间反应物、生成物物质的量的关系,最后确定已知物和目标产物之间的物质的量的关系,列出
7、计算式求解,从而简化运算过程。【对点训练】(2015(2015聊城调考聊城调考)某实验小组为测定某石灰石样品中CaCO3的质量分数,先称取W g石灰石样品,加入过量的浓度为6 molL-1的盐酸,使样品完全溶解,加热煮沸后,除去溶解的CO2,再向溶液中加入足量的草酸铵(NH4)2C2O4溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀:C2O2-4Ca2=CaC2O4。过滤出CaC2O4后,用稀H2SO4溶解:CaC2O4H2SO4=H2C2O4CaSO4,再用蒸馏水稀释溶液至V0 mL,取出V1 mL,用a molL-1的酸性KMnO4溶液进行滴定,此时发生反应:2MnO-45H2C2O
8、46H=2Mn210CO2 8H2O。若达到滴定终点时消耗a molL-1的酸性KMnO4溶液V2 mL,则样品中CaCO3的质量分数为()A.25aV0V2/WV1%B.25aV1V2/WV0%C.25aV1V0/WV2%D.25aV2/W%解析:本题涉及的化学方程式或离子方程式有CaCO32HCl=CaCl2H2OCO2,C2O2-4Ca2=CaC2O4,CaC2O4H2SO4=H2C2O4CaSO4,2MnO-45H2C2O46H=2Mn210CO28H2O,由此得出相应的关系式:5CaCO35Ca25CaC2O45H2C2O42MnO-4 5 2n(CaCO3)a molL-1V210
9、-3 L解得:n(CaCO3)2.5aV210-3 mol则样品中w(CaCO3)答案:A%25%100100)3105.2(1201102WVVaVWgmolgmolVVaV三、平均值法三、平均值法所谓平均值法就是一种将数学平均原理应用于化学计算中的一种解题方法。它所依据的数学原理是:两个数Mr1和Mr2(Mr1大于Mr2)的算术平均值Mr一定介于两者之间。所以,只要求出平均值Mr,就可以判断Mr1和Mr2的取值范围,或根据Mr1和Mr2确定Mr的取值范围,再结合题目条件即可迅速求出正确答案。常见的平均值有:求平均相对原子质量、平均相对分子质量、平均浓度、平均含量、平均摩尔电子质量、平均组成
10、等。【对点训练】(2015(2015湖北七市湖北七市)可能混有下列两种杂质的硫酸铵样品13.2 g,与过量NaOH溶液在加热条件下反应,收集到标准状况下4.3 L气体,则样品中不可能混入的杂质是()A.NH4HCO3、NH4NO3B.(NH4)2CO3、NH4ClC.NH4Cl、NH4HCO3D.NH4Cl、NH4NO3解析:13.2 g纯净的(NH4)2SO4与过量NaOH溶液在加热条件下反应时最多能生成标准状况下4.48 L气体,实际生成气体的体积为4.3 L4.48 L,故杂质中能转化为NH3的氮元素含量低于(NH4)2SO4中的氮元素含量。(NH4)2SO4中的氮元素含量为14/66,
11、NH4HCO3中的氮元素含量为14/79,NH4NO3中能转化为NH3的氮元素含量为14/80(注意NO-3中的氮元素不能转化为NH3),(NH4)2CO3中的氮元素含量为14/48,NH4Cl中的氮元素含量为14/53.5。B项中两种物质中的氮元素含量均比硫酸铵中的高,C、D两项中两种物质的氮元素含量一种比硫酸铵中的高,一种比硫酸铵中的低,A项中两种物质的氮元素含量均比硫酸铵的低,依平均值原理可知,样品中不可能混入的杂质是(NH4)2CO3、NH4Cl。答案:B四、终态分析法四、终态分析法 终态分析法是利用逆向思维方式,以与待求量相关的物质(离子、分子或原子)在终态的存在形式为解题的切入点,
12、找出已知量与待求量之间的关系,不考虑中间变化过程的一种快捷有效的解题方法。在一些多步反应或多种混合物的计算中,由于涉及到的反应繁多、数据不一或变化过程复杂,解题时如果逐一去分析这些反应或过程,按步就班的进行计算,往往会纠缠不清,导致思维混乱,不但费时费力,而且极易出错,甚至无法解答。但如果我们淡化中间过程,关注最终组成,利用守恒关系进行整体分析,就会简化思维,从而快速求解。【对点训练】(2015(2015河南六市联考河南六市联考)向一定量Fe、Fe2O3的混合物中加入250 mL 2 molL-1的HNO3溶液,反应完成后生成1.12 L NO(标准状况),再向反应后溶液中加入1 molL-1
13、 NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液的体积最少是()A.450 mL B.500 mLC.400 mL D.不能确定解析:此题涉及多个反应,若全部写出化学方程式来计算显得十分繁琐,要使铁元素完全沉淀,但不能确定铁元素最终以Fe(OH)2或Fe(OH)3哪种形式存在,HNO3是否过量也不能确定,因而顺向求解比较困难。若忽略中间反应过程,运用终态法寻求守恒关系,即可迅速求解。要使铁元素恰好完全沉淀,最后溶液必为NaNO3溶液,由原子守恒有n(NaOH)n(NO-3)n(HNO3)-n(NO),即0.25 L2 molL-1-1.12L/22.4 Lmol-1V(NaOH)1
14、molL-1,所以V(NaOH)0.45 L450 mL。答案:A五、极值法五、极值法 极值法是采用极限思维方式解决一些模糊问题的解题技巧。它是将题目假设为问题的两个极端,然后依据有关化学知识确定所需反应物和生成物的值,进行分析判断,从而求得正确结论。极值法可以将某些复杂的难以分析清楚的化学问题假设为极值问题,使解题过程简洁,解题思路清晰,把问题化繁为简,由难变易,从而提高解题速度。【对点训练】(2015湖南五市十校)向100 mL 1 molL-1的NaOH溶液中通入一定量的SO2后,将所得的溶液蒸干得到5.8 g固体物质,则该固体的成分是()A.Na2SO3 B.NaHSO3C.Na2SO3、NaHSO3 D.Na2SO3、NaOH解析:本题中反应后得到的物质只可能有Na2SO3、NaHSO3、Na2SO3NaHSO3、Na2SO3NaOH四种情况,其中只有Na2SO3或只有NaHSO3时计算比较简单,故可先分别假设所得固体中只有Na2SO3或NaHSO3。假设所得固体全部是Na2SO3,则由钠原子守恒可得到0.05 mol Na2SO3,质量为6.3 g;同理可求出当固体全部为NaHSO3时的质量为10.4 g,因计算出的两个数据均大于所得到的固体质量,故说明固体物质中有一部分NaOH没有转化为相应的盐。答案:D
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
