 有机化合物知识点总结
有机化合物知识点总结


《有机化合物知识点总结》由会员分享,可在线阅读,更多相关《有机化合物知识点总结(9页珍藏版)》请在装配图网上搜索。
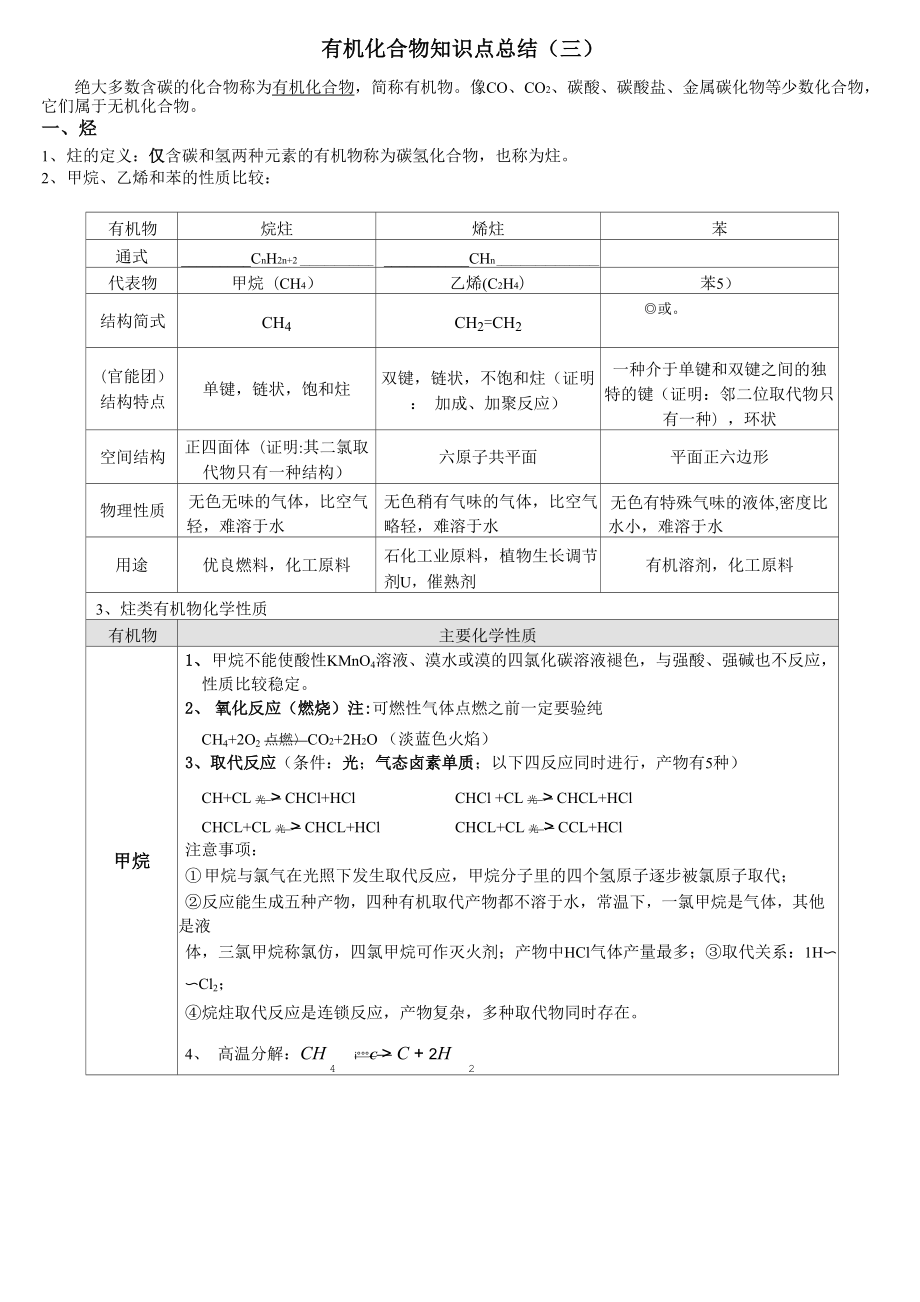
1、有机化合物知识点总结(三)绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物, 它们属于无机化合物。一、烃1、炷的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为炷。2、甲烷、乙烯和苯的性质比较:有机物烷炷烯炷苯通式CnH2n+2CHn代表物甲烷(CH4)乙烯(C2H4)苯5)结构简式ch4ch2=ch2或。(官能团)结构特点单键,链状,饱和炷双键,链状,不饱和炷(证明: 加成、加聚反应)一种介于单键和双键之间的独 特的键(证明:邻二位取代物只 有一种),环状空间结构正四面体(证明:其二氯取 代物只有一种结构)六原子共平面平面正六边形物理
2、性质无色无味的气体,比空气 轻,难溶于水无色稍有气味的气体,比空气 略轻,难溶于水无色有特殊气味的液体,密度比 水小,难溶于水用途优良燃料,化工原料石化工业原料,植物生长调节 剂U,催熟剂有机溶剂,化工原料3、炷类有机物化学性质有机物主要化学性质甲烷1、甲烷不能使酸性KMnO4溶液、漠水或漠的四氯化碳溶液褪色,与强酸、强碱也不反应, 性质比较稳定。2、氧化反应(燃烧)注:可燃性气体点燃之前一定要验纯CH4+2O2 点燃CO2+2H2O (淡蓝色火焰)3、取代反应(条件:光;气态卤素单质;以下四反应同时进行,产物有5种)CH+CL 光 CHCl+HClCHCl +CL 光 CHCL+HClCHC
3、L+CL 光 CHCL+HClCHCL+CL 光 CCL+HCl注意事项: 甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐步被氯原子取代; 反应能生成五种产物,四种有机取代产物都不溶于水,常温下,一氯甲烷是气体,其他是液体,三氯甲烷称氯仿,四氯甲烷可作灭火剂;产物中HCl气体产量最多;取代关系:1HCl2;烷炷取代反应是连锁反应,产物复杂,多种取代物同时存在。4、 高温分解:CHiC C + 2H42乙烯1. 氧化反应I. 燃烧C2H4+3O2点燃 2CO2+2H2O (火焰明亮,伴有黑烟)II. 能被酸性KMnO4溶液氧化为CO2,使酸性KMnO4溶液褪色.2. 加成反应CH2=C
4、H2+Br2CH2Br CH2Br (能使漠水或漠的四氯化碳溶液褪色)在一定条件下,乙烯还可以与H2、Cl2、HCl、H2O等发生加成反应如2 =如2 +虬催T,CH3CH3CH2=CH2+HCl催化剂* CH3CH2C1 (氯乙烷:一氯乙烷的简称)CH = CH+HO一催化剂 CHCHOH (工业制乙醇)22 2高温高压3 23. 加聚反应nCH2=CH2催化剂厂 皿土 (聚乙烯)注意:乙烯能使酸性KMnO4溶液、漠水或漠的四氯化碳溶液褪色。常利用该反应鉴别烷烃 和烯烃,如鉴别甲烷和乙烯。常用漠水或漠的四氯化碳溶液来除去烷烃中的烯烃,但是不能 用酸性KMnO4溶液,因为会有二氧化碳生成引入新
5、的杂质。苯难氧化易取代难加成1. 不能使酸性高锰酸钾褪色,也不能是漠水发生化学反应褪色,说明苯的化学性质比较稳定。 但可以通过萃取作用使漠水颜色变浅,液体分层,上层呈橙红色。2. 氧化反应(燃烧)2C6H6+15O2点燃 12CO2+6H2O (现象:火焰明亮,伴有浓烟,说明含碳量高)3. 取代反应(1)苯的漠代:。+ Br2 JieB Q-Br(漠苯)+HBr (只发生单取代反应,取代一个H) 反应条件:液漠(纯漠);FeBr3、FeC13或铁单质做催化剂 反应物必须是液漠,不能是漠水。(漠水则萃取,不发生化学反应) 漠苯是一种无色油状液体,密度比水大,难溶于水 漠苯中溶解了漠时显褐色,用氢
6、氧化钠溶液除去漠,操作方法为分液。(2)苯的硝化:O + HO-NO 岫叫 LJFNO2 + HP2 55,C60,C2 反应条件:加热(水浴加热)、浓硫酸(作用:催化剂、吸水剂) 浓硫酸和浓硝酸的混合:将浓硫酸沿烧杯内壁慢慢倒入浓硝酸中,边加边搅拌 硝基苯是一种无色油状液体,有苦杏仁气味,毒,密度比水,难溶 于水。 硝基苯中溶解了硝酸时显黄色,用氢氧化钠溶液除去硝酸,操作方法为分液。(3)加成反应(苯具有不饱和性,在一定条件下能和氢气发生加成反应)0+ 3H2 N (一个苯环,加成消耗3个H2,生成环己烷)4、同系物、同分异构体、同素异形体、同位素比较.概念同系物同分异构体同素异形体同位素定
7、义结构相似,在分子组成上 相差一个或若干个ch2 原子团的物质分子式相同而结 构式不同的化合 物的互称由同种元素组成的 不同单质的互称质子数相同而中子数 不同的同一兀素的不 同原子的互称分子式不同相同兀素符号表示相同, 分子式可不同结构相似不同不同研究对象化合物(主要为有机物)化合物(主要为有机物)单质原子常考实例 不同碳原子数烷炷 CH3OH 与 C2H5OH 正丁烷与异丁烷 正戊烷、异戊烷、 新戊烷 02与03 红磷与白磷 金刚石、石墨 1H(H)与 2H(D) 35C1 与 37C1 160与180二、烃的衍生物1、乙醇和乙酸的性质比较代表物乙醇乙醛乙酸结构简式chchoh 或 GHQH
8、CHCH0CHC00H官能团羟基:0H醛基:一CH0羧基:一C00H物理性质无色、有特殊香味的液体,俗名酒精,与水互溶,易挥发(非电解质)有刺激性气味有强烈刺激性气味的无色液体, 俗称醋酸,易溶于水和乙醇,无 水醋酸又称冰醋酸.用途作燃料、饮料、化工原料;质量分 数为75%的乙醇溶液用于医疗 消毒剂有机化工原料,可制得醋酸纤维、 合成纤维、香料、燃料等,是食醋 的主要成分2、乙醇和乙-酸的主要化学性质有机物主要化学性质乙醇1. 与Na的反应(反应类型:取代反应或置换反应)2CH3CH2OH+2Na- 2CH3CH20NH+H2T (现象:沉,不熔,表面有气泡)乙醇与Na的反应(与水比较):相同
9、点:都生成氢气,反应都放热不同点:比钠与水的反应要缓慢结论:乙醇分子羟基中的氢原子没有水分子中的氢原子活泼;1mo1乙醇与足量Na 反应产生0。5mol H2,证明乙醇分子中有一个氢原子与其他的氢原子不同;2 -H0H2,两个羟基对应一个H2;单纯的-0H可与Na反应,但不能与NaHC03 发生反应。2. 氧化反应(1)燃烧(淡蓝色火焰,放出大量的热)CH3CH2OH+3O2点燃2CO2+3H2O 可作燃料,乙醇汽油(2)在铜或银催化条件下:可以被O2氧化成乙醛(CH3CHO)2CH3CH2OH+O2彖 2CH3CHO+2H20(总反应)现象:红亮的铜丝在酒精灯上加热后变为_黑色,将黑色的氧化
10、铜伸入乙醇中又变为红 色;并且可以闻到有刺激性气味气体产生(乙醛)H 0 反应断键情况:兀H, trH + O七才2CH3 C H+2H:0坦 Cu或Ag,作催化剂,反应前后质量保持不变.(3)乙醇可以使紫红色的酸性高锰酸钾溶液褪色,与之相似的物质有乙烯;可以使橙色的重铬酸钾溶液变为呈色,该反应可用于检验酒后驾驶。总结:燃烧反应时的断键位置:全断 H H孕中与钠反应时的断键位詈:Hyc-cOH在铜催化氧化时的断键位置:、志苍洁y(4)检验乙醇中是否含有水,用无水硫酸铜;除去乙醇中的水得到无水乙醇,加生石灰, 蒸馏.1. 具有酸的通性:CH3COOH=CH3COO-+H+ (一元弱酸) 可使酸碱
11、指示剂变色,如使紫色石蕊试液变红(变色是反应生成了有色物质); 与活泼金属(金属性H之前),碱(Cu(OH) 2),弱酸盐反应,如CaCO3、Na2CO3 酸性比较:ch3cooh H2CO32CH3COOH+CaCO3- 2 (CH3COO) 2Ca+CO2T+H2O(强酸制弱酸)2。酯化反应(实质:酸去羟基,醇去氢一一同位素标记法) H诣 Ckn 齐CH.COOH+HOC,HT CHCOOCH+HO电323432 52乙酸反应类型:酯化反应,属于取代反应;是可逆反应,渗了 反应有一定限度,乙酸乙酯产率不可能达到100%-试管a中药品加入顺序是:- .f留乙醇3 mL、浓硫酸(催化剂、吸水剂
12、)、乙酸各2 mL(2)为了防止试管a中的液体发生暴沸,加热前应采取的措施是:加碎瓷片(或沸石)(3)实验中加热试管a的目的是:加快反应速率蒸出乙酸乙酯,提高产率(4)长导管的作用是:导气,冷凝回流;不伸入饱和碳酸钠溶液中:防止倒吸(5)试管b中加有饱和Na2CO3溶液,其作用是(3点):中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度,利于分层(6)反应结束后,振荡试管b,静置.观察到的现象是:饱和碳酸钠溶液上面有油状液滴生成, 且能闻到香味。三、烷烃1、烷炷的概念:碳原子间都以碳碳单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到饱和” 的饱和链烃,或称烷炷.呈锯齿状。2、烷炷物理
13、性质:状态:一般情况下,1-4个碳原子烷炷为气态,5-16个碳原子为液态,16个碳原子以上为固态。溶解性:烷炷都难溶于水,易溶于有机溶剂。熔沸点:随着碳原子数的递增,熔沸点逐渐逐渐升高;相同碳原子数时,支链越多,熔沸点越低。密度:随着碳原子数的递增,密度逐渐增大,但都比水的密度小。3、烷炷的化学性质一般比较稳定,在通常情况下跟酸、碱和高锰酸钾等都不反应氧化反应:在点燃条件下,烷炷能燃烧;取代反应 (烷烃特征反应):在光照条件下能跟卤素发生取代反应。1. 需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于
14、100C的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。2. 需用温度计的实验有:(1)、实验室制乙烯(170C)(2 )、蒸馏(3)、固体溶解度的测定(4)、乙酸乙酯的水解(70 80C) (5)、中和热的测定(6)制硝基苯(50 60C)说明:(1)凡需要准确控制温度者均需用温度计.(2)注意温度计水银球的位置.3. 能与Na反应的有机物有:醇、酚、羧酸等一-凡含羟基的化合物。4 .能发生银镜反应的物质有: 醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖-凡含醛基的物质。5 .能使高锰酸钾酸性溶液褪色的物质有:(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的
15、同系物(2)含有羟基的化合物如醇和酚类物质(3)含有醛基的化合物(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)6. 能使漠水褪色的物质有:(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)(2)苯酚等酚类物质(取代)(3)含醛基物质(氧化)(4)碱性物质(如NaOH、Na2CO3)(氧化还原一 一歧化反应)(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)(6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。)7. 密度比水大的液体有机物有:漠乙烷、漠苯、硝基苯、四氯化碳等。8. 密度比水小的液体有机物有:烃、
16、大多数酯、一氯烷烃。9 .能发生水解反应的物质有卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。10. 不溶于水的有机物有:烃、卤代烃、酯、淀粉、纤维素11. 常温下为气体的有机物有:分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。12. 浓硫酸、加热条件下发生的反应有:苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解13. 能被氧化的物质有:含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。大多数有机物都可以燃烧,燃烧都是被氧气氧化。14. 显酸性的有机物有:含有酚羟基和羧基的化合物。15. 能使蛋白质变性的物质有:强酸、强碱、重
17、金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等。16. 既能与酸又能与碱反应的有机物:具有酸、碱双官能团的有机物(氨基酸、蛋白质等)17. 能与NaOH溶液发生反应的有机物:(1)羧酸(2)酯:(水解,不加热反应慢,加热反应快):(3)蛋白质(水解)18. 有明显颜色变化的有机反应:1. KMnO4酸性溶液的褪色;2 .漠水的褪色;3 .淀粉遇碘单质变蓝色.4. 蛋白质遇浓硝酸呈黄色(颜色反应)一、物理性质甲烷:无色无味难溶乙烯:无色稍有气味难溶乙炔:无色无味微溶(电石生成:含H2S、PH3特殊难闻的臭味)苯:无色有特殊气味液体难溶有毒乙醇:无色有特殊香味混溶易挥发乙酸:无色
18、刺激性气味易溶能挥发二、实验室制法甲烷:CH3COONa+NaOH (CaO,加热)一CH4 f +Na2CO3p。s.:无水醋酸钠:碱石灰=1:3固固加热(同O2、NH3)CaO:吸水、稀释NaOH、不是催化剂乙烯:C2H5OH (浓 H2SO4, 170C) CH2=CH2 f+H2Op。s.: V酒精:V浓硫酸=1: 3 (被脱水,混合液呈棕色)排水收集(同Cl2、HCl)控温170C(140C:乙醚)碱石灰除杂SO2、CO2碎瓷片:防止暴沸乙炔:CaC2+2H2O 一 C2H2 f +Ca(OH)2注:排水收集无除杂不能用启普发生器 导管口放棉花:防止微溶的Ca(OH) 2泡沫堵塞导管
19、乙醇:CH2=CH2+H2O 一(催化剂,加热,加压)一CH3CH2OH三、燃烧现象烷:火焰呈淡蓝色 不明亮 烯:火焰明亮有黑烟 炔:火焰明亮有浓烈黑烟(纯氧中3000C以上:氧炔焰)苯:火焰明亮大量黑烟(同炔)醇:火焰呈淡蓝色放大量热 六、通式 CnH2n+2:只能是烷烃,而且只有碳链异构。如 ch3 (CH2)3CH3、ch3ch(ch3) ch2ch3、c(ch3)4CnH2n:单烯烃、环烷烃.如CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C (CH3) 2、CH2CH2 、 /C乩ch2ch2ch2ch-ch3CnH2n:快烃、二烯烃.如:CH = CCH2CH3、也3勺
20、、电=如如=如2H3CnH2n-6:芳香烃(苯及其同系物)。如:CH33、ch3ch; CH3CH3 CnH2n+2O:饱和脂肪醇、醚.如:CH3CH2CH2OH、CH3CH(OH)CH3、ch3och2ch3 CnH2nO:醛、酮、环醚、环醇、烯基醇.如:ch3ch2cho、ch3coch3、ch2=chch2oh、/OCH2-CH2,/兴CH2CH-CH3、O一 CH2、 CH2CH-OH CnH2nO2:羧酸、酯、羟醛、羟基酮。如:ch3ch2cooh、ch3cooch3、hcooch2ch3、hoch2ch2cho、ch3ch (OH) CHO、CH3COCH2OH CnH2n+1NO
21、2:硝基烷、氨基酸。如:CH3CH2NO2、H2NCH2COOH(9) CH2O) m:糖类。如:C6H12O6: CH2OH(CHOH)4CHO, ch2oh(choh)3coch2ohc12h22o11:蔗糖、麦芽糖。七、其他知识点1、天干命名:甲乙丙丁戊己庚辛壬癸2、 燃烧公式:CxHy+ (x+y/4)O2 一(点燃)一 xCO2+y/2H2OCxHyOz+(x+y/4 z/2)O2 一(点燃)一 xCO2+y/2H2O3、工业制烯烃:【裂解】(不是裂化)4、医用酒精:75%工业酒精:95%(含甲醇 有毒)无水酒精:99%5、甘油:丙三醇6、乙酸酸性介于HCl和H2CO3之间食醋:3%
22、5%冰醋酸:纯乙酸【纯净物】7、烷基不属于官能团八、有机物的物理性质1、状态:固态:饱和高级脂肪酸、脂肪、葡萄糖、果糖、蔗糖、麦芽糖、淀粉、维生素、醋酸(16。6C以下);气态:C以下的烷、烯、炔炷、甲醛、一氯甲烷、新戊烷; 4液态:油状:乙酸乙酯、油酸;1粘稠状:石油、乙二醇、丙三醇。2、气味:无味:甲烷、乙焕(常因混有PH3、H2S和AsH3而带有臭味);稍有气味:乙烯;3特殊气味:甲醛、乙醛、甲酸和乙酸;香味:乙醇、低级酯;3、颜色:白色:葡萄糖、多糖黑色或深棕色:石油4、密度:比水轻:苯、液态烃、一氯代烃、乙醇、乙醛、低级酯、汽油;比水重:漠苯、乙二醇、丙三醇、CCl.45、挥发性:乙醇、乙醛、乙酸.6、水溶性:不溶:高级脂肪酸、酯、漠苯、甲烷、乙烯、苯及同系物、石油、CCl4;易溶:甲醛、乙酸、乙二醇;与水混溶:乙醇、乙醛、甲酸、丙三醇。
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
