 过渡元素化校课件
过渡元素化校课件


《过渡元素化校课件》由会员分享,可在线阅读,更多相关《过渡元素化校课件(79页珍藏版)》请在装配图网上搜索。
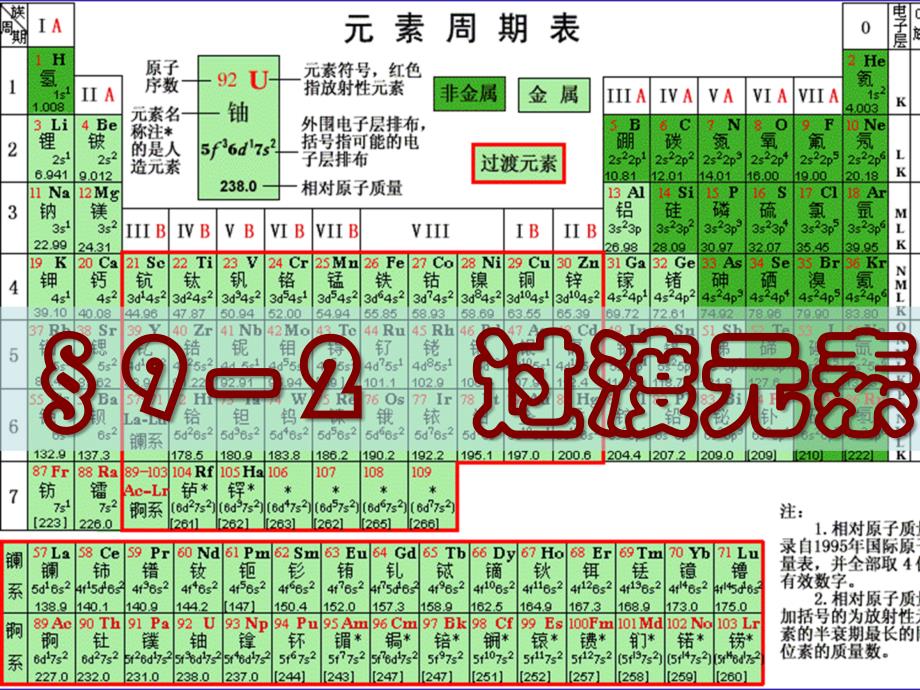
1、992 2 过渡元素过渡元素 21 过渡元素的定义和分类过渡元素的定义和分类 1 1、定义:三种划分方法、定义:三种划分方法第一种第一种:BB共共8 8个竖行个竖行2525种元素,种元素,其原子电子层结构特点:其原子电子层结构特点:有未充满的有未充满的d电子亚层。电子亚层。电子构型:电子构型:(n1)d19ns12。第二种第二种:BBBB共共9 9个竖行个竖行2828种元素,种元素,电子结构特点:原子及电子结构特点:原子及其重要的氧化态有未充满的其重要的氧化态有未充满的d亚层,电子构型亚层,电子构型:(n-1)d(n-1)d轨道轨道部部分充满。分充满。(n-1)d n-1)d 1-101-10
2、 ns ns 1-21-2第三种第三种:BBBB共共1010个竖行个竖行3131种元素种元素。(n-1)d n-1)d 1-101-10ns ns 1-21-2。这这种划分,种划分,“过渡过渡”的含义是指从活泼金属元素到非金属元素的含义是指从活泼金属元素到非金属元素的过渡或由周期表的过渡或由周期表 s区元素过渡到区元素过渡到 p区元素。区元素。我们采用第三种说法,我们采用第三种说法,从从B族到族到B族族10个从行包括个从行包括7个个副族和副族和1个个族)共族)共31种元素,称为过渡元素。种元素,称为过渡元素。一般:镧系和锕系除了镧和锕以外,过渡元素常不包括其他的一般:镧系和锕系除了镧和锕以外,
3、过渡元素常不包括其他的镧系和锕系元素。镧系和锕系元素。第一、第二和第三过渡系总称为第一、第二和第三过渡系总称为“主过渡元素主过渡元素”;f f区元素称为区元素称为“内过渡元素内过渡元素”。2 2、分类、分类为了讨论的方便,可以根据过渡元素的综合化学性质进行分类为了讨论的方便,可以根据过渡元素的综合化学性质进行分类:前过渡元素前过渡元素:IVBIVBVIIBVIIB,不包括不包括MnMn,位于位于d d区前部,区前部,其特征是其高价离子在水溶液中常发生聚合作用。其特征是其高价离子在水溶液中常发生聚合作用。后过渡元素后过渡元素:MnMn到到CuCu,第一过渡系的后部,其特点是,第一过渡系的后部,其
4、特点是以水溶液化学和配位化学为其特征。以水溶液化学和配位化学为其特征。贵金属元素:贵金属元素:的第五、六周期元素有:的第五、六周期元素有:RuRu、RhRh、PdPd,OsOs、IrIr、PtPt,再加上再加上AgAg、AuAu,特征:丰富的配位化学。,特征:丰富的配位化学。第四周期:第一过渡系,又称第四周期:第一过渡系,又称轻过渡元素轻过渡元素;第五、第六周期:第二、三过渡系,又称第五、第六周期:第二、三过渡系,又称重过渡元素重过渡元素。周期表周期表 位置位置不同不同 周期周期电子进电子进 入轨道入轨道在此我们在此我们只介绍根据元素在周期的不同的分类:只介绍根据元素在周期的不同的分类:第一过
5、渡系(轻过渡系):对应第四周期,从钪(第一过渡系(轻过渡系):对应第四周期,从钪(Sc)锌(锌(Zn)10种元素种元素第二过渡系(重过渡系):对应第五周期,从钇(第二过渡系(重过渡系):对应第五周期,从钇(Y)镉(镉(Cd)10种元素种元素第三过渡系(重过渡系):对应第六周期,从镧(第三过渡系(重过渡系):对应第六周期,从镧(La)汞(汞(Hg)10种元素种元素周期周期族族IIIBIVBVBVIB VIIBVIIIBBB四四ScTiCrMnFeCoNiCuZn五五YZrNbMoTcRuRhPdAgCd六六LaHfTaWReOsIrPtAuHg七七Ac第一过渡系第一过渡系第二过渡系第二过渡系第三
6、过渡系第三过渡系2 22 2 过渡元素的价电子层结构过渡元素的价电子层结构过渡元素价电子层结构:过渡元素价电子层结构:(n-1)d 1-10 ns 1-2 (Pd:4d105s0)为了便于学习和理解,我们又把过渡元素分成两大类:为了便于学习和理解,我们又把过渡元素分成两大类:(1)从)从B族族族元素族元素 其结构特点是:最后一个电子依次填充在次外层的其结构特点是:最后一个电子依次填充在次外层的d轨道上(轨道上(d1-9)。因而他们都是)。因而他们都是d区元素,它们的最外层区元素,它们的最外层和次外层电子都没有填满,最外层电子数只有和次外层电子都没有填满,最外层电子数只有1或或2个,个,且保持不
7、变。且保持不变。价电子层构型为:价电子层构型为:(n-1)d 1-9 ns 1-2(此(此n表示电子所处的电子层数)表示电子所处的电子层数)(2)从)从B族族B族的元素族的元素其结构特点是:它们次外层的其结构特点是:它们次外层的d轨道已经填满,最后一轨道已经填满,最后一个电子依次填充在最外层的个电子依次填充在最外层的S轨道上(轨道上(S1-2)。因而他)。因而他们不是们不是d区元素,但是,这些族中的某些元素的原子,区元素,但是,这些族中的某些元素的原子,它们的次外层上的它们的次外层上的d电子也参加成键;而且他们的氧化电子也参加成键;而且他们的氧化态时态时d轨道并没有排满,如:轨道并没有排满,如
8、:Cu2+外围电子构型为外围电子构型为3d9,Au3+为为5d8等,它们的性质与等,它们的性质与d区元素很相似所以我们把区元素很相似所以我们把B族、族、B族统称为族统称为dS区。区。所以可以认为,过渡元素是所以可以认为,过渡元素是d区元素和区元素和dS区元素的总称。区元素的总称。由于过渡元素的最外层电子数比较少,只有由于过渡元素的最外层电子数比较少,只有1或或2个,所个,所以都属于金属,所以过渡元素又称谓过渡金属以都属于金属,所以过渡元素又称谓过渡金属价电子层构型为:价电子层构型为:(n-1)d 10 ns 1-21、过渡元素电子层结构的特点与成键情况:、过渡元素电子层结构的特点与成键情况:(
9、1)(n-1)d 轨道的能量与轨道的能量与ns、np轨道比较接近,是参与成键轨道比较接近,是参与成键的内层轨道,所以次外层也是价电子层。的内层轨道,所以次外层也是价电子层。(2)d轨道比轨道比s、p轨道数目多轨道数目多,不但不但成键可能性大成键可能性大,而且成键而且成键的数目多。的数目多。(3)d轨道未充满其空轨道可以接受孤电子,形成配位化合物轨道未充满其空轨道可以接受孤电子,形成配位化合物(4)(n-1)d与与 ns 轨道能级的高低:轨道能级的高低:当当3d轨道无电子时,轨道无电子时,4s轨道的能量小于轨道的能量小于3d轨道轨道;(钻穿效应为主)(钻穿效应为主)当当3d轨道有了电子之后,其能
10、量下降轨道有了电子之后,其能量下降;能量低于能量低于4s轨道。轨道。此时,此时,3d电子就成了内层电子。电子就成了内层电子。(屏蔽效应为主)(屏蔽效应为主)或者说:或者说:对于原子:对于原子:4s3d4p 对于离子:对于离子:3d4s4p2-32-3过渡元素结构特征与通性过渡元素结构特征与通性2 2、原子结构特征、原子结构特征(1)原子半径和离子半径:)原子半径和离子半径:B B B B B B B 结论:结论:1)与同周期碱金属和碱土金属相比,原子半径都较小。如:)与同周期碱金属和碱土金属相比,原子半径都较小。如:r(k)=203pm=203pm,r(Ca)=174pm,原因:电子层数没变,
11、核电荷数增加原因:电子层数没变,核电荷数增加BB元素的原子半径元素的原子半径/pm 2)从从左到右原子半径先逐步减小,但接近左到右原子半径先逐步减小,但接近d10时半径又时半径又稍增大(稍增大(d电子屏蔽效应小,电子屏蔽效应小,d电子充满后,屏蔽效应加电子充满后,屏蔽效应加强有关)。强有关)。3)同族元素的)同族元素的原子半径从上到下增大,但第二、三过原子半径从上到下增大,但第二、三过渡系元素同族半径相差极小。(镧系收缩的缘故)。渡系元素同族半径相差极小。(镧系收缩的缘故)。4)离子半径的规律与原子半径相似,)离子半径的规律与原子半径相似,d5半充满有例外。半充满有例外。3 3、过渡元素的通性
12、、过渡元素的通性过渡元素的通性主要表现为:过渡元素的通性主要表现为:(1)全部是金属全部是金属 (2)有多变的氧化态有多变的氧化态 (3)水溶液中的离子往往有颜色水溶液中的离子往往有颜色 (4)易形成配合物易形成配合物 1)过渡元素都是金属)过渡元素都是金属a、过渡元素最外层只有过渡元素最外层只有12个电子,所以都表现出金属性。个电子,所以都表现出金属性。因此过渡元素又称过渡金属。因此过渡元素又称过渡金属。b、由于过渡元素的原子半径较小,但荷电荷数较大,所以、由于过渡元素的原子半径较小,但荷电荷数较大,所以金属性相对较弱。金属性相对较弱。c、过渡元素的原子半径小且比较相近,所以可互熔成合金。、
13、过渡元素的原子半径小且比较相近,所以可互熔成合金。d、过渡元素的原子半径较小,但荷电荷数较大,即有较小、过渡元素的原子半径较小,但荷电荷数较大,即有较小的原子体积和较大的原子量,所以表现出:密度大。如:的原子体积和较大的原子量,所以表现出:密度大。如:Cs的密度为的密度为1.90g/cm3,Pt的密度为的密度为21.45g/cm3f、过渡元素的最外层、过渡元素的最外层S电子和次外层的电子和次外层的d电子都参加成键,电子都参加成键,且堆积程度大所以表现出,晶体的熔点高,硬度大。如:且堆积程度大所以表现出,晶体的熔点高,硬度大。如:铯(铯(Cs)的熔点为)的熔点为28.59,钨(,钨(W)的熔点为
14、)的熔点为3380。2)过渡金属的活泼性)过渡金属的活泼性a、过渡元素一般不与水反应,但第一过渡系的金属能与盐酸过渡元素一般不与水反应,但第一过渡系的金属能与盐酸或硫酸作用,置换出或硫酸作用,置换出H2,但活泼性逐渐减弱。这从它们的标,但活泼性逐渐减弱。这从它们的标准电动势较低可以得到反应。准电动势较低可以得到反应。ScTiCrMnFeCoNiCuZnM2+/M-1.19-0.44-0.28-0.23-0.76M3+/M-2.0-7.1第一过渡系元素的标准电极电动势(伏)第一过渡系元素的标准电极电动势(伏)金属金属电动势电动势电对电对b、同族元素从上往下,它们的金属性是逐渐减弱的。同族元素从上
15、往下,它们的金属性是逐渐减弱的。如:如:B族的族的Cr、Mo、W,铬能与盐酸或硫酸反应置换出氢,铬能与盐酸或硫酸反应置换出氢 气,钼不能,只能溶于煮沸的稀盐酸中,钨只能溶于氢氟气,钼不能,只能溶于煮沸的稀盐酸中,钨只能溶于氢氟 酸和硝酸的混合酸中。酸和硝酸的混合酸中。原因:原因:核电荷数明显增大,但半径变化不大,原子核对价电子核电荷数明显增大,但半径变化不大,原子核对价电子 的束缚力加强。这和主族元素的性质递变规律正好相反。的束缚力加强。这和主族元素的性质递变规律正好相反。3 3)过渡元素的多变氧化态)过渡元素的多变氧化态过渡元素一般都有多变的氧化态。过渡元素一般都有多变的氧化态。如:如:Fe
16、有有+2、+3、+6 三种氧化态(三种氧化态(FeO、Fe2O3、Na2FeO4等)等)Cr有有+2、+3、+6 三种氧化态(三种氧化态(CrO、Cr2O3、CrO3等)等)Mn有有+2、+3、+4、+6、+7 多种氧化态(多种氧化态(MnO、Mn2O3、MnO2、K2MnO4、KMnO4等)等)族序族序BBBBBB B元素符号元素符号ScTiVCrMnFeCoNiCuZn价电子构型价电子构型3d14S23d24S23d34S23d54S13d54S23d64S23d74S23d84S23d104S13d104S2常见氧化数常见氧化数+2、+3+2、+3、+4+2、+3、+4、+5+2、+3、
17、+6+2、+3、+4、+6、+7+2、+3、+6+2、+3+2、+3+1、+2+2化合物代表化合物代表Sc2O3TiO、Ti2O3V2O3V2O5略略略略略略CoO、Co2O3NiO、Ni2O3Cu2O、CuOZnO价电子总数价电子总数3456789101112第一过渡系元素的常见氧化数第一过渡系元素的常见氧化数原因:原因:过渡元素的最外过渡元素的最外S S电子和次外层的电子和次外层的d d电子都可以成键。电子都可以成键。其稳定的氧化态表现的价态与稳定性有关。即当等价其稳定的氧化态表现的价态与稳定性有关。即当等价轨道处于全充满、半充满或全空时比较稳定。轨道处于全充满、半充满或全空时比较稳定。4
18、 4)过渡元素的化合物或其离子的水溶液往往显示一定的颜色)过渡元素的化合物或其离子的水溶液往往显示一定的颜色IIIB VIIB族:族:最高氧化态最高氧化态 =族数族数 VIIIB族族:最高氧化态最高氧化态 族数族数 过渡元素在水溶液中大都形成的水合配离子而显色(与过渡元素在水溶液中大都形成的水合配离子而显色(与s区、区、p区不同),原因是:区不同),原因是:过渡金属离子过渡金属离子d 轨轨 道一道一 般不充满,(据晶般不充满,(据晶体场理论)在配体水的影响下,体场理论)在配体水的影响下,d轨道发生分裂,形成能量不同轨道发生分裂,形成能量不同的两组,受到光照,不同的两组,受到光照,不同d轨道轨道
19、上的上的 电子电子 会会吸收能量产生吸收能量产生 d-d 跃跃迁,迁,d-d 跃跃迁吸收的能量一般在可见光范围,所以过渡金属水迁吸收的能量一般在可见光范围,所以过渡金属水合离子就呈现其互补色合离子就呈现其互补色。不同的过渡金属离子其电子发生不同的过渡金属离子其电子发生d-d跃迁跃迁吸收的能量不同,因而显示不同的颜色。当最外层呈现吸收的能量不同,因而显示不同的颜色。当最外层呈现d0或或d10结构结构时,过渡金属离子一般不显示颜色。时,过渡金属离子一般不显示颜色。Ti3+V2+V3+Cr3+Mn2+Fe2+Fe3+Co2+Ni2+紫红紫红 紫紫 绿绿 蓝紫蓝紫 肉色肉色 浅绿浅绿 淡紫淡紫 粉红粉
20、红 绿绿 Mn(II)Fe(II)Co(II)Ni(II)Cu(II)Zn(II)过渡金属水合离子呈现的多种颜色过渡金属水合离子呈现的多种颜色未成对未成对d电子发生跃迁电子发生跃迁5 5)过渡元素容易形成配位化合物)过渡元素容易形成配位化合物 过渡金属离子和某些过渡金属原子,由于存在空的过渡金属离子和某些过渡金属原子,由于存在空的nS、nP和和部分甚至全空的部分甚至全空的 d 轨道,轨道,可以接受配体提供的孤可以接受配体提供的孤对对电子电子,形成形成配位键,形成配位离子和配位化合物。配位键,形成配位离子和配位化合物。如如:K4Fe(CN)6、K3Fe(CN)6、Ag(NH3)2OH、Cu(H2
21、O)42+等等 铂系元素由于原子半径小,铂系元素由于原子半径小,d d电子数较多,且易变形,更易电子数较多,且易变形,更易形成配位化合物。如:形成配位化合物。如:H2 PtCl6。其他还有:如许多过渡元素及其化合物具有独特的催其他还有:如许多过渡元素及其化合物具有独特的催化性能;多数过渡元素的原子或离子具有顺磁性,以及过化性能;多数过渡元素的原子或离子具有顺磁性,以及过渡金属氧化物的水化物的酸碱性的递变规律等,在以后渡金属氧化物的水化物的酸碱性的递变规律等,在以后介绍具体元素时再讨论,在此不介绍了。介绍具体元素时再讨论,在此不介绍了。3-1 3-1 铬铬 单单 质质1 1、物理性质、物理性质
22、铬是银白色、有光泽、硬度最大的金属但脆,熔点高,有延铬是银白色、有光泽、硬度最大的金属但脆,熔点高,有延展性。铬由于有良好的光泽和很强的抗腐蚀性,所以广泛用于电展性。铬由于有良好的光泽和很强的抗腐蚀性,所以广泛用于电镀工业,作金属的保护镀层。镀工业,作金属的保护镀层。铬在形成金属键时提供铬在形成金属键时提供6 6个电子个电子,金属键较强金属键较强 93 铬(铬(Cr)BB族包括:铬(族包括:铬(CrCr)、钼()、钼(MoMo)、钨()、钨(W W)三个元素。)三个元素。铬的价电子构型铬的价电子构型:3d3d5 54S4S1 1 氧化态:氧化态:+2+2、+3+3、+6+6。其中以其中以+3+
23、3和和+6+6的化合物较常见。的化合物较常见。铬在地壳中的丰度为:约铬在地壳中的丰度为:约0.018%0.018%,主要以矿物形式存在。,主要以矿物形式存在。如:铬铁矿:如:铬铁矿:Fe(CrOFe(CrO2 2)2 2归纳为:归纳为:高熔点,高硬度,高强度,耐腐蚀性高熔点,高硬度,高强度,耐腐蚀性铬元素电势图铬元素电势图/伏伏+1.33 -0.41 -0.91 -0.74 -0.13 -1.1 -1.4 -1.5 由铬的标准电极电位可见,铬具有较强的还原性,是比较由铬的标准电极电位可见,铬具有较强的还原性,是比较活活泼的金属,但由于表面易形成氧化膜而变为钝态,活泼性下降泼的金属,但由于表面易
24、形成氧化膜而变为钝态,活泼性下降2 2、化学性质、化学性质(1 1)与非氧化性的无机酸反应)与非氧化性的无机酸反应如:与盐酸或稀如:与盐酸或稀H2SO4的反应的反应Cr+2HCl=CrCl2+H2 蓝色溶液蓝色溶液4CrCl2+4HCl+O2=4CrCl3+2H2O 空气中变绿空气中变绿 Cr2+(aq)Cr3+(aq)(2)与热的浓与热的浓H2SO4的反应的反应2Cr+6H2SO4(浓浓)=Cr2(SO4)3+3SO2+6H2O(3)冷的浓冷的浓H2SO4、冷的、冷的HNO3无论浓稀都可以把铬钝化,无论浓稀都可以把铬钝化,甚至冷的王水也不能溶解铬。甚至冷的王水也不能溶解铬。铬也能发生置换反应
25、把溶液中铜等置换出来。高温下能铬也能发生置换反应把溶液中铜等置换出来。高温下能与卤素、氮、氧、碳等许多非金属反应。与卤素、氮、氧、碳等许多非金属反应。3 3、用途、用途(1)做各种不锈钢的器件,不锈钢中铬含量在)做各种不锈钢的器件,不锈钢中铬含量在12%14%(2)制造其它合金)制造其它合金(3)做金属陶瓷)做金属陶瓷 (含含77%的的Cr,23%的的Al2O3)(4)作金属表面的电镀保护层)作金属表面的电镀保护层3-2 铬的化合物铬的化合物 铬的化合物中氧化态有:铬的化合物中氧化态有:+2、+3、+6。其中以其中以+3 和和+6 的化合物较常见。的化合物较常见。1、Cr(III)化合物化合物
26、常见的:常见的:Cr2O3、Cr(OH)3、Cr2(SO4)3和亚铬酸盐等和亚铬酸盐等(1)Cr2O3(铬绿铬绿)微溶于水微溶于水,具有具有-Al2O3的结构的结构制备制备两性两性亚铬盐(紫色)亚铬盐(紫色)亚铬酸盐(绿色)亚铬酸盐(绿色)这和这和Al2O3的性质很相似的性质很相似(2)Cr(OH)3紫色紫色 灰蓝色灰蓝色 绿色绿色在可溶性的铬(在可溶性的铬()盐溶液中加碱,得到)盐溶液中加碱,得到灰兰色灰兰色的胶状的胶状Cr(OH)3沉淀,沉淀,Cr(OH)3显两性在溶液中存在下列平衡显两性在溶液中存在下列平衡Cr3+3OH-Cr(OH)3 Cr(OH)4-OH-H+OH-H+当当pH 4.
27、6时,时,Cr()以简单阳离子)以简单阳离子Cr3+的形式存在,的形式存在,当当pH1314时,就以时,就以Cr(OH)4-的形式存在。的形式存在。Cr(OH)4-通常通常可以写成可以写成CrO2-(3 3)Cr(III)Cr(III)盐和亚铬酸盐盐和亚铬酸盐可见,在可见,在酸性介质酸性介质中中Cr3+相当稳定相当稳定,只有很强氧化剂才能将其氧化只有很强氧化剂才能将其氧化 在在碱性介质碱性介质中中CrO2-还原性较强,易被氧化为还原性较强,易被氧化为CrO42-Cr3+在溶液中实际以在溶液中实际以d2sp3型配离子型配离子Cr(H2O)63+的形式存在。的形式存在。但但Cl-或或NH3可以取代
28、水分子。如可以取代水分子。如CrCl36H2O有三种异构体:有三种异构体:Cr(H2O)6Cl3紫色紫色,Cr(H2O)5ClCl2H2O淡绿色淡绿色,Cr(H2O)4Cl2Cl2H2O暗绿色暗绿色 2、Cr(VI)化合物化合物(1)在水溶液中存在下列平衡)在水溶液中存在下列平衡 常见为含氧酸盐和对应酸常见为含氧酸盐和对应酸:重铬酸盐、重铬酸盐、铬酸盐,铬酸盐,重铬酸、重铬酸、铬酸。铬酸。黄色黄色 橙色橙色加酸平衡右移,当加酸平衡右移,当pH6:溶液中以:溶液中以CrO42-为主为主当加入当加入Ba2+Pb2+Ag+等由于生成等由于生成铬酸盐沉淀,铬酸盐沉淀,平衡左移平衡左移 2Ba2+Cr2
29、O72-+H2O =2H+2BaCrO4(黄黄)Ag+Cr2O72-或或 CrO42-Ag2CrO4(砖红色砖红色)Pb2+Cr2O72-或或 CrO42-PbCrO4 (黄色黄色)分析化学中常用于检验这些离子分析化学中常用于检验这些离子 (2 2)重铬酸盐的强氧化性重铬酸盐的强氧化性如:如:Cr2O72-+14H+6I-=2Cr3+3I2 +7H2O 用途用途 分析化学中用分析化学中用K2Cr2O7测定铁测定铁的含量的含量重铬酸盐氧化乙醇监测司机是否酒后开车重铬酸盐氧化乙醇监测司机是否酒后开车 重铬酸盐在酸性溶液中是强氧化剂,可以氧化重铬酸盐在酸性溶液中是强氧化剂,可以氧化H2S、H2SO3
30、、HI、Fe2+等,加热时可以氧化浓盐酸逸出等,加热时可以氧化浓盐酸逸出Cl2。K2Cr2O7 指示剂指示剂(3)三氧化铬:)三氧化铬:CrO3 酸酐酸酐,强氧化剂强氧化剂 K2Cr2O7 +H2SO4=K2SO4+CrO3+H2O 是强氧化剂是强氧化剂,棕红色棕红色逐渐变为逐渐变为绿色绿色失效失效 想想为什么想想为什么重铬酸钾浓溶液中加入浓硫酸灰析出重铬酸钾浓溶液中加入浓硫酸灰析出橙红色橙红色晶体晶体CrO3 CrO3(s)+H2O =H2CrO4 H2CrO4强酸强酸,酸性接近于硫酸,但酸性接近于硫酸,但H2CrO4只能在溶液中存在,只能在溶液中存在,无法分离出纯净的铬酸。无法分离出纯净的
31、铬酸。橙红色晶体橙红色晶体介绍介绍 常用的洗液:常用的洗液:K2Cr2O7饱和溶液饱和溶液+H2SO4(浓)浓)?3 3、Cr()Cr()和和CrCr()的鉴定)的鉴定 OH5C2 C2H5过氧化物不稳定,在乙醚中可以形成稳定的加合物为过氧化物不稳定,在乙醚中可以形成稳定的加合物为兰色兰色小结:小结:(NH4)2CrO4(橙黄)Cr2O3(s,绿)CrCr(OH)3(灰绿)Cr(OH)4(亮绿)-Cr2O7(橙红)2-CrO4(黄)2-BaCrO4(s,柠檬黄)Ag2CrO4(s,砖红)PbCrO4(s,黄)Cr3+CrO(O2)2(蓝)O2,H+H+H+H+H+过量OH-OH-氨水或适量OH
32、-H2O2Cl2Br2ClO-Sn2+,Fe2+SO3,H2SI-(Cl-)2-S2O82-H2O2OH-乙醚Ag+Ba2+Pb2+Ba2+Pb2+Ag+H+Cr2+O2Zn4-1 4-1 锰锰 单单 质质1 1、制备:、制备:2 2、物理性质、物理性质(1)块状锰为银白色块状锰为银白色,粉末状为灰色,锰的熔点较高(粉末状为灰色,锰的熔点较高(1247)硬度较大但脆。硬度较大但脆。(2)锰在制合金有重要用途锰在制合金有重要用途9.4 锰(锰(Mn)Mn是是B族元素,族元素,B族包括:锰(族包括:锰(Mn)、锝()、锝(Tc)、铼)、铼(Re)三个元素。称锰族元素)三个元素。称锰族元素 锰的价电
33、子构型锰的价电子构型:3d54S2 氧化态:氧化态:+2、+3、+4、+6、+7。其中以其中以+2、+4、+6和和+7的化合物较常见。的化合物较常见。锰在地壳中的丰度为:约锰在地壳中的丰度为:约0.085%,主要以矿物形式存在。如:,主要以矿物形式存在。如:软锰矿软锰矿(MnO2xH2O)。锰是一种重要的金属元素,应用很广。锰是一种重要的金属元素,应用很广。3 3、化学性质化学性质(2)高温下与卤素、高温下与卤素、O2、S、C、P等非金属直接化合等非金属直接化合(1)锰是活泼金属,呈强还原性锰是活泼金属,呈强还原性(3)在氧化剂存在下与熔融的碱作用生成锰酸盐在氧化剂存在下与熔融的碱作用生成锰酸
34、盐 锰元素电势图锰元素电势图/伏伏1.6951.231.510.5965-0.0514酸性溶液酸性溶液碱性溶液碱性溶液 由电势图和电子层结构可知:由电势图和电子层结构可知:(1)Mn2+很稳定,很稳定,在酸性介质中,在酸性介质中,Mn2+还原性不强还原性不强,与强氧化与强氧化剂才能反应剂才能反应4-2 锰锰(II)的化合物的化合物 说明:说明:鉴定鉴定Mn2+常用常用NaBiO3或或(NH4)2S2O8反应生成反应生成MnO4-溶溶 液显紫色液显紫色 酸化时用酸化时用HNO3不能不能用盐酸用盐酸 C(Mn2+)很低时,也很灵敏很低时,也很灵敏Mn()的强酸盐都易溶于水的强酸盐都易溶于水,水溶液
35、呈淡红色水溶液呈淡红色(2)Mn()在在碱性条件下不稳定碱性条件下不稳定(还原性强还原性强)如:如:MnSO4+2NaOH=Mn(OH)2(白白)+Na2SO42Mn(OH)2+O2=2MnO(OH)2 (棕色棕色)Mn(OH)2 +氧化剂氧化剂 MnO2 或或 K2MnO4MnO2(3)酸性介质中,显强氧化剂酸性介质中,显强氧化剂 4-3 锰锰(IV)的化合物的化合物(1)黑色无定形粉末,不溶于水和稀酸黑色无定形粉末,不溶于水和稀酸(2)热不稳定性热不稳定性(4)在强碱性介质中呈)在强碱性介质中呈还原性,氧化产物为还原性,氧化产物为锰酸盐锰酸盐绿色绿色1、K2MnO4 4-4 锰锰(VI)和
36、和锰锰(VII)的化合物的化合物(1)暗绿暗绿色晶体;色晶体;(2)强碱性溶液中能稳定存在强碱性溶液中能稳定存在(3)在在酸性、中性、弱碱性介质中均自发歧化生成高锰酸盐酸性、中性、弱碱性介质中均自发歧化生成高锰酸盐和二氧化锰和二氧化锰强碱性介质中,锰酸盐能稳定存在的原因:强碱性介质中,锰酸盐能稳定存在的原因:MnO42-/MnO2电对的电极电动势受电对的电极电动势受H+的影响大,而的影响大,而MnO4-/MnO42-电对电对的电极电动势的高低,不受的电极电动势的高低,不受H+的影响。的影响。熔碱熔碱+氧化剂氧化剂+MnO2 MnO42-盐盐K2MnO4在酸介质中歧化,得在酸介质中歧化,得KMn
37、O4和和MnO22、KMnO4KMnO4是是深紫色深紫色晶体晶体,比较稳定;比较稳定;水溶液紫红色水溶液紫红色 光及光及MnO2对对KMnO4的分解起催化作用的分解起催化作用,所以所以KMnO4溶液溶液应保存于应保存于棕色棕色瓶中瓶中遇酸缓慢分解遇酸缓慢分解KMnO4的性质:不稳定性和强氧化性的性质:不稳定性和强氧化性(1 1)不稳定性不稳定性受热分解受热分解(2 2)强氧化性强氧化性还原剂还原剂SO32-I-Cl-H2SFe2+Sn2+氧化产物氧化产物SO42-I2Cl2S或SO42-Fe3+Sn4+溶液的酸度不同,溶液的酸度不同,KMnO4被还原的产物不同被还原的产物不同酸性溶液:酸性溶液
38、:中性或微酸、弱减性:中性或微酸、弱减性:强碱性:强碱性:KMnO4+H2SO4(浓、冷浓、冷)Mn2O7 Mn2O7 呈绿色油状,强氧化性呈绿色油状,强氧化性Mn2O7 +有机物(例乙醇)有机物(例乙醇)爆炸、燃烧爆炸、燃烧MnO4-+5Fe2+8H+=Mn2+5Fe3+4H2O 3 3、应用、应用 在在分析化学中分析化学中应用氧化还原法,应用氧化还原法,用用KMnO4测定铁测定铁等各种物等各种物质的含量。质的含量。生成生成归纳归纳(1)酸性介质中)酸性介质中Mn2+稳定稳定 (2)中性、弱碱性溶液中)中性、弱碱性溶液中MnO2稳定稳定 (3)强碱)强碱性介质中性介质中MnO42-稳定稳定小
39、小 结结(黑褐黑褐)(白色白色)(肉色肉色)(深肉色)深肉色)无无O2+OH-H+KClO3 +KOHH+或或CO2(歧化歧化)H2O+SO32-OH-(浓浓)+SO32-H+或或CO32-(歧化歧化)紫色紫色暗绿暗绿9-5 9-5 铁铁 VIII族包括:铁(族包括:铁(Fe)、钴()、钴(Co)、镍()、镍(Ni)、钌()、钌(Ru)、)、铑(铑(Rh)、钯()、钯(Pd)、锇()、锇(Os)、铱()、铱(Ir)、铂()、铂(Pt)9种元素。种元素。第一过渡系的第一过渡系的Fe、Co、Ni的性质很相似,统称为铁系元素。的性质很相似,统称为铁系元素。第二过渡系、第三过渡系的第二过渡系、第三过渡
40、系的Ru、Rh、Pd、Os、Ir、Pt由于镧由于镧系收缩等原因,性质也很相似称为铂系元素;铂系元素是稀有元系收缩等原因,性质也很相似称为铂系元素;铂系元素是稀有元素,和金(素,和金(Au)、银()、银(Ag)一起又称为贵金属。)一起又称为贵金属。铁铁系系和和铂铂系系元元素素我们主要介绍铁系元素中的铁。我们主要介绍铁系元素中的铁。铁系元素(铁系元素(铁、钴、镍铁、钴、镍)铂系元素(铂系元素(钌、铑、钯、钌、铑、钯、锇、铱、铂锇、铱、铂)5-1 5-1 铁单质铁单质铁系元素的基本性质铁系元素的基本性质元素元素FeCoNi电子层结构电子层结构3d64s23d74s23d84s2氧化态氧化态+2+3(
41、+6)+2+3(+4)+2(+3)稳定性的氧化态稳定性的氧化态+3+2+2标准电极电势标准电极电势(M2+/M)-0.44-0.29-0.25 Fe3+的电子层结构为的电子层结构为3d54s0,所以,所以,Fe3+比比Fe2+稳定。稳定。氧化数为氧化数为+6的铁,主要存在于高铁酸盐中,如:高铁酸钠的铁,主要存在于高铁酸盐中,如:高铁酸钠(Na2FeO4)。)。铁和钾、钙同属第四周期,由于铁的原子半径比钾、钙小很多,铁和钾、钙同属第四周期,由于铁的原子半径比钾、钙小很多,但核电荷数大于钾、钙,所以活泼明显降低。但核电荷数大于钾、钙,所以活泼明显降低。r(K):r(Ca):r(Fe)=2.35A:
42、1.97A:1.26A O O O 铁是自然界分布最广的金属元素之一。铁是迄今为止人类冶铁是自然界分布最广的金属元素之一。铁是迄今为止人类冶炼最多、应用最广泛的金属。铁在地壳中的含量约炼最多、应用最广泛的金属。铁在地壳中的含量约5%5%,在金属中,在金属中仅次于铝。在金属分类中,铁和铬、锰统称为黑色金属仅次于铝。在金属分类中,铁和铬、锰统称为黑色金属铁在自然界的存在:铁在自然界的存在:游离态游离态:陨石中陨石中 化合态化合态:矿石,如磁铁矿矿石,如磁铁矿(Fe(Fe3 3O O4 4)、赤铁矿赤铁矿(Fe(Fe2 2O O3 3)、褐铁矿、褐铁矿 (2Fe(2Fe2 2O O3 33H3H2
43、2O)O)、菱铁矿菱铁矿(FeCO(FeCO3 3)。1 1、铁的物理性质:、铁的物理性质:()纯净的铁是银白色金属()纯净的铁是银白色金属,有光泽有光泽(2 2)具有良好的延展性和坚韧性)具有良好的延展性和坚韧性(3 3)是电和热的良导体)是电和热的良导体(4 4)密度是)密度是7.86g/cm37.86g/cm3,熔点:,熔点:15351535沸点是沸点是27502750(5 5)特性)特性:能被磁体吸引,在磁场作用下可以被磁化而具铁磁性能被磁体吸引,在磁场作用下可以被磁化而具铁磁性 纯铁抗腐蚀力强,但通常铁都含有碳或其他元素,因而熔点降纯铁抗腐蚀力强,但通常铁都含有碳或其他元素,因而熔点
44、降低,抗腐蚀力弱。低,抗腐蚀力弱。(1 1)与非金属反应()与非金属反应(ClCl2 2、BrBr2 2、I I2 2、OO2 2、S S等等)2 2、铁的化学性质铁的化学性质:2Fe+3Cl2 2FeCl3 现象现象:褐色褐色的烟的烟 3Fe+2O2 Fe3O4 Fe+S FeS (黑色)(黑色)铁是比较活泼的金属,一定条件下能与许多非金属和铁是比较活泼的金属,一定条件下能与许多非金属和某些化合物反应。某些化合物反应。问:问:如何制取如何制取FeCl2?铁与铁与Br2、I2反应的产物是什么?反应的产物是什么?如持续加热呢?如持续加热呢?硫和碘的性质相似性,与铁反应都生成亚铁硫和碘的性质相似性
45、,与铁反应都生成亚铁(2 2)与某些盐溶液反应与某些盐溶液反应Fe+CuSO4 FeSO4+Cu(3 3)与酸反应与酸反应:(a)(a)与非氧化性酸反应(置换反应)与非氧化性酸反应(置换反应)Fe+2HCl 2FeCl2+H2Fe+H2SO4(稀稀)FeSO4+H2 Fe+Fe2(SO4)3 3FeSO4 想想:想想:上述两个反应在实际生产和实验室有哪些应上述两个反应在实际生产和实验室有哪些应 用用 想想有哪些现象?想想有哪些现象?(b b)与氧化性酸反应与氧化性酸反应(HNOHNO3 3、浓浓H H2 2SOSO4 4)常温下与浓硝酸、浓硫酸产生钝化现象常温下与浓硝酸、浓硫酸产生钝化现象加热
46、时反应。加热时反应。2Fe+6H2SO4(浓浓)Fe2(SO4)3+3SO2+6H2OFe+4HNO3(稀稀)Fe(NO3)3+NO+2H2OFe+6HNO3(浓浓)Fe(NO3)3+3NO2 +3H2O想想:钝化是否没反应?想想:钝化是否没反应?哪些金属也有此性质哪些金属也有此性质与稀硝酸不加热也反应,产物不是氢气与稀硝酸不加热也反应,产物不是氢气思考:加过量铁时产物会有什么变化?如何写方程式思考:加过量铁时产物会有什么变化?如何写方程式?4 4、与水反应:与水反应:常温下通常不与水反应,常温下通常不与水反应,高温时可以反应高温时可以反应Fe3O43Fe+4H2O(g)+4H+4H2 2高温
47、高温 从上述反应比较上述反应比较FeFe与与H H2 2的还原性可得到什么启示?的还原性可得到什么启示?5 5、不纯铁的电化腐蚀反应、不纯铁的电化腐蚀反应反应式:反应式:4Fe+nH2O+3O22Fe2O3nH2O 想想想想 铁的电化腐蚀实际是怎么进行的?铁的电化腐蚀实际是怎么进行的?+:O2+2H2O+4e=4OH-:Fe 2e=Fe2+Fe2+2OH-=Fe(OH)24Fe(OH)2+O2+2H2O4Fe(OH)3Fe(OH)3Fe2O3XH2O 未配平未配平讨论题:讨论题:1、把铁投入下列溶液中,铁与下列物质不反应的、把铁投入下列溶液中,铁与下列物质不反应的是是 ()A.HAc溶液溶液
48、B.浓硝酸浓硝酸 C.浓硫酸浓硫酸 D.稀硝酸稀硝酸 E.氢氧化钠溶液氢氧化钠溶液 F.二氧化硫水溶液二氧化硫水溶液2、由两种金属组成的合金、由两种金属组成的合金50克,与氯气完全反应,克,与氯气完全反应,消耗氯气消耗氯气71克,则该金属的可能组成是克,则该金属的可能组成是 ()A.Cu和和Zn B.Na和和Al C.Fe和和Cu D.Mg和和CaEC3、下列可用铁桶较长期盛装的是、下列可用铁桶较长期盛装的是 ()A.FeCl3(溶液溶液)B.CuSO4(溶液溶液)C.4mol/L HNO3 (冷冷)D.18mol/L H2SO4(冷冷)E.AlCl3(溶液溶液)D4、将铁粉撒入下列溶液中充分
49、反应后,溶液将铁粉撒入下列溶液中充分反应后,溶液的质量增加但无气体放出的是的质量增加但无气体放出的是 ()A、CuCl2 B、H2SO4 C、AgNO3 D、Fe2(SO4)D 2 2、铁的化合物、铁的化合物 铁是比较活泼的金属,在自然界主要以化合态和矿铁是比较活泼的金属,在自然界主要以化合态和矿物形式存在。物形式存在。铁的化合物主要有:铁的化合物主要有:铁的氧化物铁的氧化物 铁的氢氧化物铁的氢氧化物 铁盐铁盐名名 称称俗俗 称称化学式化学式氧化亚铁氧化亚铁氧化铁氧化铁四氧化三铁四氧化三铁共共 性性与与酸酸与与 还还 原剂原剂氧化铁红氧化铁红磁性氧化铁磁性氧化铁黑色粉末黑色粉末红棕色粉末红棕色
50、粉末黑色晶体黑色晶体+2+3+2,+3不不 溶溶不不 溶溶不不 溶溶碱碱 性性 氧氧 化化 物物都能与酸反应。如都能与酸反应。如都能被还原。如都能被还原。如(1 1)铁的氧化物:)铁的氧化物:色色 态态化合价化合价水溶性水溶性类类 型型(a a)铁的氧化物性质比较)铁的氧化物性质比较(b b)铁的氧化物生成和相互转化)铁的氧化物生成和相互转化 铁的氧化物生成铁的氧化物生成 3 3Fe+4O2 2Fe3O4 2Fe(OH)3 Fe2O3+3H2O 铁的氧化物相互转化铁的氧化物相互转化 Fe3O4 Fe FeO Fe2O3 点燃点燃CO,H2O2CO,H2CO,H2CO,H2O2 将将NaOHNa
51、OH溶液滴入溶液滴入FeClFeCl3 3溶液溶液 产生产生红褐色沉淀红褐色沉淀 将将NaOHNaOH溶液滴到新制的溶液滴到新制的FeSOFeSO4 4溶液中。溶液中。产生产生白色沉淀白色沉淀灰绿色灰绿色红褐色红褐色离子方程式和化学方程式:离子方程式和化学方程式:(2 2)铁的氢氧化物:)铁的氢氧化物:Fe3+3OH-Fe(OH)3(红褐色红褐色)Fe2+2OH-Fe(OH)2(白色)白色)4Fe(OH)2+O2+2H2O 4Fe(OH)3(a)(a)铁的氢氧化物的制备铁的氢氧化物的制备(b b)铁的氢氧化物的主要性质)铁的氢氧化物的主要性质具有不溶性碱的共性具有不溶性碱的共性热不稳定性热不稳
52、定性 2Fe(OH)3 Fe2O3+3H2O具有碱性氢氧化物的性质,与酸等反应具有碱性氢氧化物的性质,与酸等反应(2)Fe()盐盐 Fe能形成稳定的能形成稳定的+3价简单盐,常见的是强酸盐;价简单盐,常见的是强酸盐;Fe(NO3)36H2O、FeCl36H2O、Fe2(SO4)312H2O。溶解性:溶解性:都易溶于水。盐中的都易溶于水。盐中的Fe(H2O)63+(浅紫色),浅紫色),它也可存在于它也可存在于pH=0左右的强酸性溶液中。左右的强酸性溶液中。水解性:水解性:Fe()盐比盐比Fe()更易水解,使溶液呈黄色)更易水解,使溶液呈黄色或红棕色。或红棕色。Fe(H2O)63+H2O Fe(O
53、H)(H2O)52+H3O+Fe(OH)(H2O)52+H2O Fe(OH)2(H2O)4+H3O+3.3.一些重要的铁盐一些重要的铁盐(1)Fe()盐:盐:强酸盐都易溶于水,并微弱水解,显示酸性;强酸盐都易溶于水,并微弱水解,显示酸性;水合盐晶体及其水溶液呈现浅绿色:水合盐晶体及其水溶液呈现浅绿色:Fe(H2O)62+,如,如 FeSO47H2O:俗称绿矾,浅绿色俗称绿矾,浅绿色 复盐复盐(NH4)2SO4FeSO46H2O硫酸亚铁铵,俗称摩尔盐硫酸亚铁铵,俗称摩尔盐(它比(它比FeSO4更稳定,常作分析化学中的还原剂)更稳定,常作分析化学中的还原剂)水解及双水解反应水解及双水解反应如:如:
54、FeCl3溶液呈酸性与溶液呈酸性与Na2CO3的双水解反应:的双水解反应:2Fe3+3CO32-+3H2O 2Fe(OH)3+3CO2 Fe3+CO32-HCO3-AlO2-等等Fe3+与与S2-、I-、H2S等应该发生什么反应呢?等应该发生什么反应呢?想想想想 Fe3+与下列微粒反应的离子反应和化学方程式与下列微粒反应的离子反应和化学方程式 的书写的书写(a a)FeClFeCl3 3的化学性质的化学性质与可溶碱的反应:与可溶碱的反应:如:氨水、烧碱等反应如:氨水、烧碱等反应与某些盐的反应与某些盐的反应:如:硝酸银等的反应如:硝酸银等的反应强氧化性:强氧化性:与与H2S、Fe、Cu、KI、S
55、2-、I-等的反应等的反应 2Fe3+H2S S+2Fe2+2H+2Fe3+Cu 2Fe2+Cu2+Fe的配合物和的配合物和Fe3+检验:检验:(a a)硫氰配合物)硫氰配合物 实验实验在在FeCl3稀溶液中滴入数滴稀溶液中滴入数滴 KSCN溶液,溶液,溶液呈溶液呈血红血红色;再加入少量还原铁粉,红色褪去;色;再加入少量还原铁粉,红色褪去;取出上层液,再滴入氯水或取出上层液,再滴入氯水或H2O2,溶液又显,溶液又显红红色色离子反应方程式:离子反应方程式:Fe3+nSCN-Fe(SCN)n(3-n)+6种配离子。种配离子。(6种配离子溶于水均呈种配离子溶于水均呈血红血红色)色)该反应十分灵敏,可
56、检出微量该反应十分灵敏,可检出微量FeFe3+3+;常用于;常用于FeFe3+3+的定性检验的定性检验 2Fe(SCN)2+Fe 3Fe2+SCN-2Fe2+Cl2 2Fe3+2Cl-Fe3+nSCN-Fe(SCN)n(3-n)+(血红血红色)色)(b b)氰配合物)氰配合物 向向Fe3+溶液中加入六氰合铁(溶液中加入六氰合铁()酸钾(习惯称亚铁)酸钾(习惯称亚铁氰化钾氰化钾-黄血盐)黄血盐)K4Fe(CN)6溶液,出现兰色沉淀称普溶液,出现兰色沉淀称普鲁士蓝。用于检验鲁士蓝。用于检验Fe3+反应式:反应式:K+Fe(CN)64-+Fe3+KFeFe(CN)6 (普鲁士蓝普鲁士蓝)(b)(b)
57、亚铁盐的化学性质亚铁盐的化学性质与可溶碱的反应:与可溶碱的反应:如如:氨水、烧碱等的反应氨水、烧碱等的反应较强的较强的还原性:还原性:如如:可以被氯水、溴水、双氧水、可以被氯水、溴水、双氧水、HNOHNO3 3、KMnO4、K2Cr2O7、O2等氧化剂氧化等氧化剂氧化Fe(NOFe(NO3 3)2 2的特殊性:的特殊性:在溶液在溶液Fe(NOFe(NO3 3)2 2的的中加入盐酸或硫酸有何现象中加入盐酸或硫酸有何现象溶液变为棕黄色溶液变为棕黄色如:如:6Fe2+Cr2O72-+14H+6Fe3+2Cr3+7H2O 空气中:空气中:4Fe2+O2+4H+4Fe3+2H2O Fe的配合物和的配合物
58、和Fe2+的检验:的检验:向向Fe3+溶液中加入六氰合铁(溶液中加入六氰合铁()酸钾(习)酸钾(习惯称铁氰化钾惯称铁氰化钾-赤血盐)赤血盐)K3Fe(CN)6溶液,出现溶液,出现兰色沉淀称滕氏蓝。用于检验兰色沉淀称滕氏蓝。用于检验Fe2+反应式:反应式:K+Fe(CN)63-+Fe2+KFeFe(CN)6 (滕氏滕氏蓝蓝)经结构分析测定经结构分析测定普鲁士蓝和滕氏蓝不但化学式普鲁士蓝和滕氏蓝不但化学式相同都是:相同都是:KFeFe(CN)6;而且而且结构也是一样结构也是一样的,都是内界为铁(的,都是内界为铁()外界为铁()外界为铁()。)。铁铁还能形成其它配合物,还能形成其它配合物,如:如:F
59、e(CO)Fe(CO)5 5 五羰基五羰基合铁(合铁(0 0)(浅黄色液体)等。)(浅黄色液体)等。练练练练 FeFe3+3+、FeFe2+2+、FeFe的相互转化的的相互转化的一些反应式一些反应式 FeBr2+Cl2(逐滴至过量逐滴至过量)FeI2+Cl2(逐滴至过量逐滴至过量),FeCl3+HI FeCl3+H2S Fe(少)(少)+HNO3(稀稀)Fe(过量过量)+HNO3(稀)(稀)FeCl3+Na2CO3 FeCl3+NaHCO3 FeS+HNO3(稀)(稀)FeCl2+NaOH(4 4)FeFe2+2+、FeFe3+3+的检验和确定存在的检验和确定存在 KSCN溶液溶液 K4Fe(
60、CN)6 NaOH溶液溶液Fe3+检验检验现象现象溶液呈血红色溶液呈血红色红褐色沉淀红褐色沉淀Fe2+检验检验NaOH溶液溶液K3Fe(CN)6KSCN溶液溶液 后,再加氯水或过氧化氢后,再加氯水或过氧化氢白色沉淀白色沉淀灰绿色灰绿色红褐色红褐色先无现象,再加后溶液呈血红色先无现象,再加后溶液呈血红色兰色沉淀兰色沉淀兰色沉淀兰色沉淀1、家用炒菜铁锅用水清洗放置后,出现红棕色的锈、家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是斑,在此变化过程中不发生的化学反应是 ()A.4Fe(OH)22H2OO24Fe(OH)3 B.2Fe2H2OO2 2Fe(OH)2 C.2
61、H2OO24e OH D.Fe3e Fe3 D讨论题讨论题2、在稀盐酸中投入铜粉没有现象,在此溶液中加入、在稀盐酸中投入铜粉没有现象,在此溶液中加入下列物质,铜会溶解的是下列物质,铜会溶解的是 ()A.适量氯化铜溶液适量氯化铜溶液 B.适量氯化铁溶液适量氯化铁溶液 C.适量硝酸钠固体适量硝酸钠固体 D.适量银粉适量银粉BC三、炼铁和炼钢三、炼铁和炼钢(一)炼铁(一)炼铁 1、铁合金、铁合金(1)生铁:)生铁:含碳量含碳量24.3%的铁合金的铁合金 硬而脆硬而脆 生铁中除含碳外,还含生铁中除含碳外,还含Si、Mn和少量和少量S、P等。等。根据碳在铁中存在的形态不同,生铁分为:根据碳在铁中存在的形
62、态不同,生铁分为:炼钢生铁炼钢生铁 (又称白口铁)(又称白口铁)铸造生铁铸造生铁 (又称灰口铁)(又称灰口铁)球墨生铁球墨生铁其他生铁:如硅铁、锰铁其他生铁:如硅铁、锰铁生铁生铁 2、钢、钢 钢也是铁合金,含碳一般钢也是铁合金,含碳一般0.032%钢的性能:坚硬、有韧性、弹性,可锻造、钢的性能:坚硬、有韧性、弹性,可锻造、延压、铸造。延压、铸造。低碳钢:含碳量低于低碳钢:含碳量低于0.3%碳素钢碳素钢 中碳钢:含碳量中碳钢:含碳量0.30.6%钢钢(普通钢)(普通钢)高碳钢:含碳量大于高碳钢:含碳量大于0.6%钨钢、锰钢:硬度大,可制刀具、履带等钨钢、锰钢:硬度大,可制刀具、履带等 合金钢合金
63、钢 锰硅钢:韧性特别强,可制弹簧圈等锰硅钢:韧性特别强,可制弹簧圈等 (特种钢)(特种钢)钨铬钢:韧性好硬度大,制刀具、模具等钨铬钢:韧性好硬度大,制刀具、模具等 镍铬钢(不锈钢):抗腐蚀、耐氧化,制镍铬钢(不锈钢):抗腐蚀、耐氧化,制 医疗器件、餐具等医疗器件、餐具等3 3、炼铁:、炼铁:铁在地壳里以矿物形式存在称为铁矿石铁在地壳里以矿物形式存在称为铁矿石铁矿石主要有:铁矿石主要有:磁铁矿石(主要成分:磁铁矿石(主要成分:Fe3O4):黑色或略带浅兰:黑色或略带浅兰 色色 晶体,有磁性。晶体,有磁性。赤铁矿石(主要成分:赤铁矿石(主要成分:Fe2O3):暗红,含铁多:暗红,含铁多 会呈黑色。
64、会呈黑色。褐铁矿石(主要成分:褐铁矿石(主要成分:2Fe2O33H2O):褐色、黄:褐色、黄 褐色、黑褐色褐色、黑褐色菱铁矿石(主要成分:菱铁矿石(主要成分:FeCO3):黄白、浅褐、深:黄白、浅褐、深 褐色褐色(1 1)炼铁原理:)炼铁原理:利用氧化还原反应,在高温利用氧化还原反应,在高温下,用还原剂把矿石中的铁还原出来。下,用还原剂把矿石中的铁还原出来。(2 2)炼铁设备:)炼铁设备:高炉高炉高炉构造:高炉构造:5个部分组成:炉喉、炉身、炉腰、个部分组成:炉喉、炉身、炉腰、炉腹、炉缸炉腹、炉缸 5个口:进料口、进风口、出铁口、个口:进料口、进风口、出铁口、出渣口、高炉煤气出口出渣口、高炉煤
65、气出口(3 3)炼铁原料:)炼铁原料:铁矿石、焦炭(还原剂)、石灰石(作熔剂)铁矿石、焦炭(还原剂)、石灰石(作熔剂)炼铁高炉炼铁高炉(4 4)炼铁过程和主要反应:)炼铁过程和主要反应:反应:反应:C+CO2 CO2+Q CO2+C 2CO Q Fe2O3+3CO 2Fe+3CO2除脉石:除脉石:CaCO3 CaO+CO2 CaO+SiO2 CaSiO3产品:产品:生铁生铁主要用于炼钢主要用于炼钢炉渣炉渣作水泥、渣砖作水泥、渣砖高炉煤气(高炉煤气(CO、CO2、N2等)等)净化处理后作净化处理后作 气体燃料。气体燃料。高温高温高温高温高温高温(二)炼钢:(二)炼钢:原理:原理:利用氧化还原反应
66、利用氧化还原反应,把生铁中过多,把生铁中过多 的碳和其他杂质锰、硅、硫、磷等的碳和其他杂质锰、硅、硫、磷等 杂质氧化成气体或炉渣除去杂质氧化成气体或炉渣除去。目的:目的:适当降低生铁里的含碳量,除去大适当降低生铁里的含碳量,除去大 部分部分S、P等有害物质,调整钢里合等有害物质,调整钢里合 金元素的含量金元素的含量。原料:原料:生铁生铁 氧化剂:氧化剂:O2(或空气)、氧化铁(或空气)、氧化铁 造渣材料:生石灰(造渣材料:生石灰(CaO)主要反应:主要反应:2Fe+O2 2FeO+Q Mn+FeO MnO+Fe+Q Si+2FeO SiO2+2Fe+Q C+FeO CO+Fe+Q SiO2+FeO FeOSiO2 SiO2+MnO MnOSiO2 FeS+CaO FeO+CaS 2P+5FeO+3CaO 5Fe+Ca3(PO4)2 FeOSiO2+CaO CaOSiO2+FeO Si+2FeO 2Fe+SiO2 Mn+FeO MnO+Fe 2Al+3FeO 3Fe+Al2O3 高温高温高温高温高温高温高温高温高温高温高温高温高温高温高温高温高温高温脱脱S脱脱P高温高温脱氧脱氧,调节调节
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
