 生物化学:第一章 蛋白质的结构与功能
生物化学:第一章 蛋白质的结构与功能


《生物化学:第一章 蛋白质的结构与功能》由会员分享,可在线阅读,更多相关《生物化学:第一章 蛋白质的结构与功能(102页珍藏版)》请在装配图网上搜索。
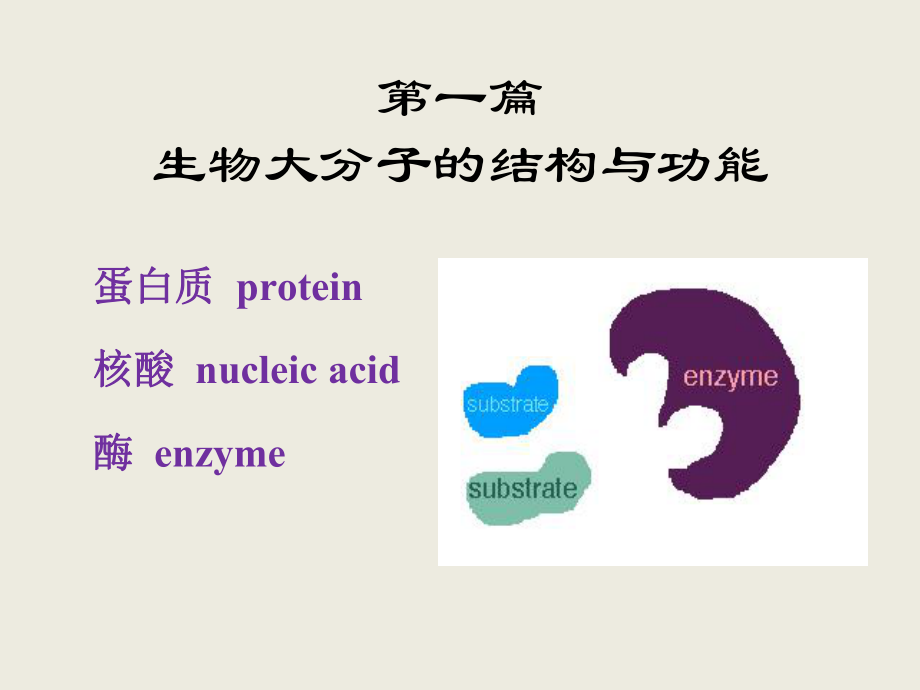
1、第一篇生物大分子的结构与功能蛋白质蛋白质 protein核酸核酸 nucleic acid酶酶 enzyme第一章蛋白质的结构与功能 protein Pro,Pr,P蛋白质蛋白质 (protein)(protein)是由许多是由许多氨基酸氨基酸 (amino(amino acids)acids)通过通过肽键肽键 (peptide bond)(peptide bond)相连形成的相连形成的高分子高分子含氮含氮化合物。化合物。蛋白质的生物学功能蛋白质的生物学功能作为生物催化剂(酶)作为生物催化剂(酶)代谢调节作用代谢调节作用免疫保护作用免疫保护作用物质的转运和存储物质的转运和存储运动与支持的作用运
2、动与支持的作用参与细胞间信息传递参与细胞间信息传递氧化供能氧化供能 蛋白质是生物体的基本组成成分之一,几蛋白质是生物体的基本组成成分之一,几乎参与了生命活动的所有过程。乎参与了生命活动的所有过程。含量:含量:约占约占固体固体成分的近成分的近1/2(45%)种类:种类:一个真核细胞达数千种,每一种一个真核细胞达数千种,每一种 均有其特定的结构与功能均有其特定的结构与功能分布广,含量高分布广,含量高第一节 蛋白质的分子组成碳、氢、氧、碳、氢、氧、氮氮 、硫、硫 (C、H、O、N、S )以及磷、以及磷、铁、铁、铜、铜、锌、锌、碘、碘、硒硒元素组成元素组成:蛋白质平均含氮量(蛋白质平均含氮量(N%):
3、):16%蛋白质含量蛋白质含量=含氮克数含氮克数6.256.25(凯氏定氮法)(凯氏定氮法)1/16%存在自然界中的氨基酸有300余种,但组成人体蛋白质(参与编码蛋白质的参与编码蛋白质的)的基本氨基酸仅有2020种。一、基本组成单位一、基本组成单位氨基酸氨基酸(amino acid,AA)H甘氨酸甘氨酸CH3丙氨酸丙氨酸L-L-氨基酸的通式氨基酸的通式RC+NH3COO-Hl1.20种种AA中除中除Pro外,与羧基相连的外,与羧基相连的-碳原子上碳原子上都有一个氨基,因而称都有一个氨基,因而称-氨基酸。氨基酸。l2.不同的不同的-AA,其,其R侧链不同。氨基酸侧链不同。氨基酸R侧链对侧链对蛋白
4、质空间结构和理化性质有重要影响。蛋白质空间结构和理化性质有重要影响。l3.除除Gly的的R侧链为侧链为H原子外,其他原子外,其他AA的的-碳原子碳原子都是不对称碳原子,可形成不同的构型,因而具有都是不对称碳原子,可形成不同的构型,因而具有旋光性。旋光性。组成人体蛋白质的氨基酸都为组成人体蛋白质的氨基酸都为L-AA(Gly,Pro除外)除外)。二、氨基酸的分类二、氨基酸的分类按按侧链的结构侧链的结构和和理化性质理化性质可分为:可分为:非极性、脂肪族非极性、脂肪族氨基酸氨基酸 极性、中性极性、中性氨基酸氨基酸 芳香族芳香族氨基酸氨基酸 酸性酸性氨基酸氨基酸 碱性碱性氨基酸氨基酸甘氨酸甘氨酸 gly
5、cine Gly G 5.97丙氨酸丙氨酸 alanine Ala A 6.00缬氨酸缬氨酸 valine Val V 5.96亮氨酸亮氨酸 leucine Leu L 5.98 异亮氨酸异亮氨酸 isoleucine Ile I 6.02 苯丙氨酸苯丙氨酸 phenylalanine Phe F 5.48脯氨酸脯氨酸 proline Pro P 6.30亚氨基酸亚氨基酸Phe脯氨酸脯氨酸Pro吡咯烷环吡咯烷环-杂环氨基酸杂环氨基酸1.1.非极性脂肪族氨基酸非极性脂肪族氨基酸(侧链含烃链的氨基酸侧链含烃链的氨基酸)2.2.极性中性氨基酸极性中性氨基酸(侧链有极性但不带电荷的氨基酸侧链有极性但不
6、带电荷的氨基酸)3.3.芳香族氨基酸芳香族氨基酸(侧链含芳香基团的氨基酸侧链含芳香基团的氨基酸)TrpTyr天冬氨酸天冬氨酸 aspartic acid Asp D 2.97 谷氨酸谷氨酸 glutamic acid Glu E 3.22 赖氨酸赖氨酸 lysine Lys K 9.74精氨酸精氨酸 arginine Arg R 10.76组氨酸组氨酸 histidine His H 7.595.碱性氨基酸碱性氨基酸-胍基胍基咪唑基咪唑基杂环氨基酸杂环氨基酸4.酸性氨基酸酸性氨基酸芳香芳香族氨基酸:族氨基酸:含含羟基羟基氨基酸:氨基酸:含含硫硫氨基酸:氨基酸:碱性碱性氨基酸:氨基酸:酸性酸性氨
7、基酸氨基酸亚氨基酸亚氨基酸:支链支链氨基酸:氨基酸:Trp、Tyr、PheSer、Thr、TyrCys、MetHis、Arg、LysAsp、GluProVal、Leu、Ile目目 录录几种特殊氨基酸几种特殊氨基酸 脯氨酸脯氨酸(亚氨基酸)(亚氨基酸)CH2CHCOO-NH2+CH2CH2CH2CHCOO-NH2+CH2CH2目目 录录-OOC-CH-CH2-S+NH3S-CH2-CH-COO-+NH3-OOC-CH-CH2-S+NH3S-CH2-CH-COO-+NH3 半胱氨酸半胱氨酸 +胱氨酸胱氨酸二硫键二硫键-HH-OOC-CH-CH2-SH+NH3-OOC-CH-CH2-SH+NH3HS
8、-CH2-CH-COO-+NH3HS-CH2-CH-COO-+NH3目目 录录修饰氨基酸:修饰氨基酸:蛋白质合成后通过修饰加工生成的氨基蛋白质合成后通过修饰加工生成的氨基酸。没有相应的编码。如:胱氨酸、羟脯氨酸。没有相应的编码。如:胱氨酸、羟脯氨酸(酸(Hyp)、羟赖氨酸()、羟赖氨酸(Hyl)。)。不构成人体蛋白的氨基酸:不构成人体蛋白的氨基酸:人体蛋白质中不存在的氨基酸。如:瓜人体蛋白质中不存在的氨基酸。如:瓜氨酸、鸟氨酸、同型半胱氨酸,是代谢途径氨酸、鸟氨酸、同型半胱氨酸,是代谢途径中产生的。中产生的。1968 1968年美国年美国DudrickDudrick,在研究人体营养学工作中,利
9、用结晶氨,在研究人体营养学工作中,利用结晶氨基酸配出了氨基酸输液,挽救了很多病人的生命。基酸配出了氨基酸输液,挽救了很多病人的生命。用于大面积烧伤、创伤及严重感染等应激状态用于大面积烧伤、创伤及严重感染等应激状态下肌肉分解代谢亢进、消化系统功能障碍、营下肌肉分解代谢亢进、消化系统功能障碍、营养恶化及免疫功能下降的病人的营养支持,亦养恶化及免疫功能下降的病人的营养支持,亦用于手术后病人,改善其营养状态。用于手术后病人,改善其营养状态。氨基酸营养输液是继氨基酸营养输液是继“疫苗疫苗”、“维生素维生素”、“抗生素抗生素”之后,之后,被誉为二十世纪医疗史上的四被誉为二十世纪医疗史上的四个里程碑。个里程
10、碑。氨基酸注射液氨基酸注射液三、三、2020种氨基酸具有共同或特异的理化性质种氨基酸具有共同或特异的理化性质n两性解离及等电点两性解离及等电点氨基酸是两性电解质,其解离程度取决于所氨基酸是两性电解质,其解离程度取决于所处溶液的酸碱度。处溶液的酸碱度。等电点等电点(isoelectric point,pI)在某一在某一pH的溶液中,氨基酸解离成阳离子和的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电阴离子的趋势及程度相等,成为兼性离子,呈电中性。此时溶液的中性。此时溶液的pH值值称为该氨基酸的称为该氨基酸的等电点等电点。1.1.氨基酸具有氨基酸具有两性解离两性解离的性质的
11、性质pH=pI+OH-pHpI+H+OH-+H+pHpI氨基酸的兼性离子氨基酸的兼性离子 阳离子阳离子阴离子阴离子CHNH2COOHR CHNH2COOHRCHNH3+COO-R CHNH3+COO-RCHNH2COO-R CHNH2COO-RCH COOHRNH3+CH COOHRNH3+含有含有共轭双键共轭双键的芳香族氨基酸的芳香族氨基酸 Trp,Tyr 的最大的最大吸收峰在吸收峰在280nm波长附近。波长附近。2.2.紫外吸收性质紫外吸收性质 该蓝紫色化合物在该蓝紫色化合物在570nm波长处有最大波长处有最大吸收,可用于氨基酸的定量分析。吸收,可用于氨基酸的定量分析。3.3.茚三酮反茚三
12、酮反应应蓝紫色化合物蓝紫色化合物(一)氨基酸通过肽键连接成肽(一)氨基酸通过肽键连接成肽肽键肽键(peptide bond)是由一个氨基酸的是由一个氨基酸的-羧基与另一个氨基酸的羧基与另一个氨基酸的-氨基脱水缩合氨基脱水缩合而形成的化学键。而形成的化学键。H2N C CHR1OHO+N CHHHR2COOHH2OH2N CCHR1ONCHR2COOHH肽键四、四、肽与肽键肽与肽键(peptide and peptide bond)NH2-CH-CHOOH甘甘氨氨酸酸NH2-CH-CHOOH甘甘氨氨酸酸NH-CH-CHOHO OH甘甘氨氨酸酸+-HOH甘氨酰甘氨酸甘氨酰甘氨酸肽键肽键NH2-CH
13、-C-N-CH-COOHHHHONH2-CH-C-N-CH-COOHHHHO*肽是由氨基酸通过肽键缩合而形成的化合物。*两分子氨基酸缩合形成二肽,三分子氨基酸缩合则形成三肽*肽链中的氨基酸分子因为脱水缩合而基团不全,被称为氨基酸残基(residue)。*由十个以内氨基酸相连而成的肽称为寡肽(oligopeptide),由更多的氨基酸相连形成的肽称多肽(polypeptide)。氨基酸残基氨基酸残基(residue)谷胱甘肽(谷胱甘肽(glutathione,GSH)还原型还原型氧化型氧化型-肽键肽键(1)体内重要的还原剂体内重要的还原剂 保护蛋白质和酶分子中的巯基免遭氧化,保护蛋白质和酶分子中
14、的巯基免遭氧化,使蛋白质处于活性状态。使蛋白质处于活性状态。(2)(2)谷胱甘肽的巯基作用谷胱甘肽的巯基作用 可以与致癌剂或药物等结合可以与致癌剂或药物等结合,从而阻断这从而阻断这些化合物与些化合物与DNA、RNA或或蛋白质结合,保护机体免遭毒性损害。蛋白质结合,保护机体免遭毒性损害。促甲状腺素释放激素(促甲状腺素释放激素(3肽)肽)由下丘脑分泌,促进腺垂体分泌促甲状腺素。由下丘脑分泌,促进腺垂体分泌促甲状腺素。第二节 蛋白质的分子结构 蛋白质是蛋白质是氨基酸氨基酸通过通过肽键肽键相连形成的相连形成的具有三维结构的生物具有三维结构的生物大分子。一般将蛋白大分子。一般将蛋白质分子的结构分为四质分
15、子的结构分为四个层次来学习。个层次来学习。Ribulose-1,5-bisphosphate carboxylase/oxygenase蛋白质分子的结构层次蛋白质分子的结构层次一二一二 蛋白质的一级结构就是蛋白质多肽链中氨基酸残基蛋白质的一级结构就是蛋白质多肽链中氨基酸残基的排列顺序。主要化学键是的排列顺序。主要化学键是肽键肽键,有的还包含,有的还包含二硫键二硫键。一、蛋白质的一级结构一、蛋白质的一级结构(primary structure)(primary structure)一级结构一级结构是蛋白质是蛋白质空间构象空间构象和特异生物学功能的和特异生物学功能的基础基础。二、蛋白质的二级结构二
16、、蛋白质的二级结构(secondary structure)(secondary structure)二级结构的主要结构单位二级结构的主要结构单位肽单元(肽单元(peptide unitpeptide unit)二级结构的主要化学键二级结构的主要化学键 氢键氢键 (hydrogen bond)(hydrogen bond)蛋白质的二级结构是指多肽链中蛋白质的二级结构是指多肽链中主链骨架主链骨架原原子的子的局部空间局部空间排布,不涉及氨基酸侧链的构象。排布,不涉及氨基酸侧链的构象。稳定因素:稳定因素:氢键氢键肽单元(肽单元(peptide unit)肽单元具有这样一些特性:(1)早在1925年,
17、Pauling等人就发现,肽键肽键中的C-N比相邻的C-N单键短,而较一般C=N双键长。可见,肽键中-C-N-键的性质介于单、双键之间,具有部分部分双键双键的性质,因而不能旋转,这就将其固定在一个平面之内。CCNOHCCCNOHC(2)肽键平面 肽键的C及N周围三个 键 角 之 和 均 为360,说明都处于一个平面上,也就是说肽单元的六个原子基本上同处于一个平面,是一个刚性平面,这就是 肽 平 面。(3)肽键中的C-N既然具有双键性质,就会有顺反不同的立体异构,已证实肽单元两个-碳原子呈反向分布。-螺旋螺旋(-helix)-折叠折叠(-pleated sheet)-转角转角(turn or -
18、bend)无规卷曲无规卷曲(random coil)肽链中能够旋转的只有-碳原子所形成的单键,肽单元上C所连的两个单键的旋转角度,决定两个相连肽单元的相对空间位置,肽平面成为肽链盘曲折叠的基本单位。由于肽平面和氨基酸残基侧链R基对多肽链构象的限制作用,二级结构只有以下几种主要形式:常见的蛋白质二级结构常见的蛋白质二级结构 多个肽平多个肽平面通过面通过CC的旋的旋转,相互之间转,相互之间紧密盘曲成稳紧密盘曲成稳固的固的右手螺旋右手螺旋。-helix 主链螺旋上升,每3.6个氨基酸残基上升一圈,螺距0.54nm。肽平面和螺旋长轴平行。-helix 相邻两圈螺旋之间借肽键中羰基氧(CO)和亚氨基氢(
19、NH)形成许多链内氢键,即每一个氨基酸残基中的亚氨基氢和前面相隔三个残基的羰基氧之间形成氢键,这是稳定-螺旋的主要化学键。-helix 肽链中氨基酸残基侧链R基,分布在螺旋外侧,其形状、大小及电荷均会影响-螺旋的形成。-helix 是肽链相当伸展的结构,肽平面之间折叠成锯齿状,相邻肽平面间呈110角。依靠两条肽链或一条肽链内的两段肽链间的羰基氧与亚氨基氢形成氢键,使构象稳定。也就是说,氢键是稳定-折叠的主要化学键。-pleated sheet两段肽链可以是平行的,也可以是反平行的。即前者两条链从N端到C端是同方向的,后者是反方向的。-折叠结构的形式十分多样,正、反平行还可以相互交替。平行的-折
20、叠结构中,两个残基的间距为0.65nm;反平行的-折叠结构,则间距为0.7nm。氨基酸残基的侧链R基分布在片层的上方或下方。turn 蛋白质分子中,肽链经常会出现180的回折,在这种回折角处的构象就是-转角(-turn)或称-折角(-bend)。-转角中,第一个氨基酸残基的羰基氧与第四个残基的亚氨基氢形成氢键,从而使结构稳定。氢键氢键 无规卷曲无规卷曲是用来阐述没有确定规律性的那部分肽链是用来阐述没有确定规律性的那部分肽链结构。结构。“无规卷曲无规卷曲”也像其它二级结构那样是也像其它二级结构那样是明确而稳定明确而稳定的结构的结构,但是它们受氨基酸残基侧链,但是它们受氨基酸残基侧链R R基相互作
21、用的基相互作用的影响很大。影响很大。这类结构经常构成这类结构经常构成酶活性部位酶活性部位和其它蛋白质和其它蛋白质特异的特异的功能部位功能部位。Random coil 许多蛋白质分子中可以有许多蛋白质分子中可以有二个或三个二个或三个具有二级结构具有二级结构的的肽段肽段,在空间位置上相互接近,形成特殊的空间结构,在空间位置上相互接近,形成特殊的空间结构,称其为称其为“模体模体”(motif)。模体是具有特殊功能的超二级结构模体是具有特殊功能的超二级结构钙结合蛋白中结合钙结合蛋白中结合钙离子的模体钙离子的模体-螺旋螺旋-转角(或环转角(或环)-螺旋模体螺旋模体链链-转角转角-链模体链模体链链-转角转
22、角-螺旋螺旋-转转角角-链模体链模体模体常见的形式模体常见的形式 锌指模体结构锌指模体结构锌指模体存在于类固醇激素受体超家族和一些转录因子中,属锌指模体存在于类固醇激素受体超家族和一些转录因子中,属DNADNA结合蛋白。锌指结合蛋白。锌指模体约由模体约由3030个氨基酸残基组成。个氨基酸残基组成。4 4个半胱氨酸残基或个半胱氨酸残基或2 2个半胱氨酸残基和个半胱氨酸残基和2 2个组氨酸个组氨酸残基与残基与1 1个锌离子配价结合。其中前一对半胱氨酸残基与后一对半胱氨酸(或组氨个锌离子配价结合。其中前一对半胱氨酸残基与后一对半胱氨酸(或组氨酸)残基之间相隔酸)残基之间相隔1212个氨基酸残基。锌指
23、模体的个氨基酸残基。锌指模体的-螺旋部分是与螺旋部分是与DNADNA结合的部位。结合的部位。三、蛋白质的三级结构三、蛋白质的三级结构(tertiary structure)(tertiary structure)蛋白质的三级结构是指多肽链在二级结构的基础上,由于氨基酸残基侧链R基的相互作用进一步盘曲或折迭而形成的特定构象。也就是整条多肽链中所有原子或基团整条多肽链中所有原子或基团在三维空间的排布位置。肌红蛋白肌红蛋白(myoglobin,Mb)一条长为一条长为153个氨基酸个氨基酸的多肽链和一个血红素的多肽链和一个血红素辅基组成。共有辅基组成。共有8段段-螺旋结构螺旋结构(A-H)功能功能:储
24、存储存O2 蛋白质三级结构的形成和稳定主要靠蛋白质三级结构的形成和稳定主要靠次级键次级键,包括,包括氢键、氢键、盐键、疏水键以及范德华力盐键、疏水键以及范德华力等。此外,等。此外,某些蛋白质中某些蛋白质中二硫键二硫键也也起着重要的作用。起着重要的作用。二硫键二硫键 结构域结构域(domain):大分子蛋白质三级结构常可分大分子蛋白质三级结构常可分割成一个或数个球状或纤维状的区域,各自折叠割成一个或数个球状或纤维状的区域,各自折叠得较为紧密,并且行使各自的功能。得较为紧密,并且行使各自的功能。分子伴侣分子伴侣分子伴侣分子伴侣(chaperon)可以帮助蛋白质正确折叠:可以帮助蛋白质正确折叠:通通
25、过提供一个保护环境从而加速蛋白质折叠成天然构象或过提供一个保护环境从而加速蛋白质折叠成天然构象或形成四级结构。形成四级结构。*帮助形成正确的高级结构帮助形成正确的高级结构 *使错误聚集的肽段解聚,再诱导其正确折叠。使错误聚集的肽段解聚,再诱导其正确折叠。*帮助形成二硫键帮助形成二硫键 热休克蛋白热休克蛋白Heat shock proteins,Heat shock proteins,HSPsHSPs 帮助新生蛋白质的正确折叠、装配、跨膜运输和转位,阻止蛋白质的变性和聚集;参与错误折叠的蛋白质的水解,抑制错误折叠的蛋白质的分泌。四、蛋白质的四级结构(四、蛋白质的四级结构(quaternary s
26、tructurequaternary structure)血红蛋白四级结构示意图血红蛋白四级结构示意图 主要稳定因素:主要稳定因素:氢键、离子键氢键、离子键 由两个或两个以上由两个或两个以上亚基亚基之间之间彼此以非共价键相互作用形成彼此以非共价键相互作用形成的更为复杂的空间构象,称为的更为复杂的空间构象,称为蛋白质的四级结构。蛋白质的四级结构。蛋白质的结构蛋白质的结构 按组成成分:单纯蛋白(仅含氨基酸)结合蛋白(单纯蛋白+辅基)按形状分:球蛋白 纤维蛋白五、蛋白质的分类五、蛋白质的分类第三节 蛋白质结构与功能的关系一、蛋白质的一级结构与功能的关系一、蛋白质的一级结构与功能的关系 1.1.蛋白质
27、一级结构是空间结构的基础蛋白质一级结构是空间结构的基础 蛋白质的一级结构决定蛋白质空间蛋白质的一级结构决定蛋白质空间结构,进而决定蛋白质的生物学功能。结构,进而决定蛋白质的生物学功能。Anfinsen经典实验经典实验核糖核酸酶核糖核酸酶2.2.相似的一级结构有相同或相似的生物学功能相似的一级结构有相同或相似的生物学功能镰刀状红细胞性贫血镰刀状红细胞性贫血:亚基亚基N N端的第端的第6 6位位氨基酸残基发生了改变,氨基酸残基发生了改变,GluVal,GluVal,这种这种变异来源于基因上遗传信息的突变。变异来源于基因上遗传信息的突变。正常正常 DNA TGT GGG CTT CTT TTT mR
28、NA ACA CCC GAA GAA AAA HbA N端端 Ser Pro Glu Glu Lys异常异常 DNA TGT GGG CAT CTT TTT mRNA ACA CCC GUA GAA AAA HbS N端端 Ser Pro Val Glu Lys 分子病:蛋分子病:蛋白质分子发白质分子发生变异所导生变异所导致的疾病致的疾病3.3.一级结构关键部位的改变影响其生物学活性一级结构关键部位的改变影响其生物学活性镰刀型红细胞镰刀型红细胞正常红细胞正常红细胞在氧张力低的毛细血管区,在氧张力低的毛细血管区,HbSHbS形成管状凝胶结构(如棒状结构),形成管状凝胶结构(如棒状结构),导致红细
29、胞扭曲成镰刀状。这种僵硬的镰状红细胞不能通过毛细血导致红细胞扭曲成镰刀状。这种僵硬的镰状红细胞不能通过毛细血管,加上管,加上HbSHbS的凝胶化使血液的黏滞度增大,阻塞毛细血管,引起局的凝胶化使血液的黏滞度增大,阻塞毛细血管,引起局部组织器官缺血缺氧,产生脾肿大、胸腹、肌肉疼痛等临床表现。部组织器官缺血缺氧,产生脾肿大、胸腹、肌肉疼痛等临床表现。肌红蛋白(肌红蛋白(myoglobin,Mb)单体,单体,153AA血红蛋白(血红蛋白(hemoglubin,Hb)四聚体,四聚体,22(22,22):141AA,(,):146AA二、蛋白质空间结构与功能的关系二、蛋白质空间结构与功能的关系 Mb与与
30、Hb氧合曲线的比较氧合曲线的比较氧饱和度氧饱和度=100%Mb与氧气有着高度亲和力,与氧气有着高度亲和力,其曲线为其曲线为双曲线双曲线。与与Mb相比,相比,Hb与氧气的亲和与氧气的亲和力较低。其曲线为力较低。其曲线为S形曲线形曲线,表,表明明Hb中各个亚基与氧气的亲和力中各个亚基与氧气的亲和力不一致。不一致。Hb中第一个亚基与氧中第一个亚基与氧气结合后,将促进后续亚基与氧气结合后,将促进后续亚基与氧气的结合。这是由气的结合。这是由Hb的的变构效应变构效应导致的。其作用在于导致的。其作用在于使使Hb能够更能够更有效地运输氧气有效地运输氧气。MbO2MbO2+Mb1 mmHgHb的变构效应的变构效
31、应也称也称别构效应别构效应 一个亚基与配体结合后,一个亚基与配体结合后,影响另一亚基与配体的影响另一亚基与配体的结合能力。结合能力。促进促进正协同效应正协同效应抑制抑制负协同效应负协同效应协同效应协同效应蛋白质折叠病蛋白质折叠病疯牛病疯牛病是由是由朊病毒蛋白朊病毒蛋白(prion protein,PrP)引起的具有传染性、引起的具有传染性、遗传性的神经退行性病变。遗传性的神经退行性病变。PrP是由染色体基因编码的分子量为是由染色体基因编码的分子量为33-35kD的蛋白质。动物和人的正常的蛋白质。动物和人的正常PrP水溶性强、对蛋白酶敏水溶性强、对蛋白酶敏感,含有多个感,含有多个-螺旋螺旋,称为
32、,称为PrPC。PrPC通过某种机制可转变成通过某种机制可转变成全为全为-折叠折叠的的PrP(称为称为PrPSC)。PrPSC水溶性差、对蛋白酶耐受、水溶性差、对蛋白酶耐受、热稳定、而且可以传染给其他个体,并致使其他个体中正常的热稳定、而且可以传染给其他个体,并致使其他个体中正常的PrPC通过某种机制重新折叠成通过某种机制重新折叠成PrPSC。最后。最后PrPSC可以相互聚集,可以相互聚集,形成淀粉样沉淀而致病。形成淀粉样沉淀而致病。蛋白质是由蛋白质是由氨基酸氨基酸组成的大分子化合物,其理组成的大分子化合物,其理化性质化性质一、蛋白质的理化性质一、蛋白质的理化性质 第四节 蛋白质的理化性质及其
33、分离纯化一部分与氨基酸相似,一部分与氨基酸相似,如两性电离及等电点、如两性电离及等电点、紫外吸收、呈色反应等。紫外吸收、呈色反应等。也有一部分又不也有一部分又不同于氨基酸,如同于氨基酸,如高分子量、胶体高分子量、胶体性质、沉淀、变性质、沉淀、变性和凝固等。性和凝固等。蛋白质的两性电离及等电点蛋白质的两性电离及等电点蛋白质的蛋白质的等电点(等电点(pI)在某一溶液中,蛋白质所带正负电荷在某一溶液中,蛋白质所带正负电荷相等,净电荷为零时,此时该溶液的相等,净电荷为零时,此时该溶液的pH值即为该蛋白质的值即为该蛋白质的等电点等电点(isoelectric point,pI)。蛋白质的吸收光谱及几种呈
34、色反应蛋白质的吸收光谱及几种呈色反应1.蛋白质的特征紫外吸收光波长蛋白质的特征紫外吸收光波长280nm (Trp、Tyr的贡献)的贡献)2.呈色反应呈色反应常可用于蛋白质定量常可用于蛋白质定量双缩脲反应双缩脲反应(Biuret Reaction)(Biuret Reaction)两个或两个以上的肽键两个或两个以上的肽键在碱性条件下与在碱性条件下与CuCu2+2+反应生成反应生成紫红色紫红色物质物质Folin-Folin-酚试剂反应酚试剂反应蛋白质分子中的蛋白质分子中的Tyr在碱性条件下与酚试剂生成在碱性条件下与酚试剂生成蓝色蓝色化合物化合物茚三酮反应茚三酮反应蛋白质分子中的蛋白质分子中的游离氨
35、基和羧基游离氨基和羧基与茚三酮加热生成与茚三酮加热生成蓝紫色蓝紫色化合物化合物蛋白质的胶体性质蛋白质的胶体性质 蛋白质分子量颇大,可自一蛋白质分子量颇大,可自一万至百万之巨,故其分子的大万至百万之巨,故其分子的大小已达到胶粒小已达到胶粒1 1100nm100nm范围之范围之内。因此蛋白质溶液具有内。因此蛋白质溶液具有胶体胶体溶液溶液的性质。的性质。稳定该亲水胶体的因素是稳定该亲水胶体的因素是:水化膜、颗粒表面电荷。水化膜、颗粒表面电荷。+带正电荷的蛋白质带正电荷的蛋白质带负电荷的蛋白质带负电荷的蛋白质在等电点的蛋白质在等电点的蛋白质水化膜水化膜+带正电荷的蛋白质带正电荷的蛋白质带负电荷的蛋白质
36、带负电荷的蛋白质不稳定的蛋白质颗粒不稳定的蛋白质颗粒酸酸碱碱酸酸碱碱酸酸碱碱脱水作用脱水作用脱水作用脱水作用脱水作用脱水作用溶液中蛋白质的聚沉溶液中蛋白质的聚沉 天然蛋白质在天然蛋白质在某些物理或化学因素某些物理或化学因素作用下,其特定的作用下,其特定的空空间结构间结构被破坏,从而导致理化性质改变和生物学活性的丧失,被破坏,从而导致理化性质改变和生物学活性的丧失,称为蛋白质的称为蛋白质的变性作用变性作用(denaturation)(denaturation)。变性主要是。变性主要是二硫键及二硫键及非共价键非共价键的断裂,并不涉及一级结构氨基酸序列的改变。的断裂,并不涉及一级结构氨基酸序列的改变
37、。蛋白质的变性蛋白质的变性-吴宪最早提出吴宪最早提出 变性因素:加热、有机溶剂、强酸、强碱、重金属等变性因素:加热、有机溶剂、强酸、强碱、重金属等蛋白质的沉淀蛋白质的沉淀 蛋白质变性后,蛋白质变性后,疏水基团疏水基团暴露,相互之间容易聚集而发生沉暴露,相互之间容易聚集而发生沉淀。淀。值得注意的是,有时蛋白质发生沉淀,但并不变性。值得注意的是,有时蛋白质发生沉淀,但并不变性。蛋白质变性的应用:蛋白质变性的应用:利用:高温、高压灭菌利用:高温、高压灭菌利用:低温保存酶、疫苗等,防止蛋白质变性。利用:低温保存酶、疫苗等,防止蛋白质变性。变性并非是不可逆的变化,当变性程度较轻时,如去除变性并非是不可逆
38、的变化,当变性程度较轻时,如去除变性因素,有的蛋白质仍能恢复或部分恢复其原来的构象及变性因素,有的蛋白质仍能恢复或部分恢复其原来的构象及功能,变性的可逆变化称为功能,变性的可逆变化称为复性复性(renaturationrenaturation)。)。分离与纯化就是利用蛋白质的分离与纯化就是利用蛋白质的理化性质和特点!理化性质和特点!蛋白质的分离和纯化蛋白质的分离和纯化盐析(盐析(salt precipitation):中性盐):中性盐(硫酸铵等),分段盐析(硫酸铵等),分段盐析有机试剂沉淀:乙醇、丙酮,低温有机试剂沉淀:乙醇、丙酮,低温 免疫沉淀:抗原免疫沉淀:抗原-抗体抗体 透析透析(dia
39、lysis):):半透膜半透膜层析层析(chromatography):):离子交换层析、亲和层离子交换层析、亲和层析、凝胶柱层析析、凝胶柱层析离心、超速离心离心、超速离心(ultracentrifugation):沉降系数:沉降系数S电泳电泳(electrophoresis):pI分子量的大小分子量的大小一、透析和超滤法可去除蛋白质一、透析和超滤法可去除蛋白质溶液中的小分子化合物溶液中的小分子化合物应用正压或离心力使蛋白质溶液透过有一应用正压或离心力使蛋白质溶液透过有一定截留分子量的超滤膜,达到浓缩蛋白质溶液定截留分子量的超滤膜,达到浓缩蛋白质溶液的目的。的目的。透析透析(dialysis)
40、超滤法超滤法利用透析袋把大分子蛋白质与小分子化合利用透析袋把大分子蛋白质与小分子化合物分开的方法物分开的方法。透析透析(dialysis):磁力搅拌器磁力搅拌器透析前透析前透析后透析后透析袋透析袋通过透析,小分子通透透析袋,散布于透析液中,通过透析,小分子通透透析袋,散布于透析液中,大分子量的蛋白质不能通透透析袋,留在透析袋内。大分子量的蛋白质不能通透透析袋,留在透析袋内。从而,蛋白质溶液中的小分子物质通过透析被分离除从而,蛋白质溶液中的小分子物质通过透析被分离除去。去。在在一定的压力下一定的压力下,使蛋白质溶液在通过一定孔径的超滤,使蛋白质溶液在通过一定孔径的超滤膜时,小分子量物质滤过,而大
41、分子量的蛋白质被截留,膜时,小分子量物质滤过,而大分子量的蛋白质被截留,从而达到分离纯化的目的。这种方法既可以纯化蛋白质,从而达到分离纯化的目的。这种方法既可以纯化蛋白质,又可达到浓缩蛋白质溶液的目的。又可达到浓缩蛋白质溶液的目的。磁力搅拌器磁力搅拌器待超滤的蛋白质溶液待超滤的蛋白质溶液加压的氮气加压的氮气超滤膜超滤膜超滤(超滤(ultrafiltration):二、丙酮沉淀、盐析及免疫沉淀是常用二、丙酮沉淀、盐析及免疫沉淀是常用的蛋白质沉淀方法的蛋白质沉淀方法使用使用丙酮沉淀丙酮沉淀时,必须在时,必须在04低温下进行,低温下进行,丙酮用量一般丙酮用量一般10倍于蛋白质溶液体积。蛋白质倍于蛋白
42、质溶液体积。蛋白质被丙酮沉淀后,应立即分离。除了丙酮以外,被丙酮沉淀后,应立即分离。除了丙酮以外,也可用乙醇沉淀。也可用乙醇沉淀。盐析盐析(salt precipitation)是将硫酸铵、硫酸钠或是将硫酸铵、硫酸钠或氯化钠等加入蛋白质溶液,使蛋白质表面电荷氯化钠等加入蛋白质溶液,使蛋白质表面电荷被中和以及水化膜被破坏,导致蛋白质沉淀。被中和以及水化膜被破坏,导致蛋白质沉淀。免疫沉淀法:免疫沉淀法:将某一纯化蛋白质免疫动物将某一纯化蛋白质免疫动物可获得抗该蛋白的特异抗体。利用特异抗可获得抗该蛋白的特异抗体。利用特异抗体识别相应的抗原蛋白,并形成抗原抗体体识别相应的抗原蛋白,并形成抗原抗体复合物
43、的性质,可从蛋白质混合溶液中分复合物的性质,可从蛋白质混合溶液中分离获得抗原蛋白。离获得抗原蛋白。三、利用荷电性质可用电泳法将三、利用荷电性质可用电泳法将蛋白质分离蛋白质分离蛋白质在高于或低于其蛋白质在高于或低于其pI的溶液中为带电的的溶液中为带电的颗粒,在电场中能向正极或负极移动。这种通过颗粒,在电场中能向正极或负极移动。这种通过蛋白质在电场中泳动而达到分离各种蛋白质的技蛋白质在电场中泳动而达到分离各种蛋白质的技术术,称为称为电泳电泳(elctrophoresis)。根据支撑物的不同,可分为薄膜电泳、凝胶根据支撑物的不同,可分为薄膜电泳、凝胶电泳等。电泳等。SDS-聚丙烯酰胺凝胶电泳,常用于
44、蛋白聚丙烯酰胺凝胶电泳,常用于蛋白质分子量的测定。质分子量的测定。原点带负电荷蛋白质的泳动方向滤纸、醋酸纤维素薄膜或其他支持物阳极阴极电极缓冲液电极缓冲液电泳示意图 等电聚焦电泳等电聚焦电泳通过蛋白质等电点的差异而分离蛋白质的电泳方法通过蛋白质等电点的差异而分离蛋白质的电泳方法四、应用相分配或亲和原理可将蛋白质四、应用相分配或亲和原理可将蛋白质进行层析分离进行层析分离待分离蛋白质溶液(流动相)经过一个固待分离蛋白质溶液(流动相)经过一个固态物质(固定相)时,根据溶液中待分离的蛋态物质(固定相)时,根据溶液中待分离的蛋白质颗粒大小、电荷多少及亲和力等,使待分白质颗粒大小、电荷多少及亲和力等,使待
45、分离的蛋白质组分在两相中反复分配,并以不同离的蛋白质组分在两相中反复分配,并以不同速度流经固定相而达到分离蛋白质的目的。速度流经固定相而达到分离蛋白质的目的。层析层析(chromatography)分离蛋白质的原理分离蛋白质的原理离子交换层析:利用各蛋白质的电荷离子交换层析:利用各蛋白质的电荷量及性质不同进行分离。量及性质不同进行分离。凝胶过滤凝胶过滤(gel filtration)又称分子筛层又称分子筛层析,利用各蛋白质分子大小不同分离。析,利用各蛋白质分子大小不同分离。蛋白质分离常用的层析方法蛋白质分离常用的层析方法洗脱洗脱洗脱样品凝胶颗粒大分子先洗脱下来小分子后洗脱下来五、利用蛋白质颗粒
46、沉降行为不同五、利用蛋白质颗粒沉降行为不同可进行超速离心分离可进行超速离心分离超速离心法超速离心法(ultracentrifugation)既既可以用来分离纯化蛋白质也可以用可以用来分离纯化蛋白质也可以用作测定蛋白质的分子量。作测定蛋白质的分子量。蛋白质在离心场中的行为用沉降系数蛋白质在离心场中的行为用沉降系数(sedimentation coefficient,S)表示,沉降表示,沉降系数与蛋白质的密度和形状相关系数与蛋白质的密度和形状相关。因为沉降系数因为沉降系数S S大体上和分子量成正比关系,故大体上和分子量成正比关系,故可应用超速离心法测定蛋白质分子量,但对分子形状可应用超速离心法测定
47、蛋白质分子量,但对分子形状的高度不对称的大多数纤维状蛋白质不适用。的高度不对称的大多数纤维状蛋白质不适用。思考题思考题:1.1.蛋白质的元素组成、基本组成单位,蛋白质的元素组成、基本组成单位,氨基酸成肽的连接方式;熟悉氨基酸的通式与结构特点;氨基酸成肽的连接方式;熟悉氨基酸的通式与结构特点;2.2.蛋白质蛋白质1-41-4级结构的定义及维系这些结构稳定的作用键级结构的定义及维系这些结构稳定的作用键3.3.蛋白质二级结构的基本形式?蛋白质二级结构的基本形式?4.4.举例说明蛋白质一级结构与功能的关系。举例说明蛋白质一级结构与功能的关系。5.5.什么是蛋白质的变性?哪些因素可引起蛋白质的变性?什么是蛋白质的变性?哪些因素可引起蛋白质的变性?变性蛋白质的性质发生了哪些变化?变性蛋白质的性质发生了哪些变化?
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
