 原电池的电动势与电极电位势解读课件
原电池的电动势与电极电位势解读课件


《原电池的电动势与电极电位势解读课件》由会员分享,可在线阅读,更多相关《原电池的电动势与电极电位势解读课件(31页珍藏版)》请在装配图网上搜索。
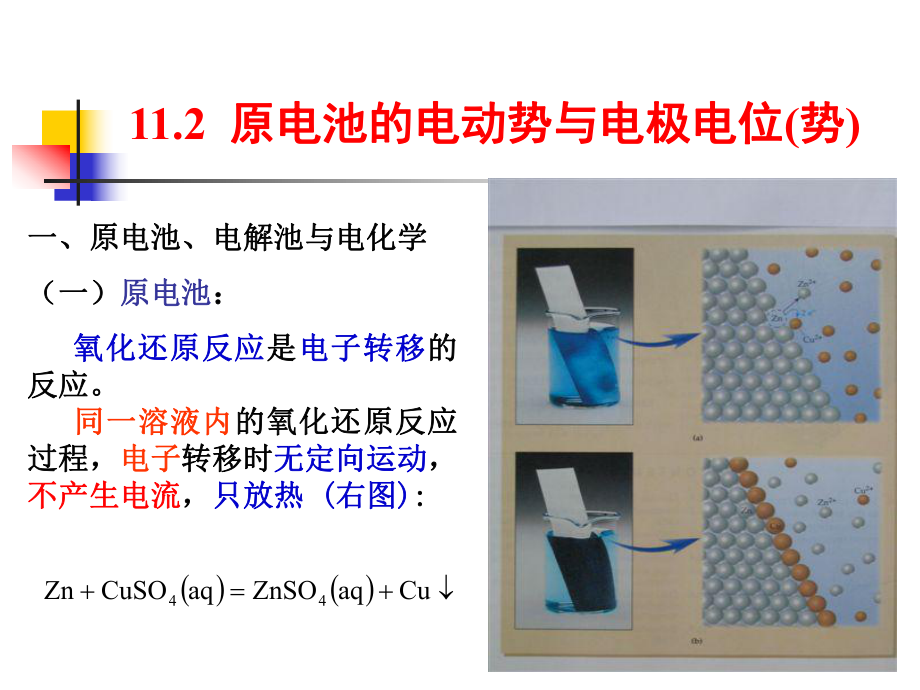
1、11.2 原电池的电动势与电极电位原电池的电动势与电极电位(势势)一、原电池、电解池与电化学一、原电池、电解池与电化学(一)(一)原电池原电池:氧化还原反应氧化还原反应是是电子转移电子转移的的反应。反应。同一溶液内同一溶液内的氧化还原反应的氧化还原反应过程,过程,电子电子转移时转移时无定向运动无定向运动,不产生电流不产生电流,只放热只放热 (右图右图):CuaqZnSOaqCuSOZn44(一)(一)原电池原电池(续)(续)n若若选择适当的电极选择适当的电极,组装为组装为“原电池原电池”,使转移的使转移的电子定向运电子定向运动动产生电流产生电流。n原电池原电池:是是化学能化学能电能电能的装的装
2、置。置。n右图:右图:Daniell电池电池(锌锌-铜原电池铜原电池)锌锌-铜电池(铜电池(Daniell Cell电池电池)(盐桥盐桥:KCl(或(或Na2SO4)等)等+琼胶,琼胶,维持电路畅通维持电路畅通)电极反应:电极反应:Zn极(负极极(负极,Cathode):Cu极(正极极(正极,Anode):e2ZnsZn2 sCue2aqCu2原电池放电总反应:原电池放电总反应:Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)盐桥盐桥(饱和饱和KCl(aq)(或(或Na2SO4)+琼脂琼脂)的作用的作用 作为作为正、负离子通道正、负离子通道,使,使两个两个“半电池半电池”的的溶液都溶
3、液都保持电中性,维持电路畅通。保持电中性,维持电路畅通。Cl-,SO42-ZnSO4(aq)K+,Zn2+CuSO4(aq)KCl 也可以用也可以用Na2SO4等等其它电解质其它电解质代替。代替。总结总结“原电池原电池”放电反应放电反应:负极负极(Cathode):电势低电势低,电子流出电子流出,发生,发生氧化氧化反应反应;正极正极(Anode):电势高电势高,电子流入电子流入,发生,发生还原还原反应。反应。原电池符号原电池符号 锌锌-铜电池(铜电池(Daniell Cell电池)电池)(-)Zn(s)|ZnSO4(1 mol/dm3)|CuSO4(1 mol/dm3)|Cu(s)(+)相界相
4、界 浓度或活度浓度或活度 盐桥盐桥可可简化简化为(为(不严格不严格):(-)Zn(s)|ZnSO4|CuSO4|Cu(s)(+)n放电总反应放电总反应:Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)n给出给出总反应总反应方程式,要能够方程式,要能够设计设计为为原电池原电池,写出,写出电池符号电池符号和半反应和半反应(电极反应电极反应)方程式。方程式。例例2.原电池原电池 氢铁电池氢铁电池n()(Pt),H2(1 p )H+(1 moldm-3)Fe3+(1 moldm-3),Fe2+(1 moldm-3)Pt(+)n负极负极:氧化氧化半反应半反应 H2=2H+2e n正极正极:还原
5、还原半反应半反应 Fe3+e =Fe2+n放电放电总反应总反应:H2+2 Fe3+=2 H+2 Fe2+给出给出电池符号电池符号,要能够写出,要能够写出半反应半反应 (电极反应电极反应)和和放电放电总反应方程式总反应方程式。例例3.原电池原电池 锌锰干电池锌锰干电池结构结构nNH4Cl,ZnCl2和和MnO2 浆状物浆状物 n正极:石墨正极:石墨(带铜帽)(带铜帽)n负极:锌(外壳)负极:锌(外壳)例例3.原电池原电池 锌锰锌锰干电池干电池放电反应放电反应n负极负极(氧化氧化反应):反应):Zn(s)Zn2+(aq)+2en正极正极(还原还原反应):反应):MnO2(s)+H+(aq)+e M
6、nO(OH)(s)2 MnO(OH)(s)Mn2O3(s)+H2O(l)合并,得合并,得总的总的放电反应:放电反应:Zn(s)+2 MnO2(s)+2 H+(aq)Zn2+(aq)+Mn2O3(s)+H2O(l)例例4.氢氧燃料电池氢氧燃料电池将燃烧过程中放出的化学能转化为电能将燃烧过程中放出的化学能转化为电能的装置叫的装置叫燃料电池燃料电池。例氢燃料电池:基本反应:例氢燃料电池:基本反应:H2(g)+1/2O2(g)H2O(l)H=-286KJmol-1 用多孔膜将电池分为三部:中间装75%KOH,左侧通H2,右侧通O2,扩散到KOH溶液中发生反应:(+)极:1/2O2(g)+H2O(l)+
7、2e-=2OH-(-)极:H2(g)+2OH-=2 H2O(l)+2e-总反应:总反应:H2(g)+1/2O2(g)=H2O(l)优点:不经过热能的中间形式,直优点:不经过热能的中间形式,直接将化学能接将化学能电能,利用率高,减电能,利用率高,减少环境污染。少环境污染。早在早在1839年年,英国人,英国人W.Grove就提出了氢和就提出了氢和氧反应可以发电的原理,这就是最早的氢氧反应可以发电的原理,这就是最早的氢-氧氧燃料电池燃料电池(FC)。但直到。但直到20世纪世纪60年代初,年代初,由由于航天和国防的需要,才开发了液氢和液氧于航天和国防的需要,才开发了液氢和液氧的小型燃料电池,应用于空间
8、飞行和潜水艇。的小型燃料电池,应用于空间飞行和潜水艇。近二三十年来,近二三十年来,由于由于一次能源的匮乏和环境一次能源的匮乏和环境保护的突出保护的突出,要求开发利用新的清洁再生能,要求开发利用新的清洁再生能源。源。燃料电池由于具有能量转换效率高、对燃料电池由于具有能量转换效率高、对环境污染小等优点而受到世界各国的普遍重环境污染小等优点而受到世界各国的普遍重视。视。美国矿物能源部长美国矿物能源部长助理克助理克.西格尔说:西格尔说:“燃料电池燃料电池技术在技术在21世纪上半叶在技术上的冲击影响,会类世纪上半叶在技术上的冲击影响,会类似于似于20世纪上半叶内燃机所起的作用。世纪上半叶内燃机所起的作用
9、。”福特汽福特汽车公司主管车公司主管PNGV经理鲍伯经理鲍伯.默尔称,燃料电池必默尔称,燃料电池必会给汽车动力带来一场革命,燃料电池是唯一同会给汽车动力带来一场革命,燃料电池是唯一同时兼备无污染、高效率、适用广、无噪声和具有时兼备无污染、高效率、适用广、无噪声和具有连续工作和积木化的动力装置。连续工作和积木化的动力装置。预期燃料电池会预期燃料电池会在国防和民用的电力、汽车、通信等多领域发挥在国防和民用的电力、汽车、通信等多领域发挥重要作用。重要作用。美国美国Arthur D.Little公司最新估计,公司最新估计,2000年燃料电池在能源系统市场将提供年燃料电池在能源系统市场将提供1 5002
10、 000MW动力,价值超过动力,价值超过30亿美元,车辆市场将超亿美元,车辆市场将超过过20亿美元;亿美元;2007年燃料电池在运输方面的商业年燃料电池在运输方面的商业价值将达到价值将达到90亿美元。亿美元。2002.12月月2日,日本首日,日本首相小泉纯一相小泉纯一郎在东京首郎在东京首相官邸前乘相官邸前乘坐本田公司坐本田公司的的FCX型燃型燃料电池动力料电池动力汽车时向人汽车时向人们挥手。们挥手。在在2003年的早些时候,东芝已经发布了世年的早些时候,东芝已经发布了世界上第一块笔记本电脑燃料电池及燃料管。这界上第一块笔记本电脑燃料电池及燃料管。这种燃料电池的横截面为种燃料电池的横截面为275
11、75毫米,重毫米,重900克。而仅重克。而仅重72克的燃料管可以容纳克的燃料管可以容纳50立方厘米立方厘米高浓度甲醇。如果用这个电池系统为普通的高浓度甲醇。如果用这个电池系统为普通的PDA供电,那么一枚燃料管中盛载的溶液可以供电,那么一枚燃料管中盛载的溶液可以坚持发电坚持发电20小时。除此之外,日本移动电话运小时。除此之外,日本移动电话运营巨头营巨头NTT DoCoMo在在2003年年6月月5日宣布,日宣布,其将会在最近两年内推出一种使用燃料电池的其将会在最近两年内推出一种使用燃料电池的手机,并且预言手机,并且预言“如果一切顺利,如果一切顺利,2004年就将年就将上市第一款燃料电池手机上市第一
12、款燃料电池手机”。笔记本燃料电池笔记本燃料电池最新一代燃料电池最新一代燃料电池日本移动运营商NTT DoCoMo宣布,该公司研发出了一种使用微型燃料电池供电的3G手机充电器原型。这种燃料电池通过合成氢和无害的甲醇来产生化学反应,以此为手机充电提供充足的能量。这款微型燃料电池重190克,可以产生近3.8瓦特的能量。别看它个头这么小,可却有惊人的耐力,在普通室温的条件下它的供电时间大大超出锂电池的寿命。不过燃料电池也有其自身的不足,它的每一个电池(一个甲醇燃料管)只能提供一次性的供电。也就是说我们不能为燃料电池进行像锂电、镍氢电池一样的充电操作。因此,当我们出远门时就得随身带着多个燃料电池了。左起
13、依次为耳机、燃料电池左起依次为耳机、燃料电池诺基亚试产百部燃料电池耳机诺基亚试产百部燃料电池耳机 锂电池锂电池n2005年年12月月,日本生产出锂电池驱动汽车日本生产出锂电池驱动汽车,最高时速超过最高时速超过300 km/h.手机手机.例例5.锌汞纽扣电池锌汞纽扣电池放电反应放电反应(作原电池):(作原电池):负极负极:(氧化反应氧化反应)Zn(s)+2 OH-(aq)ZnO(s)+H2O(l)+2 e正极正极:(还原反应还原反应)HgO(s)+H2O(l)+2 e Hg(l)+2 OH-(aq)放电总反应:放电总反应:Zn(s)+HgO(s)ZnO(s)+Hg(l)(二)(二)电解池电解池
14、是是使用使用直流电直流电促使促使非自发非自发的氧化还原反应的氧化还原反应 发生发生的的装置装置,即,即电能电能化学能化学能的的装置装置。例例1 NaCl水溶液水溶液电解池电解池 阳阳极:极:Cl-(aq)Cl2(g)+2 e (氧化氧化反应)反应)阴阴极:极:2 H+(aq)+2 e H2(g)(还原还原反应)反应)例例2 融熔融熔NaCl电解池(电解池(左左)和实验装置()和实验装置(右右)阳阳极极:2 Cl-(l)Cl2(g)+2 e (氧化氧化反应反应)阴阴极极:2 Na+(l)+2 e 2 Na(l)(还原还原反应反应)例例3.铅蓄电池铅蓄电池n放电反应放电反应(作原电池):(作原电池
15、):负极:负极:Pb(s)+HSO4-(aq)PbSO4(s)+H+(aq)+2e正极:正极:PbO2(s)+HSO4-(aq)+3 H+(aq)+2e PbSO4(s)+2 H2O(l)放电总反应:放电总反应:Pb(s)+PbO2(s)+2 HSO4-(aq)+2 H+(aq)2 PbSO4(s)+2 H2O(l)充电总反应(作电解池)充电总反应(作电解池):2 PbSO4(s)+2 H2O(l)Pb(s)+PbO2(s)+2 HSO4-(aq)+2 H+(aq)例例4.镍镉碱性充电电池镍镉碱性充电电池放电反应放电反应(作原电池):(作原电池):负极负极:(氧化反应氧化反应)Cd(s)+2
16、OH-(aq)Cd(OH)2(s)+2 e正极正极:(还原反应还原反应)NiO(OH)(s)+H2O(l)+e Ni(OH)2(s)+OH-(aq)放电放电总反应:总反应:Cd(s)+2 NiO(OH)(s)+2 H2O(l)Cd(OH)2(s)+2 Ni(OH)2(s)充电充电总反应(作电解池)总反应(作电解池):Cd(OH)2(s)+2 Ni(OH)2(s)Cd(s)+2 NiO(OH)(s)+2 H2O(l)(二)(二)电解池电解池 (续续)例例5:电解精炼铜:电解精炼铜.电解池电解池:阳极阳极(Anode)与与原电池正极原电池正极连接,总是发生连接,总是发生氧化氧化反应反应:Cu(s)
17、=Cu2+(aq)+2e (阳极阳极为粗铜为粗铜)阴极阴极(Cathode)与与原电池负极原电池负极连接,总是发生连接,总是发生还原还原反应反应:Cu2+(aq)+2e=Cu(s)(阴极阴极为精铜为精铜)电解的应用电解的应用:电镀电镀n电镀银电镀银n阳极阳极Ag(s)(接原电池接原电池+极极)Ag Ag+e (氧化反应氧化反应)n阴极阴极(镀件镀件)(接原电池接原电池-极极)Ag+e Ag (还原反应还原反应)电解的应用电解的应用:电镀电镀(续续)n阴极阴极(汽车车体镀件汽车车体镀件)(接原电池接原电池-极极)(三)(三)电化学电化学 (Electrochemistry)研究研究化学电池化学电
18、池中中氧化还原反应氧化还原反应过程过程以及以及化学化学能能与与电能电能互相转变规律互相转变规律的化学的化学分支,称为分支,称为“电化学电化学”。化学电池化学电池:(1)原电池原电池(化学能化学能电能电能)(2)电解池电解池(电能电能化学能化学能)原电池(上)原电池(上)和和电解池(下)电解池(下)的电极反应的电极反应n原电池原电池放电反应放电反应:负极负极(Cathode):电势低,电子流电势低,电子流出出,发生,发生氧化氧化反应反应;正极正极(Anode):电势高,电子流入电势高,电子流入,发生发生还原还原反应。反应。n电解池电解池电解电解反应反应:阳极阳极(Anode):连接连接原电池正极
19、原电池正极,发生发生氧化氧化反应反应;阴极阴极(Cathode):连接连接原电池原电池负极负极,发生发生还原还原反应反应;二、二、原电池原电池的的电动势电动势与与电极电位(势)电极电位(势)(一)原电池的电动势(一)原电池的电动势 (或或E)指原电池指原电池正、负电极正、负电极之间的之间的平衡电势差平衡电势差。=+-(10.1.1)=+-(10.1.2)可用可用电位差计电位差计或或高阻抗晶体管伏特计高阻抗晶体管伏特计直接直接测量测量.例:上述例:上述Daniell cell,测出电动势测出电动势 =+1.10 V 表示表示Cu电极电势比电极电势比Zn电极高电极高1.10 V 电极电位的产生电极
20、电位的产生“双电层模型双电层模型”Zn(s)-ZnSO4(aq)双电层形成双电层形成电极电位的产生电极电位的产生“双电层模型双电层模型”把金属晶体插入它的盐溶液中:把金属晶体插入它的盐溶液中:M(s)Mn+(aq)+n e (e 留在留在M(s)表面)表面)金属金属“溶解溶解”Mn+(aq)沉积沉积“双电层模型双电层模型”在在一定温度一定温度下达到下达到“平衡平衡”,有两种可能,有两种可能:1.M活泼性活泼性,或,或/和和Mn+(aq)浓度小,浓度小,占优,生成占优,生成左边左边的的“双电层双电层”。2.M活泼性活泼性,或,或/和和Mn+(aq)浓度大,浓度大,占优,生成占优,生成右边右边的的
21、“双电层双电层”。Zn/Zn2+Cu/Cu2+n+-n+-n+-n+-n+-+电极电位的产生电极电位的产生(续续)例:例:Zn(s)=Zn2+(aq)+2 e 金属金属“溶解溶解”占优势占优势 Cu(s)=Cu2+(aq)+2 e Mn+(aq)沉积沉积占优势占优势 电极电位(势),电极电位(势),金属与其盐溶液之间产生的金属与其盐溶液之间产生的这种这种电势差电势差,称为,称为“电极电位电极电位”(势)。(势)。符号符号:.SI单位单位:V.由于由于 (Zn2+/Zn)(Cu2+/Cu),当,当 以以盐桥盐桥连接这连接这两个溶液且外电路接通(构成回路)时,就有两个溶液且外电路接通(构成回路)时,就有电子从电子从Zn电极流出电极流出,经,经外电路外电路流入流入Cu电极电极,产生电流。,产生电流。
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
