 物理化学1章热力学基本定律与函数课件
物理化学1章热力学基本定律与函数课件


《物理化学1章热力学基本定律与函数课件》由会员分享,可在线阅读,更多相关《物理化学1章热力学基本定律与函数课件(62页珍藏版)》请在装配图网上搜索。
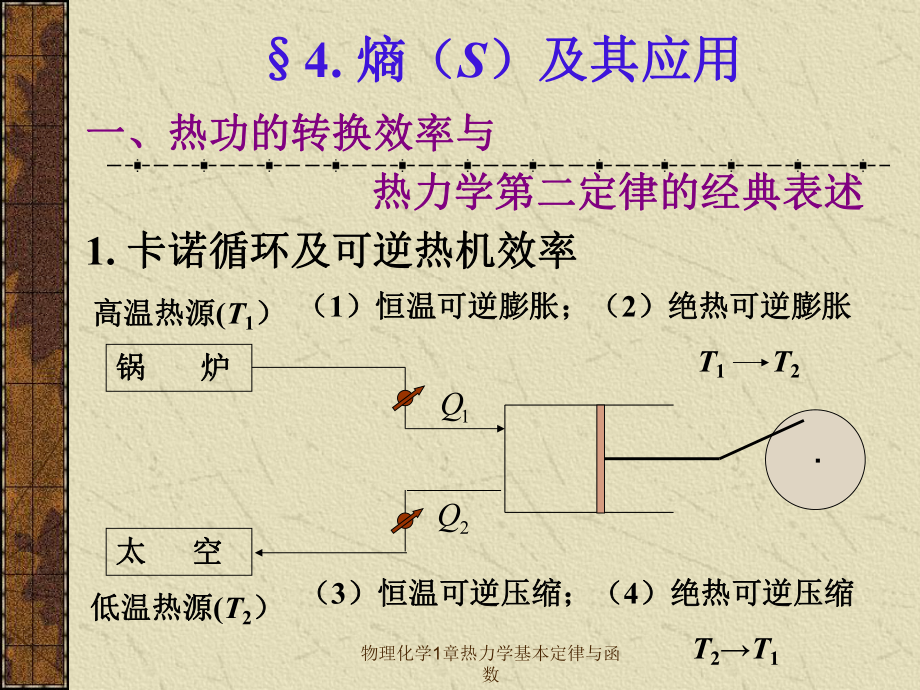
1、物理化学1章热力学基本定律与函数4.熵(熵(S)及其应用)及其应用一、热功的转换效率与一、热功的转换效率与 热力学第二定律的经典表述热力学第二定律的经典表述1.卡诺循环及可逆热机效率卡诺循环及可逆热机效率高温热源高温热源(T1)锅锅 炉炉太太 空空低温热源低温热源(T2)(1)恒温可逆膨胀;()恒温可逆膨胀;(2)绝热可逆膨胀)绝热可逆膨胀 T1 T2(3)恒温可逆压缩;()恒温可逆压缩;(4)绝热可逆压缩)绝热可逆压缩 T2T11Q2Q物理化学1章热力学基本定律与函数VpABCDCBC01Q)(12m,11TTCUWV D02 UDCVVRTWQln122 1211 CBVTVTDA02 Q
2、)(21m,22TTCUWV 1211 DAVTVTBACDVVVV AB01 UBAVVRTWQln111 物理化学1章热力学基本定律与函数WVVTTRQQQQQQQBA ln)(21212121(1)T2不为绝对零度时,不为绝对零度时,(2)热功转换具有不可逆性。)热功转换具有不可逆性。功可功可100%转换成热,热不可能转换成热,热不可能100%转换成功转换成功r 1。(3)02211 TQTQ1211QQQQW 热机效率:热机效率:可逆可逆热机热机121TTT 物理化学1章热力学基本定律与函数2.热力学第二定律的经典表述热力学第二定律的经典表述(见教材见教材 P208)实质:自动过程都是
3、不可逆的。实质:自动过程都是不可逆的。3.卡诺原理卡诺原理 在两个热源之间工作的热机中,可逆热在两个热源之间工作的热机中,可逆热 机效率最大。即:机效率最大。即:r在两个热源之间工作的一切可逆热机效率在两个热源之间工作的一切可逆热机效率 相等。相等。r=r 在两个热源之间工作的可逆热机效率大于在两个热源之间工作的可逆热机效率大于 一切不可逆热机效率。一切不可逆热机效率。r ir 2211TQTQ 则:则:0物理化学1章热力学基本定律与函数二、任意可逆循环过程的热温商与熵函数二、任意可逆循环过程的热温商与熵函数 热温商:热温商:Q/T02211 TQTQ对卡诺循环有:对卡诺循环有:设任意可逆循环
4、:设任意可逆循环:A B A011 iiiiTQTQ每个小卡诺循环:每个小卡诺循环:整个循环过程:整个循环过程:0)(r1 iiiTQ0)(r iiTQ或或0)()()()()()r()r()r()r(r BABAABBATQTQTQTQTQVpAB物理化学1章热力学基本定律与函数)r()r()()(BABATQTQ即:即:令:令:TQSrd 则:则:SSSSTQTQABBABABA d)()()r()r(S:熵,熵变形式定义熵,熵变形式定义 熵是状态函数,体系的容量性质;熵是状态函数,体系的容量性质;经可逆过程,熵变量经可逆过程,熵变量 ;,而,而TQSrd STQdr VpWd 物理化学1
5、章热力学基本定律与函数三、熵增原则三、熵增原则1.任意不可逆过程的热温商与熵变的关系任意不可逆过程的热温商与熵变的关系VpABrir设可逆设可逆(r)与不可逆与不可逆(ir)两条途径两条途径由第一定律得:由第一定律得:iririrrrrd,dWQUWQU ,ddirrUU 而而irrWW TQTQQQirrirr 不可逆循环有:不可逆循环有:0 TQTQSrd 又又,故,故TQSird 物理化学1章热力学基本定律与函数2.克劳修斯(克劳修斯(Clausius)不等式)不等式TQSrd 因为有因为有 和和,故:,故:TQSird SdTQirrClausius不等式,第二定律的数学表达式,不等式
6、,第二定律的数学表达式,T 热源(环境)温度。热源(环境)温度。3.自动过程的共同特征自动过程的共同特征自动过程:在指定条件下,不需要消耗外力自动过程:在指定条件下,不需要消耗外力(热热or功功)而自行发生、进行的过程。而自行发生、进行的过程。物理化学1章热力学基本定律与函数实例实例 方向方向 推动力推动力 限度限度 判据判据传热传热 T高高 T低低 温差温差(T)T=0 温度温度T水流水流 h高高 h低低 水位差水位差(h)h=0 水位水位h自动过程的逆过程都不能自动过程的逆过程都不能自动自动进行,要实现,进行,要实现,需要借助外力,所以,需要借助外力,所以,自动过程是自动过程是不可逆过程不
7、可逆过程,反之不成立;,反之不成立;自动过程的推动力是强度性质差;自动过程的推动力是强度性质差;自动过程有推动力,有判据。自动过程有推动力,有判据。物理化学1章热力学基本定律与函数4.熵增原则熵增原则将将S与与 比较,可判断过程比较,可判断过程可逆与否可逆与否TQ(1)绝热可逆:)绝热可逆:,恒熵过程,恒熵过程(2)绝热不可逆:)绝热不可逆:,dS 0 熵增熵增(3)隔离体系:)隔离体系:,dS隔隔 0,无外力作用无外力作用 故故 dS隔隔 0,或,或S隔隔 0 熵判据熵判据 隔离体系进行的自动过程使体系隔离体系进行的自动过程使体系熵增熵增0dr TQS0dir TQS0 WQ0 Qir r0
8、 W自动自动 平衡平衡自动自动 平衡平衡物理化学1章热力学基本定律与函数熵增原则:对隔离体系而言,过程总是自发熵增原则:对隔离体系而言,过程总是自发地向熵值增加的方向进行,直到体系的熵值地向熵值增加的方向进行,直到体系的熵值达到最大值,此时,体系达到平衡状态。达到最大值,此时,体系达到平衡状态。给出了给出了隔离体系隔离体系自动过程的自动过程的方向方向(熵增)和(熵增)和限度限度(熵值最大),且熵值减小的过程不能(熵值最大),且熵值减小的过程不能(自动)进行。对非隔离体系,制造隔离体(自动)进行。对非隔离体系,制造隔离体系:系:dS隔隔=(dS体体+dS环环)0平平自自物理化学1章热力学基本定律
9、与函数四、熵变化(四、熵变化(S)的计算)的计算S是状态函数,且是状态函数,且 ,只讨论可逆过程:,只讨论可逆过程:1.简单状态变化简单状态变化 恒温可逆:恒温可逆:理想气体:理想气体:U=0,Qr=-W=pdV 则则 TQSrd TQSr 2112lnlnppnRVVnRS 物理化学1章热力学基本定律与函数 恒压可逆:恒压可逆:TnCHQppddm,r TTnCSTTpd21m,则:则:12m,lnTTnCSp 理想气体:理想气体:恒容可逆:恒容可逆:TnCUQVVddm,r TTnCSTTVd21m,则:则:12m,lnTTnCSV 理想气体:理想气体:物理化学1章热力学基本定律与函数 变
10、变T、p、V可逆可逆),(),(222111VpTnVpTnS ),(12VpTnA),(12VpTnB恒容恒容恒温恒温恒压恒压恒温恒温1212m,2112m,lnlnlnlnVVnRTTnCppnRTTnCSVp 理想气体:理想气体:物理化学1章热力学基本定律与函数 绝热过程:绝热过程:可逆可逆S=0;不可逆;不可逆S 0,具体情况具,具体情况具体分析体分析(P251题题19),设计对应的可逆过程。,设计对应的可逆过程。2.相变相变 可逆相变(正常相变点下的相变)可逆相变(正常相变点下的相变)为恒温恒压过程:为恒温恒压过程:,且,且所以:所以:TQSr mtrsrHnHQ trsmtrstr
11、sTHnS 物理化学1章热力学基本定律与函数 不可逆相变(非正常相变点下的相变)不可逆相变(非正常相变点下的相变))(A)(A,SpT如:如:)(A)(Atrstrs,SpT恒压变恒压变温温恒压变恒压变温温S1S2 trsd)(Am,1TTpTTnCS TTpTTnCStrsd)(Am,2trsmtrsm,m,trsd)(A)(ATHnTTCCnSTTpp 则:则:物理化学1章热力学基本定律与函数例:例:1mol过冷水在过冷水在-10,p下结冰,求经该过程下结冰,求经该过程 体系的熵变体系的熵变S。已知水在已知水在0,p时的凝固热为时的凝固热为6.02kJmol-1;Cp,m(冰冰)=37.6
12、Jmol-1K-1;Cp,m(水水)=75.3Jmol-1K-1.解:解:trsHm=fusHm=-6.02kJmol-1)KJ(59.20273)1002.6(1d)6.373.75(1d)s(OH)l(OH13273263fusmfus2m,2m,trs TTTHnTTCCnSTTppS水水 S冰冰物理化学1章热力学基本定律与函数过程是否可逆?过程是否可逆?根据根据 Kirchhoff 定律有:定律有:Q=H(263K)=H(273K)+CpdT =-6020+(75.3-37.6)10=-5643 (J)过程的热温商过程的热温商所以,过程不可逆!所以,过程不可逆!STQ )KJ(46.2
13、1263564313.隔离体系的熵变隔离体系的熵变 Q体体=-Q环环,则,则 S环环=-Q体体/T环环,S隔隔=S体体(Q体体/T环环),上例:上例:S环环=21.46JK-1 故故 S隔隔=20.59+21.46=0.87(JK-1)0 自动自动物理化学1章热力学基本定律与函数P217 223的例的例4-21例例4-26得:得:同晶型的同种物质同晶型的同种物质S高温高温 S低温低温;气态物质气态物质S低压低压 S高压高压;同种物质同种物质S气气 S液液 S固固;物质混合物质混合S混后混后 S混前混前;已有知识:质点热运动高温时比低温剧烈;已有知识:质点热运动高温时比低温剧烈;压强压强,气体质
14、点运动自由度,气体质点运动自由度;气态物质;气态物质运动自由度最大;物质混合后体系更混乱。运动自由度最大;物质混合后体系更混乱。说明:说明:体系混乱度越大,体系的熵值越大体系混乱度越大,体系的熵值越大物理化学1章热力学基本定律与函数五、熵的统计意义五、熵的统计意义 热力学概率(热力学概率()1.a,b,c,d可区分的小球可区分的小球 左左 右右)!(!nmnmCnm 根据组合公式根据组合公式 得:得:四个球都在左边四个球都在左边 ,数学概率为,数学概率为1/16104 C四个球都在右边四个球都在右边 ,数学概率为,数学概率为1/16104 C三个球在左边,一个球在右边三个球在左边,一个球在右边
15、 ,数学概率为,数学概率为1/4414 C三个球在右边,一个球在左边三个球在右边,一个球在左边 ,数学概率为,数学概率为1/4414 C二个球在右边,二个球在左边二个球在右边,二个球在左边 ,数学概率为,数学概率为3/8624 C8341161 ,说明分布越不均匀,概率越小,说明分布越不均匀,概率越小物理化学1章热力学基本定律与函数平均分布的概率最大,且质点数平均分布的概率最大,且质点数,如:如:,;而无论而无论m为多少,总有为多少,总有 ,故质点数增加,故质点数增加,平均分布的概率与不平均分布的概率差增大。平均分布的概率与不平均分布的概率差增大。热力学上将同一种宏观状态所对应的微观状热力学上
16、将同一种宏观状态所对应的微观状态数称为热力学概率,记为态数称为热力学概率,记为,且,且2mmC7048 C1847561020 C10 mCnmC 特点:特点:1,大,数学概率大;故体系大,数学概率大;故体系自动自动从概率小的状态向概率大的状态移动,其逆过从概率小的状态向概率大的状态移动,其逆过程不可能自动实现。程不可能自动实现。物理化学1章热力学基本定律与函数2.热力学概率与自动过程热力学概率与自动过程 小,体系的有序程度高,混乱度低;小,体系的有序程度高,混乱度低;大,体系的无序程度高,混乱度高;大,体系的无序程度高,混乱度高;在无外力作用下,有序状态不能维持,因此在无外力作用下,有序状态
17、不能维持,因此,体系总是自动从有序状态向无序状态运动,体系总是自动从有序状态向无序状态运动,所以,所以,的过程是自动过程的过程是自动过程。3.熵的统计意义熵的统计意义 质点在空间出现的概率质点在空间出现的概率空间的大小,设:空间的大小,设:某质点在容积为某质点在容积为Vi 的空间出现的概率为的空间出现的概率为i物理化学1章热力学基本定律与函数即:即:(2):(1)=V2:V1 1mol(L个质点个质点)理想气体恒温可逆膨胀理想气体恒温可逆膨胀V1 V2则则 ,而,而 ,故:,故:LLLVV 12)1()2(1212lnVVRS 12121212lnlnlnln1kkLRRSSSL 即:即:S=
18、k ln 称为称为Boltzmann方程方程=(1)(2)(3)(n)S=kln(1)+ln(2)+ln(3)+ln(n)=S(1)+S(2)+S(3)+S(n)容量性质容量性质物理化学1章热力学基本定律与函数质点混乱程度的表现,质点混乱程度的表现,Boltzmann方方程将程将S(宏观性质宏观性质)与与(微观表现微观表现)联系起来联系起来,所以:所以:S是体系内部质点混乱度的量度是体系内部质点混乱度的量度六、化学反应的熵变与规定熵六、化学反应的熵变与规定熵 化学反应是不可逆过程,反应热是不可逆化学反应是不可逆过程,反应热是不可逆过程热,所以,过程热,所以,但是熵是状态,但是熵是状态函数,反应
19、函数,反应 aSm,A eSm,E fSm,F hSm,H rSm=(fSm,F+hSm,H)-(aSm,A+eSm,E)那么那么 Sm,B=?THTQSmrmr HFEA,hfeapT 物理化学1章热力学基本定律与函数 规定熵与热力学第三定律(规定熵与热力学第三定律(P227)定压下:定压下:积分:积分:TTnCTQSpddm,r TpTTpSSTTnCSSTTnCST0m,00m,ddd0?0m,TpTC热力学第三定律规定:完整晶体的热力学第三定律规定:完整晶体的 S0=0完整晶体:晶体内部无任何缺陷,形成严完整晶体:晶体内部无任何缺陷,形成严 格的点阵结构。格的点阵结构。空间分布概率空间
20、分布概率c=1,能量分布概率,能量分布概率e=1,则,则总分布概率总分布概率=ce=1,故,故 S0=kln=0物理化学1章热力学基本定律与函数 TpTTTnCS0m,d0 T的范围内无相变:的范围内无相变:0 T的范围内有相变:的范围内有相变:211ddm(2),01)1(mtrsm(1),TTpTpTTTnCTHnTTnCS低温下,热容值难测,根据固体热容理论低温下,热容值难测,根据固体热容理论导出的导出的Debye公式公式(低温热容立方式低温热容立方式)可计算:可计算:3D,1944 TCmV2.标准摩尔熵标准摩尔熵()标准大气压下,纯物质在温度标准大气压下,纯物质在温度T时的规定熵。时
21、的规定熵。由由298.15K时物质的时物质的 ,按,按P229公式算公式算 mS mS)(mTS 物理化学1章热力学基本定律与函数3.化学反应的标准摩尔熵变化学反应的标准摩尔熵变()mrSTTCKSTSTSTpd)B()298,B(),B()(298m,BmBmBmr 由物质的标准摩尔熵(由物质的标准摩尔熵()计算:)计算:mS 由物质的标准摩尔生成熵(由物质的标准摩尔生成熵()计算:)计算:mfS),B()(mfBmrTSTS 注意:注意:),B(),B(mmfTSTS 稳定单质:稳定单质:,但,但0),B(mf TS0),B(m TS物理化学1章热力学基本定律与函数5.自由能自由能A和和G
22、一、一、Helmholtz自由能自由能(free energy)推导推导 第一定律第一定律 第二定律第二定律 TdS 两式结合两式结合 dUTdS-pdV+即即-dU+TdS pdV-ddWVpQU QirrirrWWirr 恒温过程恒温过程 TdS=d(TS)则则 d(U TS)pdV-Wirr物理化学1章热力学基本定律与函数令令 AU-TS,A亥姆霍兹自由能亥姆霍兹自由能则则 dAT pdV-或或 dAT WirrirrTW 恒温恒容过程恒温恒容过程-pdV=0 则则 dAT,V-Wirr 恒温恒容无有效功过程恒温恒容无有效功过程 =0 则则 dAT,V,W=0 0 0 或或 AT,V,W
23、=0 0 0自自平平TW自自平平物理化学1章热力学基本定律与函数2.讨论讨论 A是体系的状态函数,容量性质,能量量是体系的状态函数,容量性质,能量量 纲,绝对值无法确定;纲,绝对值无法确定;可逆条件下的可逆条件下的A才有物理意义:才有物理意义:恒温可逆恒温可逆 ,体系自由能减少全,体系自由能减少全 部用于体系对外作功;部用于体系对外作功;恒温恒容可逆恒温恒容可逆 ,体系自由能减,体系自由能减 少全部用于体系对外作有效功;少全部用于体系对外作有效功;恒温可逆无有效功恒温可逆无有效功dAT,w=0=pdV,体系,体系 自由能减少全部用于体系对外作体积功;自由能减少全部用于体系对外作体积功;Td-W
24、AT d-,WAVT 物理化学1章热力学基本定律与函数在一定条件下在一定条件下A可作过程性质的判据:可作过程性质的判据:AT、AT,V 和和 AT,W=0 判断可逆与否判断可逆与否 AT,V,W=0判断自动与否判断自动与否A也称为恒容位也称为恒容位二、二、Gibbs自由能自由能 推导推导 由一、二定律的结合式由一、二定律的结合式irrW-dU+TdS pdV-得:得:irrW-dU-pdV+TdS-物理化学1章热力学基本定律与函数恒温、恒压下:恒温、恒压下:dUpdV+TdS=d(U+pVTS)令令 G U+pVTS=H TS 吉布斯自由能吉布斯自由能irrW则:则:dGT,p 2.讨论讨论
25、G是体系的状态函数,容量性质,能量量是体系的状态函数,容量性质,能量量 纲,绝对值无法确定;纲,绝对值无法确定;在恒温、恒压可逆下,体系在恒温、恒压可逆下,体系G的减少体现的减少体现 了体系作有效功的本领:了体系作有效功的本领:WdGT,p=物理化学1章热力学基本定律与函数在一定条件下,体系在一定条件下,体系Gibbs自由能的变化自由能的变化 量可作为过程性质的判据:量可作为过程性质的判据:判断过程可逆与否判断过程可逆与否irrWdGT,p irrW或或 GT,p 判断过程自动与否判断过程自动与否 体系体系Gibbs自由能又称为恒压位自由能又称为恒压位自自平平GT,p,W=0 0三、稳定平衡的
26、热力学判据三、稳定平衡的热力学判据平衡:体系性质不随时间变化,一般有平衡:体系性质不随时间变化,一般有3要素要素物理化学1章热力学基本定律与函数热力学上体系平衡的判据是热力学上体系平衡的判据是S、A、G 熵判据熵判据:平衡达最大平衡达最大亥氏自由能判据亥氏自由能判据:平衡达最小平衡达最小吉氏自由能判据吉氏自由能判据:平衡达最小平衡达最小 既满足平衡的既满足平衡的一般条件一般条件,又满足又满足热力学平衡条热力学平衡条 件件的平衡称为的平衡称为稳定平衡稳定平衡(态态);满足平衡的一般条件满足平衡的一般条件,但但不不满足热力学平衡条满足热力学平衡条 件的平衡称为件的平衡称为亚稳亚稳(定定)平衡平衡(
27、或介安状态或介安状态);自自平平GT,p,W=0 0自自平平AT,V,W=0 0自自平平S隔离隔离 0物理化学1章热力学基本定律与函数非平衡非平衡亚稳平衡亚稳平衡稳定平衡稳定平衡扰动后不能复原扰动后不能复原扰动后可能复原扰动后可能复原自由能判据的实质仍是熵判据自由能判据的实质仍是熵判据:如如 状态状态 状态状态 恒恒T,V,且且W=0时时:A体体=U体体TS体体0 又又U体体=QV,则则S体体 Q/T,S环环=Q/T 所以所以 S隔离隔离=S体体+S环环 0 熵判据熵判据平平自自平平自自平平自自物理化学1章热力学基本定律与函数四、四、A和和G的计算的计算 依据的基本关系式依据的基本关系式:A=
28、UTS,G=HTS=UpVTS=ApV dA=dUTdS SdT dG=dHTdS SdT =dUpdV Vdp TdS SdT =dApdV Vdp A=U(TS)G=H(TS)=U(pV)(TS)物理化学1章热力学基本定律与函数 恒温可逆简单状态变化恒温可逆简单状态变化 恒温恒温 dA=dUTdS 或或A=U TS dG=dHTdS或或G=HTS 可逆可逆 TdS=Q,且,且 dUQ=WpdV 所以,所以,dA=WpdV,dG=dApdV Vdp=WVdp 适用条件:封闭体系经恒温可逆变化适用条件:封闭体系经恒温可逆变化 若无有效功,则若无有效功,则 dA=pdV,dG=Vdp A=pdV
29、,G=Vdp物理化学1章热力学基本定律与函数理想气体:理想气体:p=nRT/V,V=nRT/p故故1221lnlnd21ppnRTVVnRTVpAVV AVVnRTppnRTpVGpp 2112lnlnd21例例 在在300K时,体系的压强由时,体系的压强由p增至增至10p,求经过该过程体系,求经过该过程体系的的A和和G。设体系为(。设体系为(1)1mol理想气体;(理想气体;(2)1mol水。水。解解:(1)(2)水为凝聚态水为凝聚态,可忽略压强对其体积的影响可忽略压强对其体积的影响,即即dV=0,则,则 A=0,1mol水的水的体积为体积为 Vm11810-6=1.8 10-5/m3 所以
30、:所以:G=V(p2p1)=9 pV=16.4/JJ574310ln300314.81)ln(12 ppnRTGA物理化学1章热力学基本定律与函数2.相变过程相变过程可逆相变:为恒可逆相变:为恒T,p无有效功过程,故:无有效功过程,故:trsG=0,trsA=ptrsV不可逆相变:设计含可逆相变的可逆过程不可逆相变:设计含可逆相变的可逆过程例例 1mol水在水在373.15K,p下向真空蒸发成下向真空蒸发成373.15K,p的的水蒸气,求体系的水蒸气,求体系的A和和G,并判断过程性质。,并判断过程性质。解:解:p1=p2 p外外H2O(l),373.15K,p H2O(g),373.15K,p
31、向真空向真空 A,G设计:可逆蒸发,设计:可逆蒸发,trsG=0G=trsG=0,能否用于判断过程性质,能否用于判断过程性质物理化学1章热力学基本定律与函数A=trsA=ptrsV=p(Vg Vl)pVg 将水蒸气视为理想气体,则:将水蒸气视为理想气体,则:A=nRT=3101/J,而而 A=AT0,且,且作功为零(作功为零(W=0,W=0),故原过程为自动过程),故原过程为自动过程3.化学变化过程的化学变化过程的 的熵法计算的熵法计算 mrGaA+eE=fF+hH T,p mrmrmrSTHG)(mrmrmr STUA注意:要求反应物间不形成溶液注意:要求反应物间不形成溶液 TpCHTH15
32、.298mrmr)K15.298()(物理化学1章热力学基本定律与函数TTCSTSTpd)K15.298()(15.298mrmr TTCTTTCSTHTGTpTpdd)K15.298()K15.298()(15.29815.298mrmrmr Cp=0,)K15.298()K15.298()(mrmrmr STHTG温度变化不太大时,取温度变化不太大时,取Cp=常数,则常数,则)K15.298()K15.298()K15.298(15.298ln)15.298()K15.298()K15.298()(0mrmrmrmrmrpppCTMSTHTCTTCSTHTG 温度变化较大时,分段取温度变化
33、较大时,分段取Cp=常数常数 物理化学1章热力学基本定律与函数例例 求反应求反应 2Al(s)+1.5O2(g)=Al2O3(s)的的 。)K900(mr G解:查表知解:查表知 Cp,mAl(s)=20.67+12.3810-3T Cp,mAl2O3(s)=106.61+17.7810-3T 28.53105T 3 Cp,mO2(g)=29.96+4.1810-3T 1.67105T 3 则则 Cp=20.33 13.2510-3T 26.025105T 3-13mrmolJ/104.1677)K15.298(H-11mrmolKJ/19.313)K15.298(S115.29815.298
34、mrmrmrmolkJ/27.1395dd)K15.298()K15.298()(TTCTTTCSTHTGTpTp物理化学1章热力学基本定律与函数采用近似计算:采用近似计算:取取Cp=0,Cp(900K)=5.191mrmrmrmolkJ/52.1395)K15.298(900)K15.298()K900(SHG相对误差为相对误差为0.018%取取Cp=Cp(298.15K)=12.9210mrmrmrmolkJ/89.1389)K15.298()K15.298()K15.298()(pCTMSTHTG相对误差为相对误差为0.38%物理化学1章热力学基本定律与函数4.自由能函数法计算自由能函数
35、法计算 (P237238)mrG构造一个函数:构造一个函数:并将其计算结果列表,可以将并将其计算结果列表,可以将 的计算简化,的计算简化,称为自由能函数。称为自由能函数。TTHTGT)()()(rmm mrG)(T五、封闭体系热力学函数间的关系五、封闭体系热力学函数间的关系 定义关系式定义关系式 三个:三个:HU+pV,AUTS,GHTS 导出导出 A=HpVTS,G=U+pVTS=A+pV 适用于一切封闭体系的平衡态适用于一切封闭体系的平衡态 物理化学1章热力学基本定律与函数2.微分关系式微分关系式 dH=dU+d(pV)=dU+pdV+Vdp dA=dUd(TS)=dUTdS SdT dG
36、=dHd(TS)=dHTdSSdT 经无非体积功的可逆过程,经无非体积功的可逆过程,TdS=,则:则:rQ 适用纯物质或组成适用纯物质或组成不变的封闭体系,经不变的封闭体系,经只作体积功的可逆过只作体积功的可逆过程后体系性质的变化程后体系性质的变化dU=TdS pdVdH=TdS+Vdp dA=SdT pdVdG=SdT+Vdp热力学基本关系热力学基本关系式式物理化学1章热力学基本定律与函数按数学观点看,若按数学观点看,若dz=Adx+Bdy,则,则 z=f(x,y)有有U=U(S,V),H=H(S,p),A=A(T,V),G=G(T,p)称为特征函数关系,括号内的物理量为特征变量。称为特征函
37、数关系,括号内的物理量为特征变量。若知若知G=G(T,p),则可求出则可求出U、H、A和和S(P239)特征函数可作判据,以特征变量恒定为条件特征函数可作判据,以特征变量恒定为条件dzx,y,W=00 过程自动进行过程自动进行=0 平衡过程平衡过程(体系达到平衡体系达到平衡)0 过程不能自动进行或逆向自动过程不能自动进行或逆向自动物理化学1章热力学基本定律与函数3.偏微分关系式偏微分关系式对特征函数作全微分得:对特征函数作全微分得:)dd(ddd)d-d(ddd)dd(ddd)d-d(dddpVTSppGTTGGVpTSVVATTAApVSTppHSSHHVpSTVVUSSUUTpTVSpSV
38、 将系数进行比较将系数进行比较物理化学1章热力学基本定律与函数TSSTVppVVAVUppHpGVTATGSSHSUT ,得对应系数关系式:得对应系数关系式:适用于封闭体系平衡状态适用于封闭体系平衡状态4.Maxwell关系式关系式 将不可测量转化为可测量,如将不可测量转化为可测量,如P241例例4-31考察四个热力学基本关系式,将方程右边的前考察四个热力学基本关系式,将方程右边的前项与后项交叉微分,就得到项与后项交叉微分,就得到Maxwell关系式关系式物理化学1章热力学基本定律与函数dU=TdSpdVVSSpVT dH=TdS+Vdp pSSVpT dA=SdT pdVVTTpVS dG=
39、SdT+VdppTTVpS 物理化学1章热力学基本定律与函数5.Gibbs-Helmholtz方程式方程式STGSTGpp 恒温恒温21THGTGTTHGTGTGTHSTHGppp 则则 2THTTGp 相当于相当于xxfyxy)(dd HxfTxGy )(,吉布斯吉布斯-亥姆霍兹亥姆霍兹等压等压方程式方程式物理化学1章热力学基本定律与函数TTHTGTGTGTTTGTGdd21221121122 例例 试判断试判断283K,p下,白锡和灰锡哪一种晶型稳定?下,白锡和灰锡哪一种晶型稳定?已知:已知:298K,p下,反应下,反应 Sn(白白)=Sn(灰灰)的的rSm=-7.54 JK-1mol-1
40、;fHmSn(灰灰)=-2197-2197Jmol-1;fHmSn(白白)=0 0;Cp,m Sn(灰灰)=25.73 JK-1mol-1;Cp,m Sn(白白)=26.15 JK-1mol-1。解:解:Sn(白白)=Sn(灰灰)的的Cp=-0.42 JK-11298mrmrmolJ/42.02072d)K298()(TTCHTHTp1mrmolJ2197)K298(H39.0d42.02072283)K283(298K)298(2982832mrmr TTTGG物理化学1章热力学基本定律与函数1mrmrmrmol/J9.49)K298(298)K298()K298(SHG1mrmol/J63
41、28339.09.49298283)K283(G因为:因为:0)K283(mr G故故 283K、p下,灰锡稳定;下,灰锡稳定;而而 ,反应自动逆向进行,反应自动逆向进行,故故 298K、p下,白锡稳定下,白锡稳定,反应自动正向进行,反应自动正向进行,0)K298(mr G另有另有 2TUTTAV 吉布斯吉布斯-亥姆霍兹亥姆霍兹等容等容方程式方程式物理化学1章热力学基本定律与函数6.热力学第三定律的实验依热力学第三定律的实验依据据低温电池反应研究发现:低温电池反应研究发现:随着温度降低,随着温度降低,H和和G趋向一致,趋近方式如图。趋向一致,趋近方式如图。即即 ,S必须有限必须有限GHT 0l
42、imlim ppTHTGT0T0而而pppCTHSTG ,故有故有0lim pCT00lim)lim(STHGT0T00lim ST0和和Plank提出提出0K下下Sm=0的假设的假设物理化学1章热力学基本定律与函数六、热力学在单组分体系相变过程中的应用六、热力学在单组分体系相变过程中的应用 Clapeyron方程式方程式 两相平衡:两相平衡:A()=A()G1=0 即即 (1)体系温度变化体系温度变化dT,原平衡被破坏,达到,原平衡被破坏,达到新平新平 衡时,体系压强将变化衡时,体系压强将变化dp,又有,又有 G2=0 即即 (2)式式(1)代入式代入式(2)得:得:以以 dG=-SdT+V
43、dp代入上式得:代入上式得:T,p)(m)(mddGG)(m)(m)(m)(mddGGGG )(m)(mGG 物理化学1章热力学基本定律与函数pVTSpVTSdddd-)(m)(m)(m)(m 移项:移项:pVVTSSdd)(m)(m)(m)(m 则:则:mmmm)(m)(m)(m)(mddVTHVSVVSSTp mtrsmtrsddHVTpT 即:即:克拉佩龙方程,适用于克拉佩龙方程,适用于纯物质体系的任意两相平衡纯物质体系的任意两相平衡凝聚系间相变的凝聚系间相变的trsVm较小,则较小,则 较小,即,压强变化对相变温度影响较小。较小,即,压强变化对相变温度影响较小。mtrsmtrsddHV
44、TpT 物理化学1章热力学基本定律与函数 温度变化不大时:温度变化不大时:trsHm可视为常数可视为常数12mtrsmtrs12mtrsmtrslndd2121TTVHppTVTHpTTpp 令令xTTT 112则则)1ln(1lnln11212xTTTTT 因为因为 x 较小,所以较小,所以 ln(1+x)x,故:,故:1mtrsmtrs12mtrsmtrs12lnTTVHTTVHppp 或或p=KT,p 与与T呈线性关系。呈线性关系。物理化学1章热力学基本定律与函数2.Clausius-Clapeyron方程(克方程(克-克公式)克公式)两相中有一相为气相,两相中有一相为气相,|trsVm
45、|Vm,g,则,则pRTHTVHVTHTp 2mtrsgm,mtrsmtrsmtrs|dd或或2mtrs|ddlnRTHTp )11(|ln12mtrs12TTRHpp|lnmtrsBTABRTHpp BTABRTHpp 303.2303.2|lgmtrs由由p T-1关系关系线求线求trsHm物理化学1章热力学基本定律与函数例:溜冰鞋下面的冰刀与冰面接触的地方为长例:溜冰鞋下面的冰刀与冰面接触的地方为长7.62cm,宽,宽为为0.0024cm。若溜冰人的体重为。若溜冰人的体重为60kg,问此人双脚着溜冰,问此人双脚着溜冰鞋站在冰面上时,冰刀下冰的熔点为多少度?鞋站在冰面上时,冰刀下冰的熔点为
46、多少度?已知冰的融化热已知冰的融化热fusHm=6.01kJmol-1,正常融化温度为,正常融化温度为273.16K,冰和水的密度分别为,冰和水的密度分别为 920 和和 1000kgm-3。解:解:2652s136mfus1363OH,m1363OH,mm/10867.11045.21062.7molm/10565.1molm/101810001018molm/10565.19920101822 AVMVMV水水水水冰冰冰冰 物理化学1章热力学基本定律与函数溜冰人在冰刀上产生的压强为:溜冰人在冰刀上产生的压强为:Pa/10575.110867.128.960286s2 Amgp用用 来计算:
47、来计算:T2=262.19K12mtrsmtrslnTTVHp 1mtrsmtrsTTVHp 用用 来计算:来计算:T2=261.96KPa/1001325.151 pK/16.2731 T物理化学1章热力学基本定律与函数若若trsHm随温度变化随温度变化则则 trsHm(T)=H0+Cp(T)dTTRTTTCHppdd)()(lnd20 工业上常采用工业上常采用Antoine经验式经验式(4-136),P2473.Trouton规则规则11bmvapKmolJ88 TH常与克常与克-克公式联合使用克公式联合使用如:在测定液体饱和蒸气压时,若沸点测定如:在测定液体饱和蒸气压时,若沸点测定误差为
48、误差为1%,则压强测定误差约为,则压强测定误差约为 。物理化学1章热力学基本定律与函数4.外压对饱和蒸气压的影响外压对饱和蒸气压的影响在某温度下,纯物质体系的气液两相平衡在某温度下,纯物质体系的气液两相平衡时的蒸汽压为该物质的饱和蒸汽压时的蒸汽压为该物质的饱和蒸汽压(pg)。当将该物质置于空气之中当将该物质置于空气之中(p),液面上的压,液面上的压强改变,此时的蒸汽压为强改变,此时的蒸汽压为(pgpg):l(pg,Gm,l)=g(pg,Gm,g)T,pgl(p,Gm,l)=g(pg,Gm,g)T,pg+dpG1G2Gm,l=Gm,gGm,l=Gm,gGm,l=Gm,l+dGm,l,Gm,g=Gm,g+dGm,g dGm,l=dGm,g 物理化学1章热力学基本定律与函数恒温:恒温:dG=Vdp,则,则 gm,lm,ddgggpppppVpV设液体体积不随压强变化而变化,气体为设液体体积不随压强变化而变化,气体为理想气体,则积分得:理想气体,则积分得:ggglm,ln)(ppRTppV )(lnglm,ggppRTVpp 或或当当 p,pg
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 《认识角》ppt教学讲解课件
- 《从数据谈节水》数据的收集、整理与描述优秀教学ppt课件
- 人员配置-公司组织架构与人员配置计划课件
- 《认识分式》ppt课件
- 《从百草园到三味书屋》第一课时ppt课件
- 公路工程概预算三课件
- 中考物理专题突破-综合能力题教学课件
- 《创新设计》高考英语二轮复习(江苏专用)ppt课件:第二部分-基础语法巧学巧练-专题八-非谓语动词
- 中考物理专题复习课件:滑轮及滑轮组
- CIM安全标识统一规划课件
- 中考物理专题复习教学课件-质量和密度
- 《处理民族关系的原则平等团结共同繁荣》ppt课件
- 中考物理专题复习之物理实验和探究题复习指导教学课件
- 《十二人人都会有挫折》初中心理健康教育闽教版《中学生心理健康》七级课件
- Cisco无线网络-安全-Brief课件
