 人教版初三化学-盐和化肥-知识点总结
人教版初三化学-盐和化肥-知识点总结


《人教版初三化学-盐和化肥-知识点总结》由会员分享,可在线阅读,更多相关《人教版初三化学-盐和化肥-知识点总结(5页珍藏版)》请在装配图网上搜索。
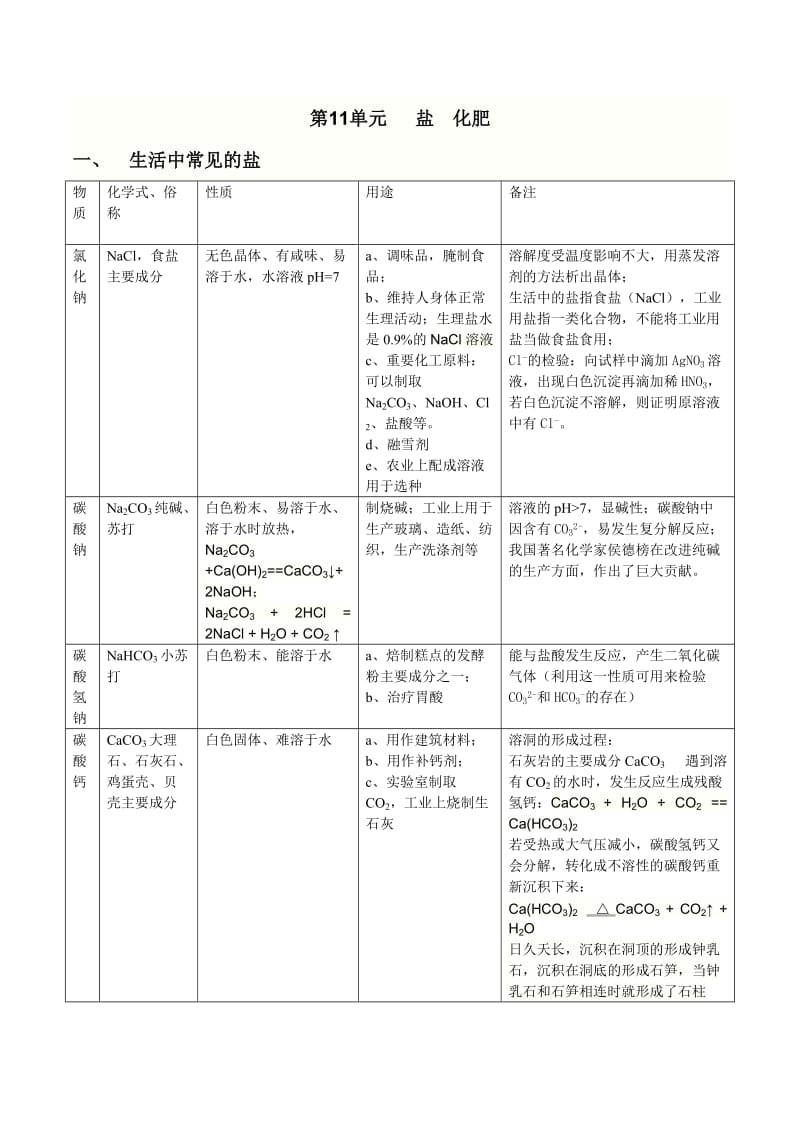
1、第11单元 盐 化肥一、 生活中常见的盐物质化学式、俗称性质用途备注氯化钠NaCl,食盐主要成分无色晶体、有咸味、易溶于水,水溶液pH=7a、调味品,腌制食品;b、维持人身体正常生理活动;生理盐水是0.9%的NaCl溶液c、重要化工原料:可以制取Na2CO3、NaOH、Cl2、盐酸等。d、融雪剂e、农业上配成溶液用于选种溶解度受温度影响不大,用蒸发溶剂的方法析出晶体;生活中的盐指食盐(NaCl),工业用盐指一类化合物,不能将工业用盐当做食盐食用;Cl-的检验:向试样中滴加AgNO3溶液,出现白色沉淀再滴加稀HNO3,若白色沉淀不溶解,则证明原溶液中有Cl-。碳酸钠Na2CO3纯碱、苏打白色粉末
2、、易溶于水、溶于水时放热,Na2CO3 +Ca(OH)2=CaCO3+2NaOH;Na2CO3 + 2HCl = 2NaCl + H2O + CO2 制烧碱;工业上用于生产玻璃、造纸、纺织,生产洗涤剂等溶液的pH7,显碱性;碳酸钠中因含有CO32-,易发生复分解反应;我国著名化学家侯德榜在改进纯碱的生产方面,作出了巨大贡献。碳酸氢钠NaHCO3小苏打白色粉末、能溶于水a、焙制糕点的发酵粉主要成分之一;b、治疗胃酸能与盐酸发生反应,产生二氧化碳气体(利用这一性质可用来检验CO32-和HCO3-的存在)碳酸钙CaCO3大理石、石灰石、鸡蛋壳、贝壳主要成分白色固体、难溶于水a、用作建筑材料;b、用作
3、补钙剂;c、实验室制取CO2,工业上烧制生石灰溶洞的形成过程:石灰岩的主要成分CaCO3 遇到溶有CO2的水时,发生反应生成残酸氢钙:CaCO3 + H2O + CO2 = Ca(HCO3)2若受热或大气压减小,碳酸氢钙又会分解,转化成不溶性的碳酸钙重新沉积下来:Ca(HCO3)2 CaCO3 + CO2 + H2O日久天长,沉积在洞顶的形成钟乳石,沉积在洞底的形成石笋,当钟乳石和石笋相连时就形成了石柱二、粗盐提纯1、粗盐中还有较多可溶性杂质(MgCl2、CaCl2deng )和不溶性杂志(泥沙等)粗盐提纯的原理:1、用过滤的方法除去不溶性杂质2、根据氯化钠的溶解度曲线用蒸发结晶的方法除去可溶
4、性杂质2、提纯步骤:溶解:用天平称取食盐,用量筒量取水,放入烧杯,用玻璃棒搅拌过滤:一贴、二低、三紧靠。如滤液仍浑浊,应再过滤一次。 实验仪器有:烧杯(两个)、漏斗、滤纸、玻璃棒、带有铁圈的铁架台蒸发结晶:将所得澄清滤液倒入蒸发皿中,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,并用玻璃棒不断搅拌,出现比较多固体时,停止加热。计算产率:用玻璃棒把固体转移到纸上,称量。产率=精盐的质量/粗盐的质量100%【注意】1、玻璃棒的作用 溶解时用玻璃棒搅拌,以加快食盐溶解 过滤使用玻璃棒引流 蒸发时用玻璃棒搅拌,以防止局部温度过高,造成液滴飞溅 计算产率时用玻璃棒转移氯化钠固体 2、过滤操作应注意(一贴、二
5、低、三靠) 一贴:滤纸紧贴漏斗内壁(一般在将滤纸贴在漏斗壁时先用水润湿并挤出气泡,因为如果有气泡会影响过滤速度) 二低:一低、滤纸边缘低于漏斗边缘 二低、滤液面边缘低于滤纸边缘 三靠:一靠:烧杯紧靠玻璃棒;二靠:玻璃棒末端紧靠三层滤纸处(三层滤纸一边比一层滤纸那边厚,三层滤纸那边不易被弄破);三靠:漏斗末端较长处紧靠烧杯内壁(防止溅出) 3、过滤后溶液仍浑浊的原因: 滤纸破损 过滤时,滤液高于滤纸边缘4、实验过程中,出现的误差: 溶解搅拌时液滴溅出,产率降低 溶解时加入的粗盐过多,未完全溶解,产率降低 过滤时,未洗涤玻璃棒、烧杯而使氯化钠损失,产率降低 蒸发时没有及时搅拌或者停止太晚造成液滴飞
6、溅,使产率降低 称量时操作或读数错误三、盐的化学性质(酸碱盐之间的化学反应)盐的组成:由金属离子(或NH4+)和酸根离子组成1、盐酸新盐新酸CaCO3 + 2HCl = CaCl2 + H2O + CO2(制取CO2的原理) Na2CO3 + 2HCl = 2NaCl + H2O + CO2 NaHCO3+HCl=NaCl+H2O+CO2(灭火的原理)2、盐碱新盐新碱Na2CO3+Ca(OH)2=CaCO3+2NaOH Na2SO4+Ba(OH)2=BaSO4+2NaOH3、盐盐新盐新盐Na2SO4+BaCl2=BaSO4+2NaCl AgNO3+NaCl=AgCl+NaNO34、盐+金属=新
7、盐+新金属,遵循金属活动性顺序四、复分解反应1、定义:两种化合物互相交换成分,生成另外两种化合物的反应。形如 AB+CD=AD+BC2、特点:仅相互交换成分,无元素、化合价的变化3、发生的条件:有沉淀 或有水 或有气体生成(三者之一)4、类型:酸+金属氧化物=盐+水 酸+碱=盐+水 酸+盐=新酸+新盐 碱+盐=新碱+新盐 盐+盐=新盐+新盐五、化肥(植物生成需求量最大的元素是氮、磷、钾)1、氮肥:种类:尿素CO(NH2)2 氨水NH3H2O 铵盐(NH4HCO3 、NH4Cl (NH4)2SO4 ) 硝酸盐NH4NO3、NaNO3。作用:能促使作物茎叶生成茂盛、叶色浓绿若缺氮,会生成迟缓、叶色
8、发黄、严重时叶脉呈淡棕色 【注意】铵态氮肥中NH4HCO3 最不稳定,保存时要注意防潮避光,同时铵态氮肥不宜与碱性肥料混合使用。2、磷肥:种类:磷矿粉Ca3(PO4)2、钙镁磷肥(含钙和镁的磷酸盐)、过磷酸钙(磷酸二氢钙Ca(H2PO4)2和CaSO4混合物)等含磷的物质作用:促使根系发达、增强抗寒、抗旱能力;缺磷时,植株矮小、生长迟缓、根系瘦弱3、钾肥:种类:硫酸钾、氯化钾;作用:促进茎秆粗壮、增强抗病抗虫害、抗倒伏能力;若缺钾,茎秆软弱、易倒伏、叶片呈褐色、并逐渐焦枯。4、复合肥:含两种或两种以上营养元素的化肥。主要有硝酸钾KNO3、磷酸铵(NH4H2PO4和(NH4)2HPO4混合物)、
9、磷酸钾等。 5、化肥的简单鉴别方法:一看、二闻、三溶,灼烧、与碱混合研磨等看外观:氮肥、钾肥都是白色晶体、磷肥是灰白色固体粉末加水:氮肥、钾肥都溶于水,磷肥大多不溶于水或者部分溶于水灼烧:氮肥可以燃烧或熔化冒烟,钾肥不燃烧。能灼烧发光的是硝酸铵,熔化冒烟的是硫酸铵,氯化铵几种常见氮肥简易鉴别:NH3H2O 液态NH4HCO3 有强烈的氨味 尿素CO(NH2)2 加入碱无氨味(NH4)2SO4 加入硝酸钡和稀硝酸,产生白色沉淀NH4Cl 加入硝酸银溶液和稀硝酸,产生白色沉淀NH4NO3 灼烧能燃烧发光;熔化冒烟的为硫酸铵,氯化铵6、有关计算:会计算化肥中某元素的质量分数、相对分子质量、元素间的质
10、量比等。 【易错点】一、 除杂遵循的原则:不增、不减、简便、易分 所选除杂试剂只与杂质反应,不与原物质反应;反应后生成便于除去的物质,如气体、沉淀等;与杂质反应时不会产生新的杂质。1、 物理方法:利用物质的溶解性、磁性、沸点等物理性质的差异分离例: 铁粉和碳粉 BaSO4和NaOH粉末2、 化气法:像混合物中加入某种试剂,使混合物中的杂质变为气体逸出例:NaCl中混有少量Na2CO3杂质 方法:加入HCl Na2CO3 +HCl=NaCl+H2O+CO23、沉淀法:向混合物中加入某种试剂,使该试剂与杂质放映转化成沉淀,再经过虑除掉沉淀,以除杂质例:NaCl中混有少量NaSO4杂质 方法:加入B
11、aCl,过滤除去杂质 NaSO4=BaSO4+NaCl4、加热高温法:热高温混合物是杂质变为气体除去例:CaO中混有CaCO3杂质 方法:高温加热 CaCO3 高温 CaO+ CO25、溶解法:向混合物中加入某种试剂,使杂质与试剂反应而被溶解掉,以除去杂质例:Cu中混有少量CuO杂质 方法:加入稀HCl,再经过过滤而除去 CuO+HCl=CuCl2+ H2O6.置换法:向混合物中加入一种单质,是单质与杂质反应,而被除去例:FeSO4中混有少量CuSO4杂质方法:向其加入足量的铁粉 Fe+ CuSO4=Cu+FeSO47、吸收法:将气体混合物通过洗气装置,杂质被洗气装置的试剂吸收而除去例:CO中
12、混有少量CO2方法:将混合气体通过盛有足量的NaOH溶液的洗气装置 2NaOH+CO2=Na2CO3+H3O二、溶解性口诀:钾、钠、铵盐、硝酸盐; 氯化物除银、亚汞; 硫酸盐除钡和铅; 碳酸、磷酸盐,只溶钾、钠、铵。 氢氧化钙硫酸钙,微溶于水要记牢。【补充】1、元素化合价口诀:钾钠银氢正一价,钙镁钡锌正二价。铝三碳四氧负二, 氟氯溴碘负一价。金正非负单质零,正负总价和为零。2、原子团化合价口诀:负一硝酸氢氧根,负二硫酸碳酸根。负三记住磷酸根,正一价的是铵根。3、溶液颜色口诀:铜蓝、亚铁绿、铁黄、高锰酸钾紫4、七字沉淀“一蓝一红褐五白”蓝色:Cu(OH)2红褐色:Fe(OH)3白色:Mg(OH)
13、2 BaCO3、 BaSO4 、CaCO3、 AgCl其中BaSO4、AgCl既难溶于水,又不溶于稀硝酸。5、判断复分解反应的实质:十对粒子“一水两气七字沉淀”生成水:H+OH-H2O H+O2-H2O 生成气体:H+CO32-CO2+H2O NH4+OH-NH3+H2O生成沉淀:七字沉淀“一蓝一红褐五白” Cu2+OH-Cu(OH)2(蓝色) Fe3+OH-Fe(OH)3(红褐色) Mg2+OH-Mg(OH)2(白色) Ba2+CO32-BaCO3(白色) Ca2+CO32-CaCO3(白色) Ag+Cl-AgCl(白色)Ba2+SO42-BaSO4(白色)6、表中涉及到三种挥发性酸:HNO
14、3、HCl、H2CO3应密封保存; 四种微溶物质:Ca(OH)2、Ag2SO4、CaSO4、MgCO3;“”表示三种不存在或遇水就水解的物质:AgOH、Fe2(CO3)3、Al2(CO3)3三、离子共存及常见离子检验1、 若离子之间发生离子反应,离子间便不能在溶液共存:(1)生成沉淀物:Cl-与Ag+; Ba2+ 与SO42-; OH-与Cu2+、Fe3+、Mg2+ ; CO32-与Ca2+、Ba2+等(2)生成气体:OH-与NH4+ 、H+和CO32- (3)生成水2、 此外要注意:题目要求的在酸性溶液还是碱性溶液、或者溶液是无色还是有色常见的有色离子:Fe3+黄色、Fe2+浅绿色、Cu2+蓝色、MnO4-紫色3、 常见离子的检验离子加入试剂主要实验现象H+紫色石蕊试液、较活泼金属变红色、有氢气产生OH-无色酚酞变红Cl-硝酸银溶液及稀硝酸白色沉淀SO42-硝酸钡溶液及稀硝酸白色沉淀CO32-稀盐酸和澄清石灰水产生能使澄清石灰水变浑浊的气体Cu2+NaOH溶液蓝色沉淀Fe3+NaOH溶液红褐色沉淀
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
