 武汉理工大学材料科学基础期末试卷及详细答案汇总
武汉理工大学材料科学基础期末试卷及详细答案汇总


《武汉理工大学材料科学基础期末试卷及详细答案汇总》由会员分享,可在线阅读,更多相关《武汉理工大学材料科学基础期末试卷及详细答案汇总(42页珍藏版)》请在装配图网上搜索。
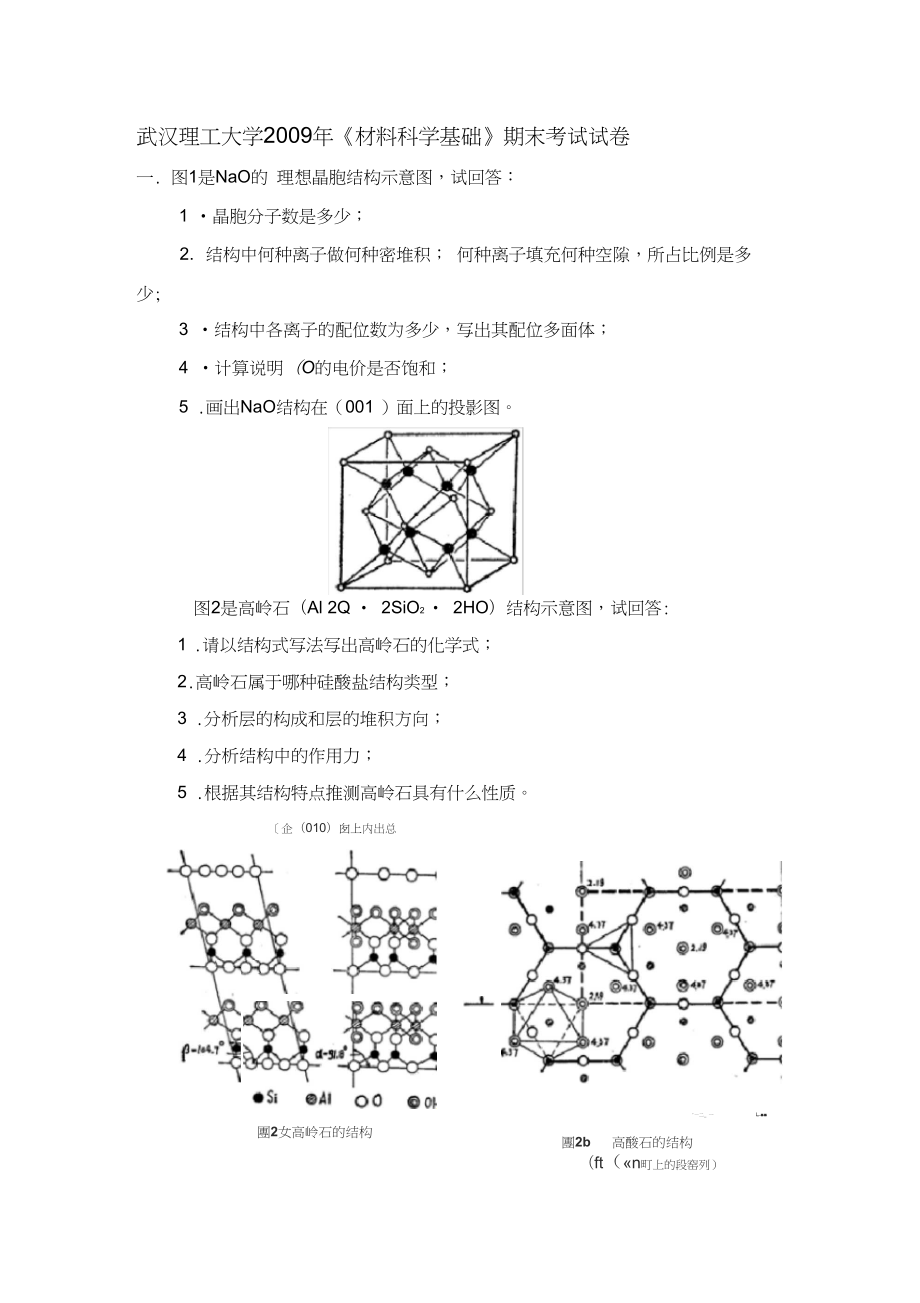
1、武汉理工大学2009年材料科学基础期末考试试卷一. 图1是NaO的 理想晶胞结构示意图,试回答:1 晶胞分子数是多少;2. 结构中何种离子做何种密堆积; 何种离子填充何种空隙,所占比例是多 少;3 结构中各离子的配位数为多少,写出其配位多面体;4 计算说明(O的电价是否饱和;5 .画出NaO结构在(001 )面上的投影图。图2是高岭石(Al 2Q 2SiO2 2HO)结构示意图,试回答:1 .请以结构式写法写出高岭石的化学式;2.高岭石属于哪种硅酸盐结构类型;3 .分析层的构成和层的堆积方向;4 .分析结构中的作用力;5 .根据其结构特点推测高岭石具有什么性质。團2女高岭石的结构企(010)囱
2、上内出总圏)二_ 一L 團2b高酸石的结构简答题:1. 晶体中的结构缺陷按几何尺寸可分为哪几类?2. 什么是负扩散?3 烧结初期的特征是什么?4. 硅酸盐晶体的分类原则是什么?5. 烧结推动力是什么?它可凭哪些方式推动物质的迁移?6. 相变的含义是什么?从热力学角度来划分,相变可以分为哪几类?四 . 出下列缺陷反应式:1. NaCl 形成肖特基缺陷;2. AgI 形成弗仑克尔缺陷( Ag+ 进入间隙);3. TiO 2掺入到 Nb2O3 中,请写出二个合理的方程,并判断可能成立的方程是 哪一种?再写出每个方程的固溶体的化学式。4. NaCl 溶入 CaCl2 中形成空位型固溶体五. 表面力的存
3、在使固体表面处于高能量状态,然而,能量愈高系统愈不 稳定,那么固体是通过何种方式降低其过剩的表面能以达到热力学稳定状态的。六. 粒径为1卩的球状AI2Q由过量的MgO微粒包围,观察尖晶石的形成, 在恒定温度下,第一个小时有 20%勺AI2Q起了反应,计算完全反应的时间: 用杨德方程计算;用金斯特林格方程计算。七. 请分析熔体结构中负离子团的堆积方式、 聚合度及对称性等与玻璃形成 之关系。八. 试从结构和能量的观点解释为什么 D晶界D晶内?九. 试分析二次再结晶过程对材料性能有何影响?工艺上如何防止或延缓 二次再结晶的发生?十.图3是A-B-C三元系统相图,根据相图回答下列问题:1 写出点P,R
4、, S的成分;2 设有2kgP,问需要多少何种成分的合金Z才可混熔成6kg成分为R的 合金。十一.图4是A-B-C三元系统相图,根据相图回答下列问题:1 在图上划分副三角形、用箭头表示各条线上温度下降方向及界线的性 质;2 判断化合物D F的性质;3写出各三元无变量点的性质及其对应的平衡关系式;4写出组成点G在完全平衡条件下的冷却结晶过程;5写出组成点H在完全平衡条件下的冷却结晶过程,写出当液相组成点 刚刚到达E4点和结晶结束时各物质的百分含量(用线段比表示)。参考答案一、1: 4;2 : 8离子做面心立方密堆积,N6填全部四面体空隙;3 :=4CN 6-=8 NaO4ONa8;4 : (O电
5、价饱和,因为(O的电价=(Na的电价/Na+的配位数)X0 2的配 位数;5 :二、1: AhSi 4Oo(OH)8;2:单网层状结构;3 :一层硅氧层一层水铝石层且沿 C轴方向堆积;4:层内是共价键,层间是氢键;5:片状微晶解理。三、1:点缺陷,线缺陷,面缺陷;2:由低浓度向高浓度的扩散;3:坯体间颗粒重排,接触处产生键合,大气孔消失,但固-气总表面 积变化不大;4:按硅氧比值分类或按硅氧聚和体的大小分类;5:表面能的降低,流动传质、扩散传质、气相传质和溶解-沉淀传质;6:随自由能的变化而发生的相的结构的变化,一级相变、二级相变 和三级相变。四、1 : O-VNa +VCI 2 : AgAA
6、gi +VAg3 : 3TiO21 3Ti Nb- +VNb- +6O2Ti21 2Ti Nb- +O+3QNbxTi 3xO 可能成立 Nb-2xTi 2xQ+x4 : NaCIMlNaCa +CICI+VCI 五、一是通过表面质点的极化、变形、重排来降低表面能,二是通过吸附 来降低表面能。一 1 2 2六、根据WG) -?=M 和 l-G-(kG)-k4 来计算$331: t=195h2: t=68h七、当O/Si由2-4时,熔体中负离子团的堆积形式由三维架状转化为孤 立的岛状,负离子团的聚合度相应的降至最低。 一般情况下,熔体中负离子团的 聚合度越高,特别是形成三维架状的空间网络时, 这
7、些大的聚合离子团位移、转 动、重排都比较困难,故质点不易调整成规则排列的晶体结构,易形成玻璃。熔 体中负离子团的对称性越好,转变成晶体越容易,则形成玻璃愈难,反之亦然。八、晶界上质点排列结构不同于内部,较晶体内疏松,原子排列混乱,存 在着许多空位、位错、键变形等缺陷,使之处于应力畸变状态,具有较高能量, 质点在晶界迁移所需活化能较晶内为小,扩散系数为大。九、二次再结晶出现后,由于个别晶粒异常长大,使气孔不能排除,坯体 不在致密,加之大晶粒的晶界上有应力存在,使其内部易出现隐裂纹,继续烧结 时坯体易膨胀而开裂,使烧结体的机械、电学性能下降。工艺上常采用引入适当 的添加剂,以减缓晶界的移动速度,使
8、气孔及时沿晶界排除,从而防止或延缓二 次再结晶的发生。十、PRSZ3 A20104553 B106045853 C70301010卜一、略武汉理工大学2010年材料科学基础期末考试试卷一、(1) (12分)根据CaTiQ晶胞图(见图1)回答下列问题:1. 晶面BCGF DEG勺晶面指数;晶向DF HA的晶向指数。2. 结构中各离子的配位数为多少,写出其配位多面体;3. 晶胞分子数是多少?何种离子添何种空隙,空隙利用率是多少?24. 结构中是否存在TiOa-离子,为什么?(2) (11分)图2是镁橄榄石(Mg2SiO4)结构示意图,试回答:1 镁橄榄石属于哪种硅酸盐结构类型;2 计算说明CT的电
9、价是否饱和;3结构中有几种配位多而体,各配位多面体间的连接方式怎样4 镁橄榄石是否容易形成玻璃,为什么?(d )图1图2二、(10分)写出下列缺陷反应式:1. NaCI形成肖脱基缺陷。2. AgI形成弗伦克尔缺陷(Ag+进入间隙)3. TQ2掺入到NbO中,请写出二个合理的方程,写出固溶体的化学式, 并判断可能成立的方程是哪一种?三、(10分)判断下列叙述是否正确?若不正确,请改正。1. Na2O-SiO2系统中随SiO2含量的增加,熔体的粘度将降低。2. 扩散的推动力是浓度梯度,所有扩散系统中,物质都是由高浓度处向低浓度处扩散3. 晶粒正常长大是小晶粒吞食大晶粒,反常长大是大晶粒吞食小晶粒。
10、4. 固溶体是在固态条件下,一种物质以原子尺寸溶解在另一种物质中形 成的单相均匀的固体。5. 在热力学平衡条件下,二兀凝聚系统最多可以 3相平衡共存,它们是一个固相、一个液相和一个气相四、(6分)什么叫弛豫表面? NaCI单晶表面具有什么样的结构特点?五、(6分)巳知Zn2+和62+在尖晶石ZnCrQ中的自扩散系数与温度的关 系分别为鬲丿不os 二x 1。exp(8.5xl0-i escp(-338904x4.18J/mo;RT1. 试求1403K时Zn2 62+在尖晶石ZnCrQ中的扩散系数2. 将细铂丝涂在两种氧化物ZnQ和 CwQ的分界线上,然后将这些压制 成型的样品进行扩散退火。(标记
11、物铂丝非常细,不影响离子在不同氧化物之间 的扩散)。根据所得数据判断铂丝将向哪一方向移动?六、(6分)为什么在成核一生成机理相变中,要有一点过冷或过热才能 发生相变?什么情况下需过冷,什么情况下需过热,各举一个例子。七、(6分)粒径为1卩球状AI2Q由过量的MgQ微粒包围,观察尖晶石 的形成,在恒定温度下,第一个小时有 20%勺AI2Q3起了反应,分别用扬德方程、 金斯特林格方程计算完全反应的时间,对计算结果进行比较并说明为什么?八、(6分)陶瓷材料中晶粒的大小与什么有关?工艺上如何控制晶粒尺 寸(请列出三种途径)?九、(26分)图3是A-B-C三元系统相图,根据相图回答下列问题:1 在图上划
12、分副三角形、用箭头表示各条界线上温度下降方向及界线的 性质;2 判断化合物D M的性质;3写出各三元无变量点的性质及其对应的平衡关系式;4写出组成点G在完全平衡条件下的冷却结晶过程;5写出组成点H在完全平衡条件下进行加热时,开始出现液相的温度和完全熔融的温度;写出完全平衡条件下进行冷却,结晶结束时各物质的百分含量(用线段比表示)参考答案一、(1)1、( 010)( 111) 111101; (4 分)N CN说戸G CNhT12: (TiOJ pCa+TiJCaO1;:门分)3、1; Ti4+添八面体空隙,八面体空隙利用率 1/4,四八面体空隙全;(3分)4、 否,因为Ti4+和O2-间没有明
13、显的共价键成分。(2分)(2)1、岛状结构;(1分);2、&与一个SiO 4、三个MgCM 配位:4/4 X 1+2/6X 3=2= O2-的 电价,O?的电价(2分);3、结构中有两种配位多面体SiO4、MgO (2分);SiO。呈孤立 的岛状,中间被MgQ隔开,SiO4与MgOj之间共顶或共棱连接,同层的MgQ 之间共棱、不同层的MgQ之间共顶连接;(4分)4、不易,因为镁橄榄石的Si/O=1/4,最低,网络连接程度弱,结 构中络阴离子团尺寸小,迁移阻力小,熔体的粘度低,冷却过程中结构调整速率 很快。(2分)二、写出下列缺陷反应式(10):1、O?VNa +VCI 2、AgAgfAAi+V
14、g3、 3TiO21 3Ti Nb- +W+6O 2TiO 2 2Ti +O+3ONbxTi 3xQ 可能成立 Nb-2xTi 2xQ+x三、1. (2分)粘度增加;2. (2分)扩散也可以从低浓度向高浓度进行;3. (2分)都是晶界移动的结果。正常长大是晶粒平均尺寸增加,反常长大是个别大晶粒尺寸异常增加。4. (2分)正确5. (2分)两个固相和一个液相四、 表面上的原子产生相对于正常位置的上、下位移,称为表面弛豫。(2NaCI单晶中处于表面层的负离子只受到上下和内侧正离子的作用,而外 侧是不饱和的。电子云将被拉向内侧的正离子一方而变形, 使该负离子诱导成偶 极子。这样就降低了晶体表面的负电
15、场。 接着,表面层离子开始重排以使之在能 量上趋于稳定。为此,表面的负离子被推向外侧,正离子被拉向内侧从而形成了 表面双电层。(4分)五、D 血施 = 6xlO-3 exp(-357732 X4 18J/J) = 1.12xlO5%a/s(2分)%窗二8.5x1尸两(-警理/型竺)二1.37x1严如(2分)因为- - :- 1 - - 1,所以铂丝向Cr2O方向移动。(2分)六、由热力学可知,在等温、等压下有 1一一 2.在平衡条件下,I,则有-*1 -式中:T 0是相变的平衡温度;一匚为相变热。若在任意温度的不平衡条件下,则有丄-丄::若-与二不随温度而变化,将上式代入上式得:hG = hH
16、-ThH!T. = LH= A/ 可见,相变过程要自发进行,必须有 I,则 1 0(1)若相变过程放热(如凝聚、结晶等) IV -1。要使二 I,必须有二I,I 二丄,即二S ,这表明系统必须 “过冷”。 若相变过程吸热(如蒸发、熔融等)二:I,要满足丄这一条件 则必须 二,即丄,这表明系统要自发相变则必须“过热”。1/32t七、扬德方程1 (1 G =K4t=194.6h(2 分)金斯特林格方程 1 2/3G( 1-G) 2/3=K6tt=68.1t=68.1(2 分)扬德方程假设反应过程中扩散截面不变,而金斯特林格方程考虑了反应中 扩散截面的变化。随反应的进行,反应物体积减小,扩散截面变小
17、,所需反应时间要比扬德假设所计算出的时间短。(2分)八、陶瓷材料中晶粒的大小与物料的原始粒度、烧结温度和时间等因素有关;(3分)控制晶粒尺寸方法:控制原始粒度均匀细小,控制烧结温度和时间,添加剂等。(3分)九、1、见图,付三角形3分,界线性质1分,界线上温度降低的方向4.5分;D, 致熔融二元化合物,高温稳定、低温分解;(1.5分)M,不一致熔融三元化合物;(1分)3、(4 分)E1,单转熔点,工4、(6 分)E2,E3,E4,低共熔点,单转熔点,过渡点,八晶结束)u 1 -丄 1 -1 -I 1 (产物 C+B+M5、E2温度(1分),H点所在温度(1分);过H点做副三角形BCM 的两条边C
18、M BM的平行线HH、HH,C%=B/BCX 100% B%=GHBCX 100% C%=tH2/BCX 100% ( 3 分)。HlE1 H鹫D2武汉理工大学2011年材料科学基础期末考试试卷一、根据CaTiQ晶胞图(见图1)回答下列问题(18):1、晶面BCGF HAC的晶面指数;晶向DF AH的晶向指数。2、结构中各离子的配位数为多少,写出其配位多面体;3、晶胞分子数是多少?何种离子添何种空隙,空隙利用率是多少?4、计算说明O-的电价是否饱和;5、结构中是否存在TiO32-离子,为什么?图1二、下列硅酸盐矿物各属何种结构类型(6):r-Ca 2Si0 4,KAISi 3Q,CaMgSi2
19、Q,MgSi 4Oo(OH) 2, Ca2AIAISiO 7,Ca2MgSi 4O1 ( OH 2、三、1、写出下列缺陷反应式(10):(1)CaCI 2溶人NaC1中形成空位型固溶体,并写出固溶体的化学式;(2)NaCI形成肖脱基缺陷。2、为什么间隙型固溶体不能形成无限固溶体?四、硅酸盐熔体的结构特征是什么?从 NqO-SiO系统出发,随引入 RQ量的增加,系统的粘度如何变化,为什么? (10)五、固体是如何降低系统的表面能的,为什么相同组成的固体的表面能总 是高于液体的表面能?( 8)六、假定碳在a Fe(体心立方)和丫 一Fe (面心立方)中进行扩散,碳在a Fe中的D0和扩散活化能为
20、0.0079、83600J/mol,碳在丫一Fe中的D0和扩散活化能为0.21和141284J/moI,计算800C时各自的扩散系数并解释其差别6)七、为什么在成核一生成机理相变中, 要有一点过冷或过热才能发生相变 ? 什么情况下需过冷,什么情况下需过热,试证明之。( 6)八、如果要合成镁铝尖晶石,可供选择的原料为 Mg(0H2、MgQ 丫 -Al 2Q、a -Al 2Q,从提高反应速率的角度出发,选择什么原料较好?请说明原因。(6)九、下列过程中哪一个能使烧结体强度增大, 而不产生坯体宏观上的收缩 ? ( 6 分)(a) 蒸发冷凝、 (b) 体积扩散、 (c) 粘性流动、 (d) 表面扩散、
21、 (e) 溶解 沉淀十、 图 2 是 A-B-C 三元系统相图,根据相图回答下列问题( 24): 1在图上划分副三角形、用箭头表示各条界线上温度下降方向及界线的 性质;2判断化合物Si、S2、S的性质; 3写出各三元无变量点的性质及其对应的平衡关系式; 4写出组成点G在完全平衡条件下的冷却结晶过程;5写出组成为H的混合物在完全平衡条件下进行加热时,开始出现液相 的温度和完全熔融的温度;写出组成H的混合物在完全平衡条件下进行冷却,结 晶结束时各物质的百分含量(用线段比表示)。图2参考答案一、1 (100)(111) 111 0-11 各 1 分2 CNT4+=6 T iO6 CNca2+=12
22、CaO CNo2-=6 OTi 2Ca各 1 分3 Z=1(1分)T i4+ (1分)占据1/4八面体空隙(1分)4 因为:Z+=2/12*4+4/6*2=2=Z -所以:饱和(3 分)5不存在,因为是复合氧化合物。(2分)二、 岛状、架状、链状、层状、组群状、链状各1分三、(1)CaCb 逛口+2ClCi+CaNa (2 分)NaGxCaCI (1 分)(2)OM +VCl (2 分)(3)是因为晶体中的间隙位置有限,二是因为间隙质点超过一定的限度会不破坏晶体结构的稳定性。四、SiOR为基本结构单元,四面体组成形状不规则大小不同的聚合力子团,络 阴离子团之间依靠金属离子连接。(4分);从Na
23、O-SiO2系统出发,随引入BO3量的增加,BO3与游离氧结合,转变 为BO4,使断裂的网络重新连接,系统粘度增加(3分);继续引入B2O, BO以层状或链状的BQ存在,系统的粘度降低(3分)。五、 固体表面通过表面质点的极化、变形、重排降低固体的表面能(3分);液体分子可自由移动,通过形成球形表面来降低表面能(2分);固体质点不能自由移动,只能通过表面质点的极化、变形、重排降低表面能, 因此表面能总是高于同组成的液体的表面能(3分)。六、由公式 D=Dexp(-Q/RT) ;(1 分)计算 D =6.72*10-7 ;(1 分)D y=2.7*10(1分);DaDr ;( 1分)因为体心结构
24、较面心结构疏松(2分)。七、由热力学可知,在等温、等压下有工匚在平衡条件下,,=o,则有 从:丄上式中:T 0是相变的平衡温度;为相变热。若在任意温度T的不平衡条件下,则有山:旦匕以7若 与;不随温度而变化,将上式代入上式得:AT可见,相变过程要自发进行,必须有 0,则士心订0。(3) 若相变过程放热(如凝聚、结晶等)0。要使 0, 口丁丁亍:,即卩TT,这表明系统必须“过冷”。(4) 若相变过程吸热(如蒸发、熔融等) 0,要满足 0这一条件则 必须;0,即TcTiO2MgO5. 烧结初期、烧结中期和烧结后期,再结晶和晶粒长大。6. 是,固体质点不能自由移动。7. 在垂直于表面的方向上原子间距
25、不同于该方向上晶格内部原子间距的表面, 驰豫表面。8. 相界面上的化学反应和反应物通过产物层的扩散,相界面上的化学反应速率 远小于反应物通过产物层的扩散速率。9. 镁橄榄石辉石长石。10. 垂直平行。二、(10 分)解: D=D exp(-Q/RT) 2 分T=563+273=836K寸,142D=3X 10- cm/s 2 分T=450+273=723K寸,D=1.0X 10-14cn1/s 2 分代入上式可求Q=48875J, Db=0.34 X 10-11cm/s 2 分(2) D=Doexp(- Q/RT) =1.1 X 10-14 cni/s 2 分三、(10分)解:(1)有两种配位
26、多面体,SiOR , MgQ,同层的MgQ八面 体共棱,如59MgQ和49MgQ共棱75O-和27O-,不同层的MgQ八面体共顶, 如1MgQ和51MgQ共顶是22O-,同层的MgQ与SiQR共顶,如TMgQ和 7SiQ 4共顶 22Q-,不同层的MgQ与SiQ。共棱,TMgQ和 43SiQ4共 28Q-和 28Q-; 2.5 分与3个唧和1个【S10J配位*(3)z=4(2.5 分);(4)Si4+占四面体空隙=1/8 , Mg+占八面体空隙=1/2。( 2.5 分)四、1、: G=;皿+ (To- = 0.15 J/cm已知:AG v= 3.6 X 10J/cm3;沈疋山=8.33 X 1
27、08cm (5 分)2、2(8.33x10(Ci.361xio-7px4= 206(5 分)五、1.如右图,I表示核化速率,u表示晶化速率(5分);2.在阴影部分以外的温度对形成玻璃有利, 因为此时核化速率与晶化速(2 分)2)几、(1 分)2 体心立方点阵的晶胞结构图(2分),(112)晶面和 1晶向(各1.5分)。3 选择Mg(OH2、丫 -AI2Q;因为反应活性高,结构不稳定。(3+2)七、1、见图;(6分)2、G, 致熔融二元化合物;F,不一致熔融二元化合物;H,不一致熔融三元化合物 (3分)Ei,单转熔点, E2,低共熔点,巳,低共熔点,E4,单转熔点,巳,单转熔点,E6,多晶转变点
28、,(结晶结束)(B消失)(4分)S: BTBTEtBtFTFtZM、(产物 a+f+h ( 2 分)5、E2温度,M点所在温度;过M点做副三角形CGH勺两条边 GH GC的平行线 MX、MY, C%=YH/HC100%H%=CX/HC100% G%=XY/HC100%( 4 分)c武汉理工大学 2013 年材料科学基础期末考试试卷一、填空题(1 10=1(分)1 、密排六方结构(等径球堆积)单位晶胞中分子数是(),配位数是( )。2、 Fick 扩散第二定律的一维表达式为()。3、当晶核剂和晶核具有()时,对核化最有利。4、广义材料腐蚀是指材料由于()而引起的破坏和变质过程。5、烧结中后期所伴
29、随的( )等,决定了材料显微结构的形 成,也决定了材料最终的性质或性能。6、固态物质的反应活性通常(),当反应物之一存在多晶转变时则转变温度通常也是( )。7、从熔融态向玻璃态转化的过程是可逆的和渐变的, 是在( ) 范围内完成,无固定熔点。8、刃位错的柏氏矢量与位错线呈()关系。二、晶体结构 -性质关系( 20分)1 、根据下图的萤石结构图回答下列问题( 14 分):1 )指出萤石结构中正负离子的堆积方式(两种方式);2)写出结构中正负离子的配位数及其配位多面体;3)Ca2+离子的配位多面体之间是如何连接的?4)在结构图中用和标示相互平行的同号离子层,分析萤石晶体的解理 性。2、根据Si/O
30、比例不同划分硅酸盐晶体结构类型。(6分)三、晶体结构缺陷(10分)1、晶体A属于体心立方空间点阵,若原子 B溶入A晶格的顶点位置形成置换型固溶体(全部取代),那么其成分可能是AB还是AB3?为什么? (4分)2、A12O3掺入到MgC中,请写出二个合理的方程,并写出对应的固溶体化 学式(6分)。四、从熔体结构角度,估计长石、辉石(MgO SiO2)、镁橄榄石三种矿物的 高温熔体表面张力大小顺序,并分析它们形成玻璃的能力。(10分)五、1、氧化铝瓷件表面上涂银后,烧到 1000C时,巳知丫 (A12O3, 固)=1J/m2; 丫 (Ag,液)=0.92J/m2 ; 丫 (Ag,液/A12O3,固
31、)=1.77 J/m2,试问液态银能否润湿氧化铝瓷件表面?可以用什么方法改善它们之间的润湿性?请提出一种最有可能实现的措施。(6分)2、根据威尔的表面双电层理论,某些化合物表面可能由负离子组成,正离子被负离子所屏蔽。已知 Pbl2的表面能为1.3 X 10- 5J/cm2, CaF2的表面能为2.5 x 10- 4J/cm2,请判断Pbl2和CaF2的表面双电层厚度的大小,并解释产生的原因。(4分)六、已知铜的熔点 Tm= 1083C,熔化热厶H 1628J/cm3,固液界面能 丫 =1.77 x 10- 5J/cm2,铜为面心立方晶体,点阵常数 a = 0.3615nm( 10分)1、当液态
32、金属铜过冷至853C进行均态形核时,求临界晶核半径和每个临界晶核的原子数(设晶核为球形)。2、若为非均态形核,求临界球冠的原子数。(设形成球冠的高度为h = 0.2R,球冠体积,R为球冠半径)七、 经过计算可知1000C下氢在面心立方铁中的扩散系数为-=1.08 x 104cm2/s,同等条件下镍在面心立方铁中的扩散系数为 二:=4.27 x 10- 11cm2/s,=,请对这种差别进行解释。(5分)八、实验室要合成镁铝尖晶石,可供选择的原料为MgCO3MgO a - AI2O3、丫 AI2O3。从提高反应速率的角度出发,选择什么原料较好?请说明原因。(5分)九、如图A-B-C三元系统相图,根
33、据相图回答下列问题(20分):1、在图上划分副三角形、用箭头表示各条界线上温度下降方向及界线的性质;2、判断化合物D的性质;3、写出各三元无变量点的性质及其对应的平衡关系式;4、写出组成点M1在完全平衡条件下的冷却结晶过程, 结晶结束时各物质的百分含量(用线段比表示);M2熔体的液相组的反应哪个晶相先消5、写出组成点M2在完全平衡条件下的冷却结晶过程,在 成点刚刚到达J1时,求其相组成(用线段比表示)。在J1 失,为什么?参考答案、填空题(1 10=10分)1.612 。2.jc;:t八。:x3.4.5.6.结构相同或相似,或具有相似的原子排列,或接触角为 环境的作用。晶粒长大和再结晶。较低,
34、速度较慢;反应开始明显进行的温度或较高。或接触角较小。7. 一定的温度。8. 垂直。二、晶体结构分析(20分)1)2)1、3)4)Ca2+面心立方堆积,简单立方堆积;(4分)钙的配位数为8,CaF8立方体;F的配位数为4,FCa4 四面体;(4分)CaF8立方体之间共棱(共用2个顶点)连接;(2 分) 见图(1分),平行(111)面存在同号离子层,外力 作用下沿平行(111)面方向有解理现象(3分)。Si/O=4/10,层状结构;Si/0=4/11,2、Si/O=1/2,架状结构; 双链结构;Si/O=2/6 , 体)结构;Si/O=2/7 , 组群状(环状)结构;单链结构;Si/O=2/7,
35、组群状(双四面 组群状(双四面体)结构; Si/O=1/3,Si/O=1/4,岛状结构;(6分)三、晶体结构缺陷(10分)1、都不对(2分)。若B进入顶点位置,则形成固溶体化学式为 A8 Bx,简化后得A(16) Bx,(8代8x取1到8的整数,全部取代顶点位置的质点,得AB(4分)2、间隙型固溶体:Ag 2AI;g 20。Oi(2 分)Al 2xMg1-2xO1 + x 或 Al2xMg2-2x02+x (1 分)置换型固溶体:MgOAg 2AlMg300 皿(2 分)Al2xMg3xO 或 Al 2xMg 3-3x03(1 分)四、(10分)长石 辉石(MgO- SiO 2)镁橄榄石(2分
36、)长石辉石 (MgO 2)SK镁橄榄石(2分)| 理由:从长石、辉石(MgO- SiO 2)到镁橄榄石,熔体结构从架状、链状到岛状,络阴 离子团尺寸减小,作用力矩减小,因此表面张力增大; 同理,长石熔体具有架状结构, 氧硅比2,网络连接程度好,冷却过程中不易规则排列而容易形成玻璃,镁橄榄石具 有岛状,氧硅比 4,硅氧四面体孤立存在,冷却过程中易规则排列而最不容易形成玻 璃,辉石形成玻璃的能力居中。(6分)yy(AI2O3,固)一 (Ag,液 /Al 2O3,固)五(10 分)、1、cos0.837 : 0(2 分)y(Ag,液)接解角大于90,所以液态银不能润温氧化铝瓷件表面(2分)最有可能实
37、现的措施:在液态银中加入表面活性剂,降低YAg,液/ AI2O3,固),可使其润湿。(2分)2、Pbl2 CaF2(2分)。与Ca2+和L相比,Pb2+与具有较大的极化性能,因此表面双电层的厚度较厚(2分)。六、(10分)1、Tm = 1083C= 1356K1 分 T = 1356-( 853+ 273)= 230K1 分r*2 Tm.H . T2 1.77 1013561628x230= 1.28 10 cm4347 3r *3(1.28 10)333n 二 3_3 4 = 34 二 744(个)2 分a(0.3615X0 )2、R* = r* = 1.28 X 10-7cm1分h = 0
38、.2R*=0. 2 X 1.28 X 10-7=0.256 X 10-7cm 1 分: h2V3R*3_Z 2二(0.256 10 )3(3 1.28 10-0.256 10)=0.24 103cm0.24 10 (0.3615 10)3-20(个)七、(5分)固溶体类型不同,扩散机制不同,导致扩散系数差别很大。1分氢在面心立方铁中形成间隙固溶体,按间隙扩散机制进行扩散,其扩散活化能比较小,故扩散系 数大;2分而镍在面心立方铁中形成置换固溶体,按空位扩散机制进行扩散,其扩散活化能比较大,故扩散系数小。2分或答原子半径小,在相同的扩散基质中进行扩散,阻力小,活化能低,扩散系数大。(5分)八、(5
39、分)选择MgCO 3、y - Al 2O3较好。3分MgCO3在加热到350C400C分解为MgO和CO?,具有比较高的反应活性; 1分Y - Al 2O3在加热到950 C时转变为a - Al 2O3,由于发生晶格重排,会使晶格活化,具 有比较高的反应活性。1分九、(20分)1. 见图。三个副三角形,各 0.5分,计1.5分;温降箭头和性质各0.5分,计3分。 合计4.5分;2. 不一致熔融二元、低温稳定高温分解的化合物,各0.5分,合计1.5分;3. E:三元低共熔点 L C B DJ仁过渡点 A + B DJ2:单转熔点L A= C DM1 L a L A b L D 4.At At Dt Dt dT M1各1分,合计3 分;c JE LBJE(液相消失,结晶结束,产物 C+B+D ), 3 分。B%=xy/CD, C%=yD/CD, B%=Cx/CD , 1.5 分。合计4.5分5.M2 L r e W1 AL D:;B(液A = A 丿 f f 丿 g = M 2相消失,结晶结束,产物C+B+D ), 3分。L%=fM 2/f J1, A%= J1M2/f J 1*Bf/AB, B%=J1M2/f J1*Af/AB , 1.5分。A先消失,因为此时系统中 A与B的比小于化合物 D中 A与B的比,2分。合计6.5分。
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
