 物质结构元素周期律知识点总结
物质结构元素周期律知识点总结


《物质结构元素周期律知识点总结》由会员分享,可在线阅读,更多相关《物质结构元素周期律知识点总结(5页珍藏版)》请在装配图网上搜索。
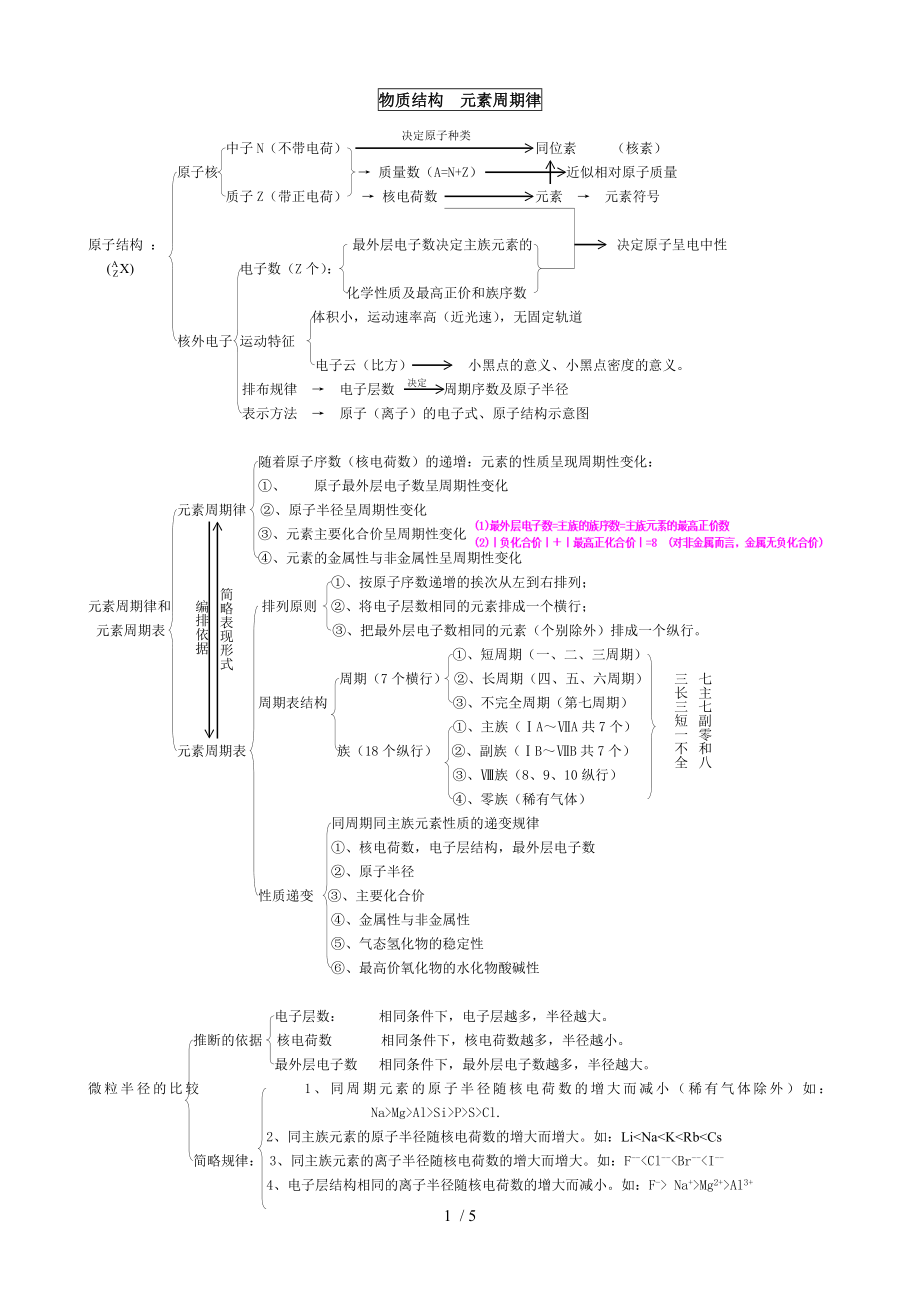
1、物质结构 元素周期律决定原子种类中子N(不带电荷) 同位素 (核素)原子核 质量数(A=N+Z) 近似相对原子质量质子Z(带正电荷) 核电荷数 元素 元素符号原子结构 : 最外层电子数决定主族元素的 决定原子呈电中性电子数(Z个):化学性质及最高正价和族序数 体积小,运动速率高(近光速),无固定轨道核外电子 运动特征决定电子云(比方) 小黑点的意义、小黑点密度的意义。排布规律 电子层数 周期序数及原子半径表示方法 原子(离子)的电子式、原子结构示意图随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化:、 原子最外层电子数呈周期性变化元素周期律 、原子半径呈周期性变化、元素主要化合价呈周期
2、性变化、元素的金属性与非金属性呈周期性变化简略表现形式、按原子序数递增的挨次从左到右排列;编排依据元素周期律和 排列原则 、将电子层数相同的元素排成一个横行;元素周期表 、把最外层电子数相同的元素(个别除外)排成一个纵行。、短周期(一、二、三周期)七主七副零和八三长三短一不全周期(7个横行) 、长周期(四、五、六周期)周期表结构 、不完全周期(第七周期)、主族(AA共7个)元素周期表 族(18个纵行) 、副族(BB共7个)、族(8、9、10纵行)、零族(稀有气体)同周期同主族元素性质的递变规律、核电荷数,电子层结构,最外层电子数、原子半径性质递变 、主要化合价、金属性与非金属性、气态氢化物的稳
3、定性、最高价氧化物的水化物酸碱性电子层数: 相同条件下,电子层越多,半径越大。推断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。最外层电子数 相同条件下,最外层电子数越多,半径越大。微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:NaMgAlSiPSCl.2、同主族元素的原子半径随核电荷数的增大而增大。如:LiNaKRbCs简略规律: 3、同主族元素的离子半径随核电荷数的增大而增大。如:F-Cl-Br- Na+Mg2+Al3+5、同一元素不同价态的微粒半径,价态越高离子半径越小。如FeFe2+Fe3+与水反应置换氢的难易 最高价氧化物的水化物碱性强弱金
4、属性强弱 单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)相互置换反应依据: 原电池反应中正负极与H2化合的难易及氢化物的稳定性元素的 非金属性强弱 最高价氧化物的水化物酸性强弱金属性或非金属 单质的氧化性或离子的还原性性强弱的推断 相互置换反应、同周期元素的金属性,随荷电荷数的增加而减小,如:NaMgAl;非金属性,随荷电荷数的增加而增大,如:SiPSCl。规律: 、同主族元素的金属性,随荷电荷数的增加而增大,如:LiNaKRbClBrI。、金属活动性挨次表:KCaMgAlZnFeSnPb(H)CuHgAgPtAu定义:核电荷数相同,中子数不同的核素,互称为同位素。(即:同种元素的不
5、同原子或核素)同位素 、结构上,质子数相同而中子数不同;特点: 、性质上,化学性质几乎完全相同,只是某些物理性质略有不同;、存在上,在天然存在的某种元素里,不论是游离态还是化合态,同位素的原子(个数不是质量)百分含量一般是不变的(即丰度肯定)。1、定义:相邻的两个或多个原子之间强烈的相互作用。离子键、定义:阴阳离子间通过静电作用所形成的化学键、存在:离子化合物(NaCl、NaOH、Na2O2等);离子晶体。、定义:原子间通过共用电子对所形成的化学键。不同原子间、存在:共价化合物,非金属单质、离子化合物中(如:NaOH、Na2O2);共价键 分子、原子、离子晶体。分子的极性共用电子对是否偏移存在
6、2、分类 极性键 共价化合物化学键 非极性键 非金属单质相同原子间、分类:(孤对电子)双方供应:共价键共用电子对的来源单方供应:配位键 如:NH4+、H3O+金属键:金属阳离子与自由电子之间的相互作用。存在于金属单质、金属晶体中。决定分子的极性分子的空间构型决定分子的稳定性键能 3、键参数 键长 键角 4、表示方式:电子式、结构式、结构简式(后两者适用于共价键)2下列叙述中能肯定说明金属A比金属B的活泼性强的是( ) AA原子最外层电子数比B原子的最外层电子数少 BA原子电子层数比B原子的电子层数多C1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多D常温时, A能从酸中置换出
7、氢,而B不能3下列递变情况中,正确的是( )ANa、Mg、Al原子的最外层电子数依次削减 BSi、P、S元素的最高正价依次降低CC、N、O的原子半径依次减小 DLi、Na、K的金属性依次减弱4.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以推断( )AR肯定是第四周期元素 BR肯定是A族元素CR的气态氢化物比同周期其他元素气态氢化物稳定 DR气态氢化物化学式为H2R5.A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n m ,则下列关系正确的是( )Aa b c B a c b Ca = b + m + n Da = c n -
8、 m6下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是( )A6和8B19和16C12和17D10和87同周期的X、Y、Z三元素,其最高价氧化物对应水化物的酸性由弱到强的挨次是:H3ZO4H2YO4HXO4,则下列推断正确的是( )A原子半径:XYZ B非金属性:XYZ C阴离子的还原性按X、Y、Z的挨次由强到弱 D气态氢化物的稳定性按X、Y、Z的挨次由弱到强8下列各组中化合物的性质比较,不正确的是( )A酸性:HClO4HBrO4HIO4 B碱性:NaOHMg(OH)2Al(OH)3C稳定性:PH3H2S HCl D非金属性:FOS9. 关于离子键、共价键的各种叙述中,下列说
9、法正确的是( )。A在离子化合物里,只存在离子键,没有共价键 B非极性键只存在于双原子的单质分子(如Cl2)中C在共价化合物分子内,肯定不存在离子键D由不同元素组成的多原子分子里,肯定只存在极性键10X元素最高氧化物对应的水化物为H2XO4,则它对应的气态氢化物为( )AHX BH2X CXH4 D XH311. 医学商量证明,用135 53I治疗肿瘤可收到肯定疗效,下列有关135 53I I叙述正确的是( )A135 53I是碘的一种同素异形体 B135 53I是一种新发现的元素C135 53I位于元素周期表中第4周期A族 D135 53I核内的中子数与核外电子数之差为2912下列物质是共价
10、化合物的是( ) AH2O2 BNH4Cl CN2 DNa2O214.具有相同电子层结构的三种微粒:、和C,下列说法正确的是( )A 原子半径: B微粒半径:C C元素不肯定是稀有气体元素 D原子序数:CBA15已知aAn、bBm-、cCm+、dDn+四种离子具有相同的核外电子排布,且nm,则下列关系中正确的是( )A得电子能力:ABCDB元素的金属性:DCABC原子半径:DCBAD离子半径:AnBm-Cm+Dn+16 . A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不行能为( )An8Bn18 Cn20Dn3217. 锶(Sr)是元素周期表中第五周期IIA族的
11、元素,下列关于锶及其化合物的说法中不正确的是( ) A. 锶能与冷水猛烈反应 B. 锶的失电子能力比钙强 C. Sr(OH)2的碱性比Ca(OH)2弱 D. 氧化锶是碱性氧化物18. 下列分子的电子式书写正确的是( )。20下列物质中既有离子键又有非极性共价键的化合物是( )AH2SO4 BNa2O2 CN2 DNaOH23. 已知五种短周期元素的原子序数的大小挨次为CABDE;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中全部离子的电子数相同,其电子总数为30;D和E可形成四核10电子分子。试回答下列问题: 写出下列元素的符号A ,B , (2) 写出D元素形成的单质的结构式 ;
12、 写出下列物质的电子式:E2B2 ; A、B两元素组成的化合物A2B2属于 (“离子”“共价”)化合物,存在的化学键是 。24.(14分) 有X、Y、Z三种元素,它们的原子序数依次增大,且位于同一周期,价电子数之和为10它们的最高价氧化物的水化物之间,任意两种都能反应生成盐和水M元素位于上述三种元素相邻的周期,而M元素原子的L电子层上有4个电子试写出:(1)X、M的元素名称:X_、M_(2)Y位于元素周期表中 (3)Z原子的原子结构示意图 。(4)X、Y、Z的最高价氧化物的水化物之间两两反应的离子方程式分别为(不按挨次) 、 、 。25、X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。
13、X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。请推断后回答下列问题:(1)Z在Y单质中燃烧的产物电子式为,其中含有的化学键类型为。(2)Y、Z、W、R形成的简洁离子半径由大到小挨次为。(3)W单质与Z的高价氧化物对应的水化物反应的离子方程式为。27有X、W、Y、Z、G五种元素,原子序数依次递增。已知X的核内无中子,X和W形成的气态化合物的水溶液呈碱性,Y与Z同主族,且形成化合物ZY2和ZY3。Y与W同周期,其中ZY2是大气污染物和形成酸雨的主要气体,G为115号元素,
14、请回答以下问题。(1)115号元素在周期表中 周期 族;(2)X与W形成的气态化合物的电子式为 (用元素符号表示);(3)由X、W、Y、Z四种元素组成的一种化合物,其原子个数比为5:1:4:1,则该化合物的化学式为 ;(4)由X、W、Y三种元素形成的化合物可能是 、 、 ;(均填写化学式)一. 选择题(每小题只有一个正确答案,每小题)题号1234567891011答案CD CDBCBCCBA题号1213141516171819202122答案AABDCCDBBBD二. 填空题(34分).H:O:.H.O:NN23. (10分,除最后一空2分其余每空一分). Na、O、 HH.:N:.离子;离子
15、键、共价键286+1624、(10分)(1)钠 铝 硫 碳 (2) 三 A (3)(4) HOH=H2O Al(OH)33H=Al33H2O Al(OH)3OH=AlO22H2O25. (3)Na+ O O 2Na+ 离子键、非极性键(4)S2O2Na+Al3+(5)2Al+2OH+2H2O=2AlO2+3H226. (1)A的化学式 Cu2(OH)2CO3 或CuCO3 ,C的电子式 D的结构式O=C=O(2)HCO3(3)3Cu8H2NO3=3Cu22NO4H2O(4)向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有Fe2存在;(5)2Fe2Cl2=2Fe32Cl。27(1) 第七 周期 VA 族;(2)(3)NH4HSO4(4)HNO3、NH3H2O、NH4NO3(其他合理也给分)(5)NH4H5 / 5
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
