 物理化学课后答案第9章电解与极化作用课件
物理化学课后答案第9章电解与极化作用课件


《物理化学课后答案第9章电解与极化作用课件》由会员分享,可在线阅读,更多相关《物理化学课后答案第9章电解与极化作用课件(37页珍藏版)》请在装配图网上搜索。
1、O返回2022-5-16O返回2022-5-169.1 分解电压9.2 极化作用9.3 电解时电极上的反应9.4 金属的电化学腐蚀与防腐9.5 化学电源O返回2022-5-16理论分解电压 使某电解质溶液能连续不断发生电解时所必须外加的最小电压,在数值上等于该电解池作为可逆电池时的可逆电动势( )()EE理论分解可逆O返回2022-5-16 使用Pt电极电解H2O,加入中性盐用来导电,实验装置如图所示。 逐渐增加外加电压,由安培计G和伏特计V分别测定线路中的电流强度I 和电压E,画出I-E曲线。电源分解电压的测定阳极阴极PtVGO返回2022-5-16 外加电压很小时,几乎无电流通过,阴、阳极
2、上无H2气和氧气放出。 随着E的增大,电极表面产生少量氢气和氧气,但压力低于大气压,无法逸出。所产生的氢气和氧气构成了原电池,外加电压必须克服这反电动势,继续增加电压,I 有少许增加,如图中1-2段。E分分解解电流I电压E123测定分解电压时的电流-电压曲线O返回2022-5-16 当外压增至2-3段,氢气和氧气的压力等于大气压力,呈气泡逸出,反电动势达极大值 Eb,max。 再增加电压,使I 迅速增加。将直线外延至I =0处,得E(分解)值,这是使电解池不断工作所必需外加的最小电压,称为分解电压。E分分解解电流I电压E123测定分解电压时的电流-电压曲线O返回2022-5-16()()()(
3、)()EEEIRE分解可逆不阳可逆不可逆阴 要使电解池顺利地进行连续反应,除了克服作为原电池时的可逆电动势外,还要克服由于极化在阴、阳极上产生的超电势 和 ,以及克服电池电阻所产生的电位降 。这三者的加和就称为实际分解电压。()阳()阴IR显然分解电压的数值会随着通入电流强度的增加而增加。O返回2022-5-16极化(polarization) 当电极上无电流通过时,电极处于平衡状态,这时的电极电势分别称为阳极平衡电势 和阴极平衡电势 。()E 阳,平()E 阴,平 在有电流通过时,随着电极上电流密度的增加,电极实际分解电势值对平衡值的偏离也愈来愈大,这种对平衡电势的偏离称为电极的极化。O返回
4、2022-5-16 根据极化产生的不同原因,通常把极化大致分为两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离子浓度由于电极反应而发生变化,本体溶液中离子扩散的速度又赶不上弥补这个变化,就导致电极附近溶液的浓度与本体溶液间有一个浓度梯度,这种浓度差别引起的电极电势的改变称为浓差极化。 用搅拌和升温的方法可以减少浓差极化,但也可以利用滴汞电极上的浓差极化进行极谱分析。O返回2022-5-16 根据极化产生的不同原因,通常把极化大致分为两类:浓差极化和电化学极化。(2)电化学极化 电极反应总是分若干步进行,若其中一步反应速率较慢,需要较高的活化能,为了使电极反应顺利进行所额
5、外施加的电压称为电化学超电势(亦称为活化超电势),这种极化现象称为电化学极化。O返回2022-5-16 在某一电流密度下,实际发生电解的电极电势 与平衡电极电势之间的差值称为超电势。()E 不可逆 为了使超电势都是正值,把阴极超电势 和阳极超电势 分别定义为: ()阴()阳 (,) (,)(,)(,() EEEE阴不可逆阳不平可逆阳阴阳阴 平 阳极上由于超电势使电极电势变大,阴极上由于超电势使电极电势变小。 ()(,)()(,),)(,EEEE阳阳不可阴阴 平阴不可阳逆逆平O返回2022-5-16 超电势或电极电势与电流密度之间的关系曲线称为极化曲线,极化曲线的形状和变化规律反映了电化学过程的
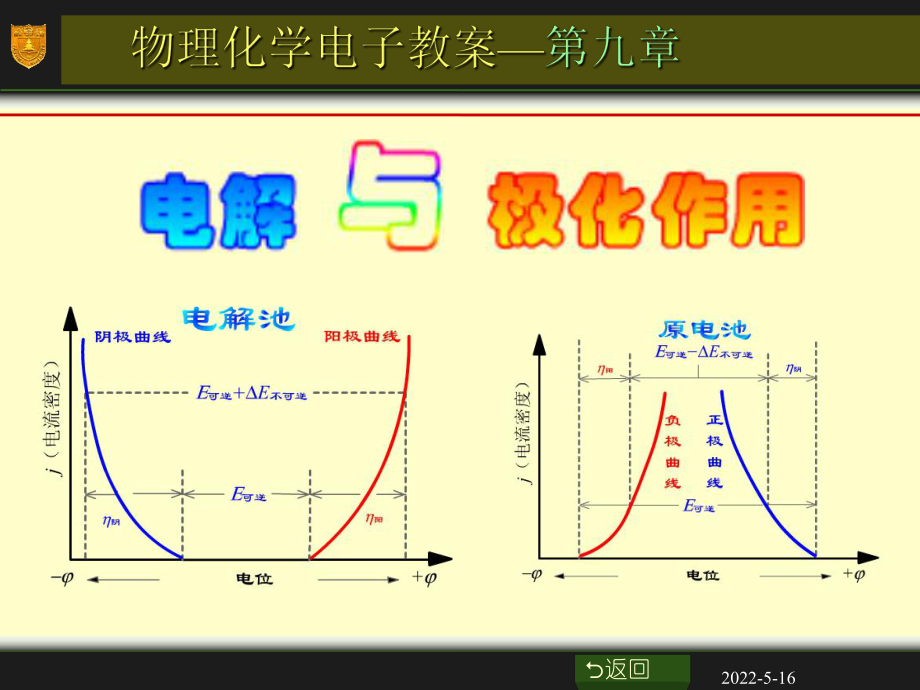
6、动力学特征。(1)电解池中两电极的极化曲线 随着电流密度的增大,两电极上的超电势也增大,阳极析出电势变大,阴极析出电势变小,使外加的电压增加,额外消耗了电能。O返回2022-5-16电解池中两电极的极化曲线E可逆可逆阴阴E可逆可逆+E不可逆不可逆阳阳阴极曲线阴极曲线阳极曲线阳极曲线j(电流密度)电位电位O返回2022-5-16(2)原电池中两电极的极化曲线 原电池中,负极是阳极,正极是阴极。随着电流密度的增加,阳极析出电势变大,阴极析出电势变小。由于极化,使原电池的作功能力下降。 但可以利用这种极化降低金属的电化腐蚀速度。O返回2022-5-16电解池中两电极的极化曲线电解池中两电极的极化曲线
7、j(电流密度)E可逆可逆E可逆可逆 - -E不可逆不可逆阴阴阳阳负极曲线正极曲线电位电位O返回2022-5-16 电解质溶液通常用水作溶剂,在电解过程中, 在阴极会与金属离子竞争还原。+H 利用氢在电极上的超电势,可以使比氢活泼的金属先在阴极析出,这在电镀工业上是很重要的。 例如,只有控制溶液的pH,利用氢气的析出有超电势,才使得镀Zn,Sn,Ni,Cr等工艺成为现实。O返回2022-5-16 金属在电极上析出时超电势很小,通常可忽略不计。而气体,特别是氢气和氧气,超电势值较大。 氢气在几种电极上的超电势如图所示。可见在石墨和汞等材料上,超电势很大,而在金属Pt,特别是镀了铂黑的铂电极上,超电
8、势很小,所以标准氢电极中的铂电极要镀上铂黑。 影响超电势的因素很多,如电极材料、电极表面状态、电流密度、温度、电解质的性质、浓度及溶液中的杂质等。O返回2022-5-16O返回2022-5-16 早在1905年,Tafel 发现,对于一些常见的电极反应,超电势与电流密度之间在一定范围内存在如下的定量关系:lnabj这就称为Tafel 公式。式中 j 是电流密度, 是单位电流密度时的超电势值,与电极材料、表面状态、溶液组成和温度等因素有关, 是超电势值的决定因素。在常温下一般等于。ab0.050 VO返回2022-5-16阴极上的反应z+z+z+M1(M |M)(M ,M)lnRTEEzFa 判
9、断在阴极上首先析出何种物质,应把可能发生还原物质的电极电势计算出来,同时考虑它的超电势。电极电势最大的首先在阴极析出。电解时阴极上发生还原反应。 发生还原的物质通常有(1)金属离子,(2)氢离子(中性水溶液中 )。+7H10a2+H+H1(H |H)lnRTEFa O返回2022-5-16阳极上的反应zzzA(A|A)(A|A)ln()RTEEazF阳 判断在阳极上首先发生什么反应,应把可能发生氧化物质的电极电势计算出来,同时要考虑它的超电势。电极电势最小的首先在阳极氧化。电解时阳极上发生氧化反应。 发生氧化的物质通常有:(1)阴离子,如 等,(2)阳极本身发生氧化。Cl ,OHO返回2022
10、-5-16(,)(,)EEE分解)阳极 析出阴极 析出分解电压 电解水溶液时,因 或 的析出,会改变 或 的浓度,计算电极电势时应把这个因素考虑进去。+H2OOH2H 确定了阳极、阴极析出的物质后,将两者的析出电势相减,就得到了实际分解电压。 因为电解池中阳极是正极,电极电势较高,所以用阳极析出电势减去阴极析出电势。O返回2022-5-16金属离子的分离 如果溶液中含有多个析出电势不同的金属离子,可以控制外加电压的大小,使金属离子分步析出而达到分离的目的。 为了使分离效果较好,后一种离子反应时,前一种离子的活度应减少到 以下,这样要求两种离子的析出电势相差一定的数值。7107 ln10RTEz
11、F 1 0.41V 2 0.21V 3 0.14VzEzEzE当O返回2022-5-16 阴极产品:电镀、金属提纯、保护、产品的美化(包括金属、塑料)和制备 及有机物的还原产物等。2H 阳极产品:铝合金的氧化和着色、制备氧气、双氧水、氯气以及有机物的氧化产物等。 常见的电解制备有氯碱工业、由丙烯腈制乙二腈、用硝基苯制苯胺等。电解的应用O返回2022-5-16金属腐蚀分两类:(1)化学腐蚀 金属表面与介质如气体或非电解质液体等因发生化学作用而引起的腐蚀,称为化学腐蚀。化学腐蚀作用进行时无电流产生。(2)电化学腐蚀 金属表面与介质如潮湿空气或电解质溶液等,因形成微电池,金属作为阳极发生氧化而使金属
12、发生腐蚀。这种由于电化学作用引起的腐蚀称为电化学腐蚀。O返回2022-5-16电化学腐蚀的例子:铜板上的铁铆钉为什么特别容易生锈? 带有铁铆钉的铜板若暴露在空气中,表面被潮湿空气或雨水浸润,空气中的和海边空气中的NaCl溶解其中,形成电解质溶液,这样组成了原电池,铜作阴极,铁作阳极,所以铁很快腐蚀形成铁锈。22CO ,SOO返回2022-5-16CuCuFe+H+H- -2e2e2H O2H O2CO2SO2O2O2+Fe电化学腐蚀示意图O返回2022-5-16铁在酸性介质中只能氧化成二价铁:2+Fe(s)Fe2e 二价铁被空气中的氧气氧化成三价铁,三价铁在水溶液中生成 沉淀, 又可能部分失水
13、生成。3Fe(OH)3Fe(OH)23Fe O 所以铁锈是一个由 等化合物组成的疏松的混杂物质。2+3+323Fe ,Fe ,Fe(OH) ,Fe OO返回2022-5-16(1)析氢腐蚀酸性介质中 在阴极上还原成氢气析出。+H2+H+22H12HeH (g) (H |H )lnaRTEFa 设 , 则+27HH1, 10aa+2(H |H )0.413 VE铁阳极氧化,当 时认为已经发生腐蚀,2+6(Fe )10a2+2+61(Fe |Fe)(Fe |Fe)ln100.617VRTEEzF这时组成原电池的电动势为,是自发电池。0.204VO返回2022-5-16 如果既有酸性介质,又有氧气存
14、在,在阴极上发生消耗氧的还原反应: 这时与 (-0.617V)阳极组成原电池的电动势为 。显然耗氧腐蚀比析氢腐蚀严重得多。2+(Fe |Fe)E1.433 V(2)耗氧腐蚀+2+27O2H 1, 10 ,(O |H O,H )0.816VaaE设则 +2+22+224OHO (g)+4H4e2H O1(O |H O,H )ln4RTEEFa a1.229 VE O返回2022-5-16(1)非金属防腐 在金属表面涂上油漆、搪瓷、塑料、沥青等,将金属与腐蚀介质隔开。(2)金属保护层 在需保护的金属表面用电镀或化学镀的方法镀上Au,Ag,Ni,Cr,Zn,Sn等金属,保护内层不被腐蚀。O返回202
15、2-5-16(3)电化学保护 1保护器保护 将被保护的金属如铁作阴极,较活泼的金属如Zn作牺牲性阳极。阳极腐蚀后定期更换。 2阴极保护 外加电源组成一个电解池,将被保护金属作阴极,废金属作阳极。3阳极保护 用外电源,将被保护金属接阳极,在一定的介质和外电压作用下,使阳极钝化。O返回2022-5-16(4)加缓蚀剂 在可能组成原电池的体系中加缓蚀剂,改变介质的性质,降低腐蚀速度。(5)制成耐蚀合金 在炼制金属时加入其它组分,提高耐蚀能力。如在炼钢时加入Mn,Cr等元素制成不锈钢。O返回2022-5-16(1)燃料电池 又称为连续电池,一般以天然燃料或其它可燃物质如氢气、甲醇、天然气、煤气等作为负
16、极的反应物质,以氧气作为正极反应物质组成燃料电池。化学电源分类(2)二次电池 又称为蓄电池。这种电池放电后可以充电,使活性物质基本复原,可以重复、多次利用。如常见的铅蓄电池和其它可充电电池等。(3)一次电池 电池中的反应物质进行一次电化学反应放电之后,就不能再次利用,如干电池。这种电池造成严重的材料浪费和环境污染。O返回2022-5-16Li离子电池的工作原理负极: 石墨,焦炭正极: 2222LiCoO , LiNiO , LiMn O + C+ LieLi C xxx充放负极反应:正极反应:+21-2LiCoOLi CoO + Li + e xxx充放21-2LiCoOCLi CoO +C Li xx充放总反应:O返回2022-5-16Li离子电池的结构示意图负极正极锂离子O返回2022-5-16Li离子电池的优点:1。通讯,如手机;Li离子电池的用途:1。重量轻(从金属壳到塑料壳),能量密度大;2。优良、安全,有防暴阀,无环境污染;3。循环寿命较长;4。成本较低。2。电子器件,电脑等;3。人造器官用电,如心脏起博器等。
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
