 研究者管理文件册目录
研究者管理文件册目录


《研究者管理文件册目录》由会员分享,可在线阅读,更多相关《研究者管理文件册目录(8页珍藏版)》请在装配图网上搜索。
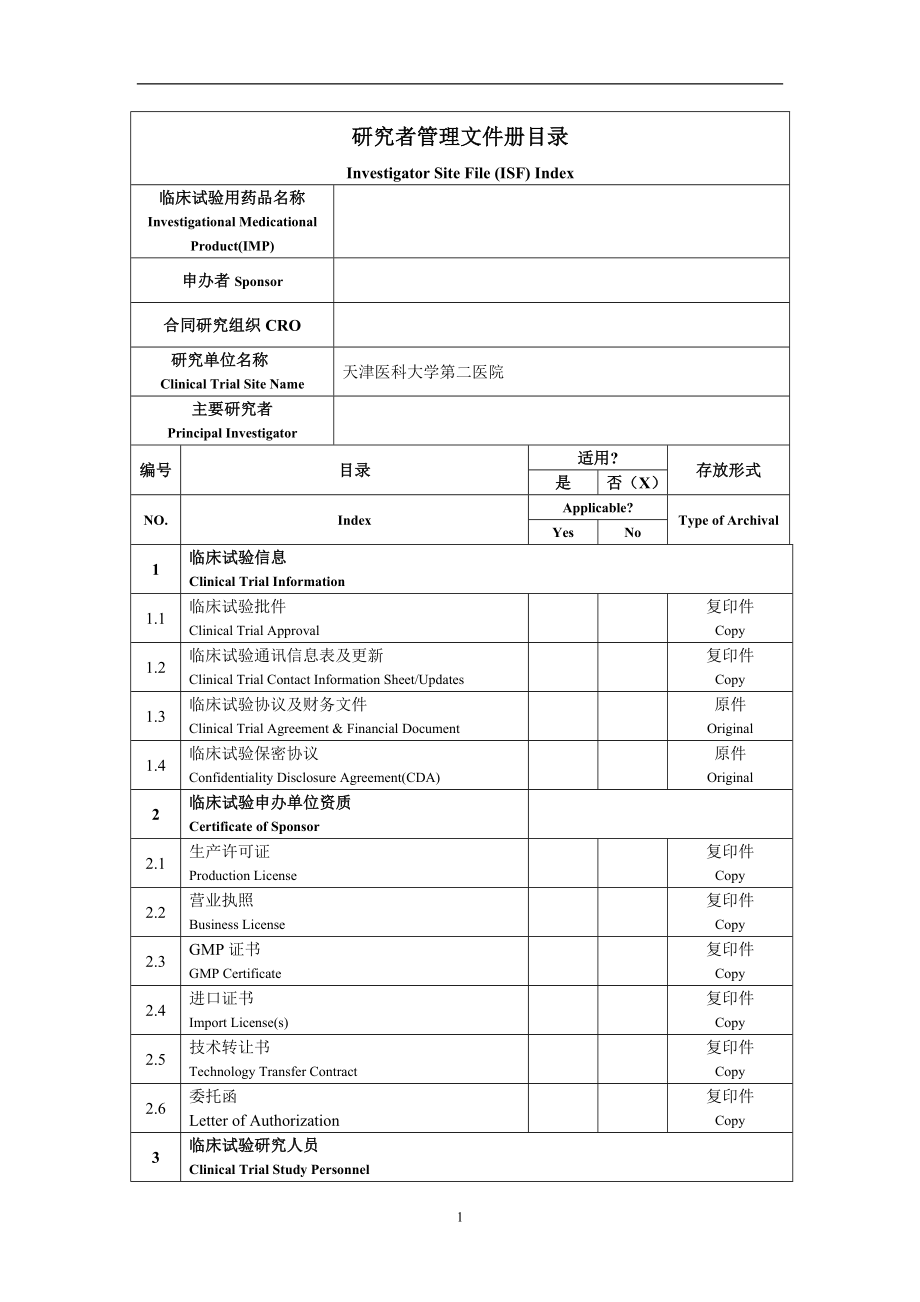
1、研究者管理文件册目录Investigator Site File (ISF) Index临床试验用药品名称Investigational Medicational Product(IMP)申办者Sponsor合同研究组织CRO研究单位名称Clinical Trial Site Name天津医科大学第二医院主要研究者Principal Investigator编号目录适用?存放形式是否(X)NO.IndexApplicable?Type of ArchivalYesNo1临床试验信息Clinical Trial Information1.1临床试验批件Clinical Trial Approva
2、l复印件Copy1.2临床试验通讯信息表及更新Clinical Trial Contact Information Sheet/Updates复印件Copy1.3临床试验协议及财务文件Clinical Trial Agreement & Financial Document原件Original1.4临床试验保密协议Confidentiality Disclosure Agreement(CDA)原件Original2临床试验申办单位资质Certificate of Sponsor2.1生产许可证Production License复印件Copy2.2营业执照Business License复印
3、件Copy2.3GMP证书GMP Certificate 复印件Copy2.4进口证书Import License(s)复印件Copy2.5技术转让书Technology Transfer Contract复印件Copy2.6委托函Letter of Authorization复印件Copy3临床试验研究人员Clinical Trial Study Personnel3.1临床试验研究人员通讯录及更新Clinical Trial Study Personnel Contact From / Update复印件Copy3.2临床试验研究人员分工授权签名表及更新Clinical Trial Stu
4、dy Personnel Authorized Signature and Delegation Log/Update复印件Copy3.3临床试验研究人员履历及更新Clinical Trial Study Personnel CV/Update复印件Copy3.4临床试验研究人员培训记录表Clinical Trial Study Personnel Training Record复印件Copy4伦理委员会Institution review board/Independent Ethics Committee(IRB/IEC)4.1临床试验伦理申请信Application Letter to
5、IRB/IEC for Conducting Clinical Trial原件Original4.2伦理委员会批件IRB/IEC Approval原件Original4.3伦理委员会成员名单IRB/IEC Membership原件Original4.4伦理委员会通信及备案文件IRB/IEC Correspondence/Filling Documents原件Original5临床试验文件Clinical Trial Documents5.1临床试验方案/修正案/一般性改变Clinical Trial Protocol / Amendments / Administrative Changes复
6、印件Copy5.2临床试验方案/修正案签名页Clinical Trial Protocol / Amendments Signature Page原件Original5.3研究者手册/产品说明书及更新Investigation Brochure/Package Inserts/Updates复印件Copy5.4受试者知情同意书及更新(模版)Subject Informed Consent Form (ICF) / Updates (Templates)原件Original5.5受试者招募广告,提供给受试者资料等及更新(如适用)Subject Recruitment Advertisements
7、, Materials Provided to Subject etc. /Updates(If Applicable)复印件Copy5.6保险声明/补偿文件及更新Insurance Statement /Letter of Indemnity/Updates复印件Copy5.7病例报告表及其填写指南及更新(模版)Case Record Form (CRF) and CRF Completion Guideline / Updates (Templates)复印件Copy5.8筛选记录及更新(模版)Screening Record Form /Update (Templates)复印件Copy
8、5.9原始记录表及更新(模版)Source Document Record Form / Updates (Templates)复印件Copy5.10临床试验用评分和日记卡及更新(模版)Clinical Trial Rating Scales and Diary Card / Updates (Templates)复印件Copy5.11受试者原始记录Subject Source Document原件Original5.12病例报告表/数据质疑表(已填写,签名,注明日期)CRF and Date Query Form (DQF) Filled , Signed and Dated复印件Copy5
9、.13已签名的知情同意书Signed ICF原件Original5.14数据(病例报告表/数据质疑表/原始记录)收集表Date (CRF /DQF /SD )Collection From复印件Copy6实验室文件Lab Document6.1实验室操作手册/操作标准规程Lab Manual/SOP复印件Copy6.2临床试验样本处理和跟踪指南Clinical Trial Sample Disposal and Follow-Up Guideline复印件Copy6.3实验室正常值范围及更新Lab Normal Ranges/Updates复印件Copy6.4实验室化验单样式及更新Lab Sh
10、eets Template/Updates复印件Copy6.5实验室资质证书/证明及更新Lab Certificate(s)/Accreditation(s)/Updates原件Original6.6实验室方法验证Lab Validation of Methods原件Original6.7实验室通信文件Lab Correspondence复印件Copy6.8试验用血样采集/运送/接收记录表Clinical Trial Blood Sample Collection /Shipment /Receipt Record Form复印件Copy6.9体液/组织标本保存记录表(如适用)Record o
11、f Retained Body Fluids / Tissue Samples (If Applicable)原件Original7临床试验用药品/物资Investigational Medicational Product(IMP)/Materials7.1临床试验用药品药检报告IMP Certificate of Analysis(COA)复印件Copy7.2临床试验用药品返还和/或处置的操作步骤Procedures of IMP Return and/or Disposal复印件Copy7.3临床试验用药品/物资运送/接收记录表IMP/Materials Shipping/Receipt
12、 Form复印件Copy7.4临床试验用药品发放/回收记录表IMP Dispense/Return Form原件Original7.5临床试验用药品标签粘贴页IMP Label Paste Pages原件Original7.6临床试验用药品/物资返还记录表IMP/Materials Return Form复印件Copy7.7临床试验用药品/物资清点记录表IMP/Materials Accountability Form原件Original7.8临床试验用药品/物资温度/湿度记录表(如适用)IMP / Materials Temperature / Humidity Log (If Applic
13、able)原件Original7.9临床试验用药品销毁证明/记录(如适用)IMP Destruction Certificate/Record(If Applicable)原件Original7.10临床试验随机和(或)揭盲标准操作规程Standard Operation Procedures of Clinical Trial Randomization and / or Unblinding复印件Copy7.11临床试验随机和(或)盲码信封/表单(包括模版复印,已用及未用)Clinical Trial Randomization and / or Blinding Envelopes/Sh
14、eets(Including Templates(Copy) ,Used and Unused Ones)原件Original8研究进展Study Progress8.1受试者筛选/入选表Subject Screening/Enrollment Log 复印件Copy8.2受试者鉴认代码表Subject Identification Form 原件Original8.3方案违背与偏离记录表Protocol Violation and Deviation Form 复印件Copy8.4临床试验研究者通讯/简报(如适用)Clinical Trial Newsletter / Study Brief
15、ing (If Applicable)复印件Copy8.5临床试验总结报告/出版规定(如适用)Clinical Study Report (CSR) / Publications (If Applicable)复印件Copy8.6临床试验完成报告(致伦理委员会,国家药品监督管理局)Clinical Trial Completion Report (To IRB/IEC and State Food and Drug Administration)复印件Copy9严重不良事件/药物不良反应Serious Adverse Event(s)/Drug Adverse Reactions(ADRs)9
16、.1严重不良事件/药物不良反应/怀孕(如适用)报告模版/标准操作规程Serious Adverse Event/Adverse Drug Reaction /Pregnancy Report (Template)/SOPs复印件Copy9.2临床试验怀孕报告表(首次/跟踪)(如适用)Clinical Trial Pregnancy Report (Initial / Follow-Up ) (If Applicable)原件Original9.3研究者致申办者/伦理委员会/药品监督管理部门的严重不良事件报告(首次/跟踪)SAE Report by Investigator to Sponsor
17、 / IRB/ IEC/ Regulatory Authority (Initial /Follow-Up)原件Original9.4申办者提供给所有研究者的安全信息通报“Dear Doctor信件”/IND安全警告信息Safety Alerts to All Investigator by Sponsor-“Dear Doctor Letter ”/IND safety Alters复印件Copy9.5申办者提供给监管机构/伦理委员会的小结报告/警告信息报告(包括不良事件,严重不良事件或未预期的严重药物不良反应)Summary Reports/Safety Alters (Including
18、 Adverse Event , Serious Adverse Event or Suspected Unexpected Serious Adverse Reactions) by Sponsor to Regulatory Authority /IRB/IEC复印件Copy10临床监查员访视文件Clinical Research Associate(CRA) Monitoring Visit Documents10.1临床试验启动访视报告Clinical Trial Initiation Visit Report复印件Copy10.2临床访视确认信件/跟踪信件Clinical Monit
19、oring Visit Confirmation Letter / Follow-Up Letter复印件Copy10.3临床试验访视记录表Clinical Site Visit Log复印件Copy10.4电话访视报告Telephone Visit Report复印件Copy10.5数据修正记录表(研究单位现场)Date Correction Record From (On-Site)原件Original11通信/会议文件Correspondence/Meeting Documents11.1通信文件,包括重要电子邮件Correspondence , including essential
20、E-mails复印件Copy11.2电话联系记录Telephone Contact Record复印件Copy11.3备忘录/说明记录Memorandum/Note to File复印件Copy11.4临床试验单位研究者会议记录(首研会、中期会、总结会)/签到表/培训资料Clinical Trial Site Investigator Meeting Minutes / Signature Log /Training Materials复印件Copy12其他Miscellaneous12.1稽查报告/证书Audit Report/Certificate复印件Copy注:不适用项画X,适用项不填
21、。6药物临床试验项目文件检查清单序号文件名称文件形式检查结果有无NAD1临床试验准备阶段D1.1研究者手册D1.2试验方案及其修正案(已签名)原件D1.3病例报告表(样表)D1.4知情同意书原件D1.5受试者招募广告D1.6财务规定D1.7保险条款或相关文件D1.8多方协议(已签名)(研究者、申办者、合同研究组织)D1.9伦理委员会批件D1.10伦理委员会成员表原件D1.11国家食品药品监督管理局批件D1.12研究者履历及相关文件D1.13临床试验有关的实验室检测正常值范围D1.14医学或实验室操作的质控证明原件D1.15试验用药品与试验相关物资的运货单D1.16试验药物的药检证明D1.17设
22、盲试验的破盲规程D2临床试验进行阶段D2.1研究者手册更新件D2.2其他文件(方案、病例报告表、知情同意书、书面情况通知、招募广告)的更新D2.3试验相关文件修订的伦理委员会批件原件D2.4新研究者的履历D2.5医学、实验室检查的正常值范围更新D2.6医学或实验室操作的质控证明的更新D2.7试验用药品与试验相关物资的运货单D2.8新批号试验药物的药检证明D2.9相关通信记录(信件、会议记录、电话记录)D2.10已签名的知情同意书原件D2.11原始医疗文件原件D2.12病例报告表(已填写,签名,注明日期)D2.13CRF修改记录D2.14研究者致申办者的严重不良事件报告原件D2.15研究中止/中断报告或终止报告(如果存在)原件D2.16申办者和/或研究者致药品监督管理局、伦理委员会的严重不良事件及其它安全性信息报告D2.17申办者致研究者的安全性信息通告D2.18中期或年度报告D2.19受试者鉴认代码表原件D2.20受试者筛选表与入选表D2.21试验用药品登记表D2.22研究者签名样张D2.23生物样本(体液或组织样本)留存记录D3临床试验完成后D3.1试验药物销毁证明D3.2完成试验受试者编码目录D3.3总结报告注:包括但不限于上述内容2
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
