 化学必修1第四章第节氨硫酸硝酸b1
化学必修1第四章第节氨硫酸硝酸b1


《化学必修1第四章第节氨硫酸硝酸b1》由会员分享,可在线阅读,更多相关《化学必修1第四章第节氨硫酸硝酸b1(25页珍藏版)》请在装配图网上搜索。
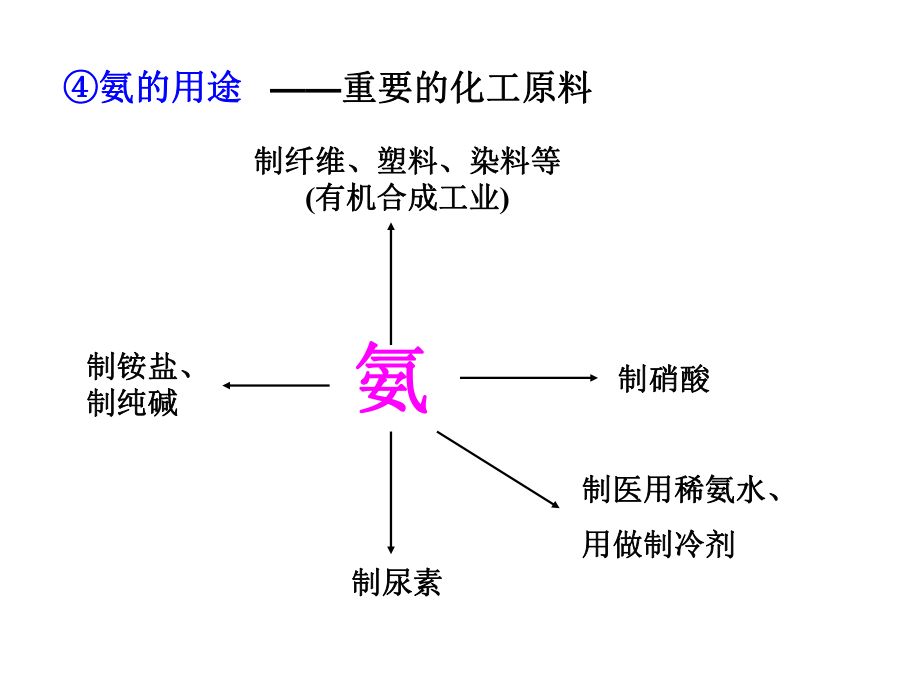
1、氨的用途氨的用途氨氨制硝酸制硝酸制铵盐、制铵盐、制纯碱制纯碱制尿素制尿素制纤维、塑料、染料等制纤维、塑料、染料等(有机合成工业有机合成工业)制医用稀氨水、制医用稀氨水、用做制冷剂用做制冷剂重要的化工原料重要的化工原料3、自然界氮的循环、自然界氮的循环 (1 1)概念:)概念: (2 2)途径:)途径: 生物固氮生物固氮 自然固氮自然固氮 人工固氮人工固氮硫酸和硝酸的氧化性硫酸和硝酸的氧化性大家讨论完成大家讨论完成P100思考与交流思考与交流3解析:解析:(1)它们都是酸,在水溶液中电离出)它们都是酸,在水溶液中电离出H+,硫酸和,硫酸和硝酸是含氧酸,盐酸是无氧酸;硫酸是二元强酸,硝酸是含氧酸,
2、盐酸是无氧酸;硫酸是二元强酸,硝酸和盐酸是一元强酸硝酸和盐酸是一元强酸(2 2)在水溶液中都电离出氢离子,)在水溶液中都电离出氢离子,HA = H+ + A- -(3 3)从盐酸、稀硫酸是非氧化性酸,浓硫酸或硝酸)从盐酸、稀硫酸是非氧化性酸,浓硫酸或硝酸是氧化性酸的角度去讨论。是氧化性酸的角度去讨论。 现有体积相同的浓硫酸和浓盐酸,分别放在等现有体积相同的浓硫酸和浓盐酸,分别放在等质量的两个试剂瓶中,不用化学方法怎样识别?质量的两个试剂瓶中,不用化学方法怎样识别?提起试剂瓶,重者是浓硫酸;提起试剂瓶,重者是浓硫酸;振动试剂瓶,液体呈油状的是浓硫酸;振动试剂瓶,液体呈油状的是浓硫酸;打开试剂瓶,
3、瓶口不生白雾者是浓硫酸;打开试剂瓶,瓶口不生白雾者是浓硫酸;打开试剂瓶,无刺激性气味的是浓硫酸。打开试剂瓶,无刺激性气味的是浓硫酸。请总结浓硫酸的物理性质:请总结浓硫酸的物理性质: 无色、无味、粘稠的油状无色、无味、粘稠的油状液体,密度大,沸点高,难挥发,与水任意比互溶液体,密度大,沸点高,难挥发,与水任意比互溶。一、一、硫酸和硝酸的氧化性硫酸和硝酸的氧化性1、硫酸的强氧化性、硫酸的强氧化性1 1、硫酸(、硫酸(H2SO4)1)浓硫酸的性质浓硫酸的性质 无色油状液体,难挥发,易溶于水,无色油状液体,难挥发,易溶于水, 沸点沸点338。注:注:高沸点酸制低沸点酸,难挥发性酸制易挥发性酸。高沸点酸
4、制低沸点酸,难挥发性酸制易挥发性酸。2)浓硫酸的特性浓硫酸的特性1) 吸水性:吸水性:能吸收水份,能吸收水份,可干燥与它不反应的气体可干燥与它不反应的气体O2 H2 N2CO2 SO2 HCl Cl2 NaCl + H2SO4(浓浓) NaHSO4 + HCl微热微热2NaCl + H2SO4(浓浓) Na2SO4 + 2HCl 强热强热具有酸的通性具有酸的通性思考:思考:能用浓硫酸干燥能用浓硫酸干燥H2S、NH3气体吗?气体吗?2) 脱水性脱水性浓硫酸能按水的组成比脱去有机物中的氢和氧元素。浓硫酸能按水的组成比脱去有机物中的氢和氧元素。浓硫酸的吸水性与脱水性有何区别浓硫酸的吸水性与脱水性有何
5、区别?思考思考:图图 4-31 向蔗糖中加入浓硫酸向蔗糖中加入浓硫酸现象现象: 固体由蓝色变为灰白色,固体由蓝色变为灰白色,溶液仍为无色。溶液仍为无色。反应反应:CuSO45H2O + H2SO4(浓浓) = CuSO4 + H2SO45H2O结论:结论:浓硫酸有浓硫酸有吸水性吸水性实验实验1在点滴板中放入在点滴板中放入少量胆矾,再加少量胆矾,再加入少量浓硫酸入少量浓硫酸现象现象: 滴有浓硫酸的滤纸滴有浓硫酸的滤纸炭化炭化变黑。变黑。解释解释: 滤纸的主要成份是纤维素,滤纸的主要成份是纤维素,由碳、氢、氧三种元素组成,由碳、氢、氧三种元素组成,浓硫酸能把滤纸中的氢、氧元浓硫酸能把滤纸中的氢、氧
6、元素按水的比例脱去。素按水的比例脱去。结论:结论:浓硫酸有浓硫酸有脱水性脱水性实验实验2把少量浓硫酸滴在纸片、火柴梗上比较学习 浓硫酸的吸水性和脱水性有什么区别?浓硫酸的吸水性和脱水性有什么区别?吸水性是指浓硫酸直接与水分子结合。吸水性是指浓硫酸直接与水分子结合。 脱水性是指浓硫酸将许多有机物中的氢、脱水性是指浓硫酸将许多有机物中的氢、氧元素按水的比例脱去。氧元素按水的比例脱去。吸收现成的水吸收现成的水反应生成水反应生成水3) 强氧化性强氧化性 加热时,浓硫酸能与大多数金属反应,但都没加热时,浓硫酸能与大多数金属反应,但都没有氢气生成,通常生成有氢气生成,通常生成SO2气体。气体。实验实验49
7、浓硫酸与铜反应,注意观察现象。浓硫酸与铜反应,注意观察现象。铜丝铜丝:红红黑黑液体液体:无无棕黑棕黑蓝色蓝色气体气体:无色无色有刺激性气味,使有刺激性气味,使品红品红溶溶液液褪色褪色实验结论:实验结论: SO2Cu + 2H2SO4(浓)(浓)= CuSO4 +SO2 +2H2O失去失去得到得到还原剂还原剂氧化剂氧化剂氧化产物氧化产物还原产物还原产物实验现象实验现象:金属的钝化金属的钝化 常温下,常温下,浓硫酸或浓硝酸浓硫酸或浓硝酸与某些金属与某些金属(如铁、铝如铁、铝)接触时,能使金属表面生成一层接触时,能使金属表面生成一层致密的氧化物致密的氧化物,从而,从而阻止内部的金属继续与浓硫酸反应,
8、这一现象叫钝化阻止内部的金属继续与浓硫酸反应,这一现象叫钝化现象。现象。加热时,浓硫酸也能与某些非金属反应(加热时,浓硫酸也能与某些非金属反应(S、C等)等) C + 2H2SO4(浓浓) = CO2 + 2SO2+ 2H2O常温下,常温下,铁、铝遇浓硫酸铁、铝遇浓硫酸(浓硝酸浓硝酸)发生钝化现象发生钝化现象总结浓硫酸的特性浓硫酸的特性 吸水性吸水性 强氧化性强氧化性 加热时浓硫酸能与大多数金属反应,加热时浓硫酸能与大多数金属反应,但不生成氢气。但不生成氢气。常温下常温下使铁铝钝化使铁铝钝化 脱水性脱水性Cu + 2H2SO4 (浓)(浓) = CuSO4 + SO2 + 2H2O 与某些非金
9、属反应与某些非金属反应C + 2H2SO4 (浓)(浓) = CO2 + SO2 + 2H2O 与硫化氢、碘化氢等还原剂反应与硫化氢、碘化氢等还原剂反应H2S + H2SO4 (浓)(浓) = S + SO2 + 2H2O分析分析 稀硫酸的氧化性和浓硫酸稀硫酸的氧化性和浓硫酸的氧化性有何不同?的氧化性有何不同? 稀硫酸的氧化性是由电离出的稀硫酸的氧化性是由电离出的H+引起的,引起的,氢离子只能氧化金属活动顺序表中氢前的金属,氢离子只能氧化金属活动顺序表中氢前的金属,所以稀硫酸具有弱的氧化性。所以稀硫酸具有弱的氧化性。 浓硫酸的氧化性是由硫酸分子中浓硫酸的氧化性是由硫酸分子中+6价硫元素引起的,
10、它可以氧化金属活动价硫元素引起的,它可以氧化金属活动顺序表氢后的金属;顺序表氢后的金属;所以浓硫酸具有强的氧化性。所以浓硫酸具有强的氧化性。硫酸用途硫酸用途制过磷酸钙制过磷酸钙电镀前去锈电镀前去锈制硫酸铵制硫酸铵制硫酸盐制硫酸盐制挥发性酸制挥发性酸精炼石油,制炸精炼石油,制炸药、农药、染料药、农药、染料Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4一元一元强酸强酸,易,易挥发挥发,不稳定(,不稳定(分解分解),),强氧化性。强氧化性。硝酸的浓度越大,越容易分解硝酸的浓度越大,越容易分解.2 2、硝酸、硝酸1)见光或受热分解见光或受热分解具有酸的通性具有酸的通性
11、4HNO3 2H2O + 4NO2+ O2热热光光思考:硝酸应储存在什么试剂瓶中?思考:硝酸应储存在什么试剂瓶中?棕色试剂瓶棕色试剂瓶2)强氧化性强氧化性与还原性物质反应与还原性物质反应:如:如金属单质、非金属单质金属单质、非金属单质 Fe2+、I-、S2-、SO2等。等。与金属反应与金属反应不产生氢气,不产生氢气,N元素被还原元素被还原反应规律:反应规律:金属金属稀硝酸稀硝酸浓硝酸浓硝酸高价金属高价金属 + NO2高价金属高价金属 + NO分析分析Cu、Fe分别与浓、稀硝酸反应分别与浓、稀硝酸反应常温时,常温时,Fe、Al遇浓硝酸也被钝化遇浓硝酸也被钝化浓硝酸与非金属的反应浓硝酸与非金属的反
12、应(C、S等等) C + 4HNO3(浓浓) = CO2 + 4NO2+ 2H2O与一些还原性离子的反应与一些还原性离子的反应3Fe2+ + 4H+ + NO3- - = 3Fe3+ + NO+ 2H2O3) 王水王水 :浓硝酸和浓盐酸的体积比为浓硝酸和浓盐酸的体积比为 1 3 的混合物的混合物4)硝酸的制备硝酸的制备实验室制法:实验室制法:工业生产:工业生产:NH3 NO NO2 HNO3NaNO3 +H2SO4(浓浓) = NaHSO4 + HNO3阅读资料卡片阅读资料卡片王水王水3 3、硫酸和硝酸的用途、硫酸和硝酸的用途 硫酸和硝酸都是重要的化工原料,也是化学实验室里硫酸和硝酸都是重要的
13、化工原料,也是化学实验室里必备的重要试剂。在工业上可用于制化肥、农药、炸药、必备的重要试剂。在工业上可用于制化肥、农药、炸药、染料、盐类等。硫酸还用于精炼石油、金属加工前的酸洗染料、盐类等。硫酸还用于精炼石油、金属加工前的酸洗及制取各种挥发性酸等。及制取各种挥发性酸等。图图 4-34 硫酸的用途硫酸的用途课堂小结课堂小结一、酸的通性 二、浓硫酸的特性 1、 吸水性 2、脱水性 3、强氧化性 三、硫酸的用途 本课小结硝酸的性质硝酸的性质物理性质物理性质化学性质化学性质1强酸性强酸性2不稳定性不稳定性3(1)钝化)钝化(2)与金属)与金属Cu(3)与非金属)与非金属C(4)与还原性化合物)与还原性
14、化合物练习练习2.下列叙述不正确的是下列叙述不正确的是 ( )A. NH3易液化,液氨常用作制冷剂易液化,液氨常用作制冷剂B. 与金属反应时,稀与金属反应时,稀HNO3可能被还原为更低价态,可能被还原为更低价态,则稀则稀HNO3氧化性强于浓氧化性强于浓HNO3C. 氨盐受热易分解,因此贮存氨态氮肥时要密封保氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处存,并放在阴凉通风处D. 稀稀HNO3和活泼金属反应时主要得到氢气和活泼金属反应时主要得到氢气1.起固定氮作用的化学反应是起固定氮作用的化学反应是 ( )A. N2与与H2在一定条件下反应生成在一定条件下反应生成NH3 B. 硝酸
15、工厂用硝酸工厂用NH3氧化制氧化制NOC. 雷雨时空气中的雷雨时空气中的 N2转化为转化为NO D. 由由NH3制碳酸氢铵和硫酸铵制碳酸氢铵和硫酸铵3.向盐酸中加入浓硫酸时产生白雾,下列叙述不属向盐酸中加入浓硫酸时产生白雾,下列叙述不属于产生该现象的原因是于产生该现象的原因是( )A. 浓硫酸具有脱水性浓硫酸具有脱水性 B. 浓硫酸具有吸水性浓硫酸具有吸水性 C. 盐酸具有挥发性盐酸具有挥发性 D. 气体的溶解度的随温度升高而降低气体的溶解度的随温度升高而降低4.欲迅速除去水壶底的水垢,又不损坏铝壶,最好欲迅速除去水壶底的水垢,又不损坏铝壶,最好选用选用 ( )A. 浓盐酸浓盐酸 B. 稀硝酸
16、稀硝酸 C. 冷的浓硫酸冷的浓硫酸 D. 冷的浓硝酸冷的浓硝酸5. 将下列性质的序号,填入各小题后面对应的括号中将下列性质的序号,填入各小题后面对应的括号中(A)脱水性脱水性;(B)强酸性强酸性;(C)二元酸二元酸;(D)氧化性氧化性;(E)吸水性吸水性(1)将胆矾放入装有浓将胆矾放入装有浓H2SO4的干燥器中,过一段时间的干燥器中,过一段时间胆矾变白色。胆矾变白色。 ( ) (2)NaOH与与H2SO4反应,可生成反应,可生成Na2SO4和和NaHSO4这这两种盐。两种盐。 ( ) (3)在烧杯中放入蔗糖,滴入浓在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大变黑,并产生大量气体。量气体。
17、( ) (4)在稀在稀HNO3中放入铝片就产生中放入铝片就产生NO。 ( )(5)在稀在稀H2SO4中放入铝片就产生中放入铝片就产生H2。 ( )(6)在冷浓在冷浓HNO3中放入铝片没明显现象。中放入铝片没明显现象。( ) (7)浓浓H2SO4敞口久置会增重。敞口久置会增重。 ( )(8)用稀硫酸清洗金属表面的氧化物用稀硫酸清洗金属表面的氧化物 ( )ECA、DB、DBDE B6.为了验证木炭可被浓为了验证木炭可被浓H2SO4氧化成氧化成CO2,选用下图所示仪器,选用下图所示仪器(内含物质内含物质)组装成实验装置:组装成实验装置:(1)如按气流由左向右流向,连接上述装置的正确顺序是如按气流由左向右流向,连接上述装置的正确顺序是(填各填各接口字母接口字母): 接接 , 接接 , 接接 ;(2)仪器乙、丙应有怎样的实验现象才表明已检验出仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中乙中 ,丙中,丙中 ; (3)丁中酸性丁中酸性KMnO4溶液的作用是溶液的作用是 ; (4)写出甲中反应方程式写出甲中反应方程式 。甲甲乙乙丙丙丁丁酸性酸性KMnOKMnO4 4品红品红澄清石澄清石灰水灰水浓浓H H2 2SOSO4 4木炭木炭ABCDEFA F E C D B出现白色沉淀出现白色沉淀品红未褪色品红未褪色吸收吸收SOSO2 2 C+2H2SO4(浓浓) = CO2+2SO2+2H2O
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
相关资源
更多 第二章 生物个体的内环境与稳态 第4节 动物生命活动的化学调节 课时2 激素调节信号转导的分子机制、体液调节与稳态、激素的应用 北师大版必修3
第二章 生物个体的内环境与稳态 第4节 动物生命活动的化学调节 课时2 激素调节信号转导的分子机制、体液调节与稳态、激素的应用 北师大版必修3
 九年级政治全册 第一课 第一框 感受社会变化课件 苏教版
九年级政治全册 第一课 第一框 感受社会变化课件 苏教版
 高中历史 第三单元《第3课 一代雄狮拿破仑》同步课件 新人教版选修4
高中历史 第三单元《第3课 一代雄狮拿破仑》同步课件 新人教版选修4
 中考语文总复习 九下 第五单元(复习重点+基础积累)课件 苏教版
中考语文总复习 九下 第五单元(复习重点+基础积累)课件 苏教版
 云南省丽江市永北镇中学八年级政治 合作竞争课件 人教新课标版
云南省丽江市永北镇中学八年级政治 合作竞争课件 人教新课标版
 北京少儿英语美式教育真伪辨别方法
北京少儿英语美式教育真伪辨别方法
 浙江省湖州市七年级政治《美国政治的心脏(第一课时)》课件新人教版
浙江省湖州市七年级政治《美国政治的心脏(第一课时)》课件新人教版
 高考地理一轮总复习 微专题1 等值线图的判读课件 中图版
高考地理一轮总复习 微专题1 等值线图的判读课件 中图版
 高中语文 22项脊轩志课件 苏教版必修5
高中语文 22项脊轩志课件 苏教版必修5
 高中语文 专题五 自河南经乱....课件 苏教版选修《唐诗宋词选读》
高中语文 专题五 自河南经乱....课件 苏教版选修《唐诗宋词选读》