 浙江省温州市啸中学高中化学 元素周期表及其应用课件
浙江省温州市啸中学高中化学 元素周期表及其应用课件


《浙江省温州市啸中学高中化学 元素周期表及其应用课件》由会员分享,可在线阅读,更多相关《浙江省温州市啸中学高中化学 元素周期表及其应用课件(26页珍藏版)》请在装配图网上搜索。
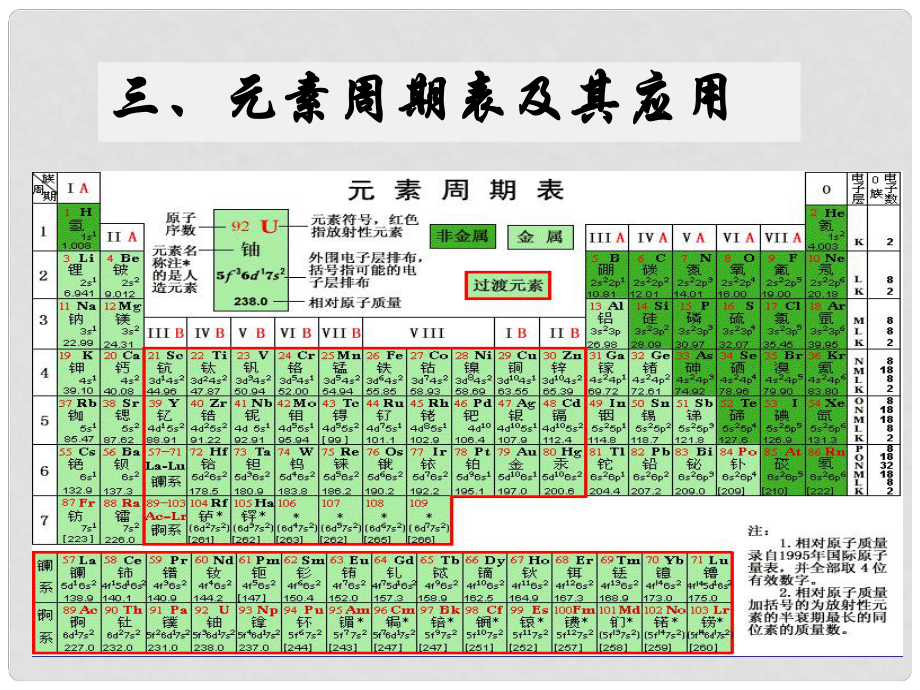
1、三、元素周期表及其应用三、元素周期表及其应用P10P10元素周期表元素周期表-门捷列夫门捷列夫 元素周期律的具体表现形式元素周期律的具体表现形式1、编排原则:、编排原则: 按原子序数的递增顺序从左到右排列按原子序数的递增顺序从左到右排列 将电子层数相同的元素排列成一个横行将电子层数相同的元素排列成一个横行(周期)(周期) 把最外层电子数相同的元素按电子层数递增的把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行顺序从上到下排成纵行(族)(族)仔细阅读研究图仔细阅读研究图l l一一5 5所示的元素周期表,与同学交流讨论下列所示的元素周期表,与同学交流讨论下列问题。问题。1 1在元素周期
2、表中,每个横行称为周期。在元素周在元素周期表中,每个横行称为周期。在元素周期表中共有多少个周期期表中共有多少个周期? ?每个周期各有多少种元素每个周期各有多少种元素? ? 在元素周期表中,每个纵行称为族。元素周期表中在元素周期表中,每个纵行称为族。元素周期表中有哪些族有哪些族? ? P8P8“交流与讨论交流与讨论”周期周期短周期短周期长周期长周期第第1周期:周期:2 种元素种元素第第2周期:周期:8 种元素种元素第第3周期:周期:8 种元素种元素第第4周期:周期:18 种元素种元素第第5周期:周期:18 种元素种元素第第6周期:周期:32 种元素种元素不完全周期不完全周期第第7周期:周期:26
3、种元素(预测有种元素(预测有32种)种)(横向)(横向)2、周期表的结构:、周期表的结构:周期序数周期序数 = = 电子层数电子层数 族族主族主族(A):副族副族(B):A , A , A , A ,A , A , A 第第VIII 族:族:稀有气体元素稀有气体元素主族序数主族序数 = = 最外层电子数最外层电子数 = =最高化合价最高化合价 0族:族:共七个主族共七个主族:长短周期共同组成长短周期共同组成B , B ,B , B , B ;B , B 共七个副族共七个副族:仅由长周期组成仅由长周期组成三个纵行,位于三个纵行,位于 B 与与B中间中间 (纵向)(纵向)2、周期表的结构:、周期表
4、的结构: 2找出氮、硫、钠、铝、氖等元素在元素周期表中的位找出氮、硫、钠、铝、氖等元素在元素周期表中的位置置(所在的周期和族所在的周期和族),分析这些元素的原子核外电子层数、,分析这些元素的原子核外电子层数、最外层电子数和元素所在的周期序数的关系。最外层电子数和元素所在的周期序数的关系。 除氖元素外,其他各元素原子的最外层电子数与该元素除氖元素外,其他各元素原子的最外层电子数与该元素所在的族序数有什么关系所在的族序数有什么关系?思考:思考:ClCl在元素周期表中位置的描述?在元素周期表中位置的描述?第七主族第七主族VIIVII族族VIIAVIIA族族第第IIIIII周期周期第三周期第三周期第第
5、3 3周期周期第三周期第三周期VIIAVIIA族族元素在周期表中位置的描述元素在周期表中位置的描述7 7个周期分长短,个周期分长短,3 3短短3 3长长1 1不全;不全;1818纵行纵行1616族,族,7 7主主7 7副副和和0 0。镧系、锕系排下边。镧系、锕系排下边。小结小结: :最外层电子数最外层电子数原子半径原子半径化合价化合价金属性(失电子能力)还金属性(失电子能力)还原性原性非金属性(得电子能力)非金属性(得电子能力)氧化性氧化性18 逐渐增多逐渐减小逐渐减小逐渐减弱逐渐减弱逐渐增强逐渐增强同周期元素即同一横行元素,同周期元素即同一横行元素,电子层数相同电子层数相同随着核电荷数的递增
6、随着核电荷数的递增逐渐升高逐渐升高(二)元素在周期表中的位置与性质的关系(二)元素在周期表中的位置与性质的关系1。同周期:。同周期:11Na 12Mg 13Al 14Si 15P 16S 17Cl 同周期元素原子同周期元素原子核外电子层数核外电子层数相同,相同,从左往右,从左往右,核电荷数递增,最外层电子数逐渐核电荷数递增,最外层电子数逐渐增加增加,原子半径逐渐原子半径逐渐减小减小,核对核外电子的吸引能力逐渐核对核外电子的吸引能力逐渐增强增强,失去电子的能力逐渐减弱,金属性失去电子的能力逐渐减弱,金属性减弱,减弱,得到电子的能力逐渐增大,非金属性得到电子的能力逐渐增大,非金属性增强。增强。同主
7、族元素即同一纵行元素,同主族元素即同一纵行元素,最外层电最外层电子数相同,子数相同,随着核电荷数的递增随着核电荷数的递增电子层数电子层数原子半径原子半径化合价化合价非金属性(得电子能力)表非金属性(得电子能力)表1-6氧化性氧化性金属性(失电子能力)还原性金属性(失电子能力)还原性逐渐增多逐渐增多逐渐增大逐渐增大基本相同基本相同逐渐增强逐渐增强逐渐减弱逐渐减弱以第以第AA族族为例:为例:9 F 17Cl35Br53I HClO4 HBrO4 HIO4非金属性逐渐减弱非金属性逐渐减弱1.单质氧化性单质氧化性逐渐减弱逐渐减弱2.2.最高价氧化物水化物最高价氧化物水化物酸性减弱酸性减弱解释:解释:从
8、上往下,电子层增多,半径增大;从上往下,电子层增多,半径增大;得电子能力减弱,非金属性减弱。得电子能力减弱,非金属性减弱。卤素原子结构的相似性,决定了卤素原子结构的相似性,决定了单质化学性质的单质化学性质的 相似性相似性与金属反应,生成卤化物。与金属反应,生成卤化物。与氢气反应,生成卤化氢。与氢气反应,生成卤化氢。与水反应,生成卤化氢和次卤酸。与水反应,生成卤化氢和次卤酸。卤素原子结构的差异性,决定了卤素原子结构的差异性,决定了单质化学性质的单质化学性质的差异性和递变性差异性和递变性与氢反应的能力渐弱与氢反应的能力渐弱氢化物的稳定性渐弱氢化物的稳定性渐弱与水反应的能力渐弱与水反应的能力渐弱单单
9、质质颜色和状态颜色和状态(常态)(常态)F F2 2淡黄绿色气淡黄绿色气体体ClCl2 2黄绿色气体黄绿色气体BrBr2 2深红棕色液深红棕色液体体I I2 2紫黑色固体紫黑色固体1.At1.At是卤族元素中位于碘后面的是卤族元素中位于碘后面的元素,推测元素,推测AtAt及它的化合物最不及它的化合物最不可能具有的性质(可能具有的性质( )A A、砹易溶于某些有机溶剂、砹易溶于某些有机溶剂B B、砹化氢很稳定,不易分解、砹化氢很稳定,不易分解C C、砹是有色气体、砹是有色气体D D、砹化银不溶于水或稀硝酸、砹化银不溶于水或稀硝酸BC从原子结构上分析同一周期元素金属性从原子结构上分析同一周期元素金
10、属性和非金属性的递变规律和非金属性的递变规律同一周期元素从左到右,随着核电荷数的增大,同一周期元素从左到右,随着核电荷数的增大,最外层电子数最外层电子数_,原子半径,原子半径_,原子失电子的能力,原子失电子的能力_,得,得电子的能力电子的能力_,元素的金属性元素的金属性_,非金属性,非金属性_。逐渐增加逐渐增加逐渐减小逐渐减小逐渐减弱逐渐减弱逐渐增强逐渐增强逐渐减弱逐渐减弱逐渐增强逐渐增强从原子结构上分析同一主族元素金属从原子结构上分析同一主族元素金属性和非金属性的递变规律性和非金属性的递变规律同一主族元素从上到下,随着核电荷数的增大,同一主族元素从上到下,随着核电荷数的增大,电子层数电子层数
11、_,原子半径,原子半径_,原子失电子的能力原子失电子的能力_,得电子的能力,得电子的能力_,元素的金属性元素的金属性_,非金属性,非金属性_。逐渐增加逐渐增加逐渐增大逐渐增大逐渐增强逐渐增强逐渐减弱逐渐减弱逐渐增强逐渐增强逐渐减弱逐渐减弱 1B Al SiGe As Sb Te 2 3 4 5 6 7A AAA AAA 0 Po At非金属性逐渐增强非金属性逐渐增强 金属性逐渐增强金属性逐渐增强金属性逐渐增强金属性逐渐增强 非金属性逐渐增强非金属性逐渐增强P9 P9 问题解决问题解决金属性最强的元素(不包括放射性元素)是金属性最强的元素(不包括放射性元素)是 ;最活泼的非金属元素是最活泼的非金
12、属元素是 ;最高价氧化物对应水化物的酸性最强的元素是最高价氧化物对应水化物的酸性最强的元素是 ;最高价氧化物对应水化物的碱性最强的元素(不包括放射性最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是元素)是 。CsFClCs2.寻找半导体材料寻找半导体材料3.寻找催化剂、耐高温、耐腐蚀的合金材料寻找催化剂、耐高温、耐腐蚀的合金材料1.寻找用于制取农药的元素寻找用于制取农药的元素五、元素周期表的应用五、元素周期表的应用原子结构原子结构表中位置表中位置元素性质元素性质原子序数原子序数= 核电荷数核电荷数周期数周期数= 电子层数电子层数主族序数主族序数=最外层电子数最外层电子数同位素化学性
13、质相同同位素化学性质相同 相似性相似性 递变性(从上至下,金属性增强,非金属性减弱)递变性(从上至下,金属性增强,非金属性减弱)同周期同周期同主族同主族递变性(从左到右,金属性减弱,非金属性增强)递变性(从左到右,金属性减弱,非金属性增强)原子半径原子半径最外层电子数最外层电子数金属性、非金属性强弱金属性、非金属性强弱(主族)最外层电子数(主族)最外层电子数 = 最高正价最高正价 最外层电子数最外层电子数8 = 负价负价结构、位置、性质三者的关系结构、位置、性质三者的关系元素周期律及元素周表的三大意义元素周期律及元素周表的三大意义 根据元素周期表中的位置,推根据元素周期表中的位置,推测元素的原
14、子结构预测其主要的性质。测元素的原子结构预测其主要的性质。 位置相近的元素性质相似,借助元位置相近的元素性质相似,借助元素周期表研究合成有特定性质的新物质素周期表研究合成有特定性质的新物质 揭示了一系列的科学观念,对化学科揭示了一系列的科学观念,对化学科学的发展起积极的推进作用。量变引起质变学的发展起积极的推进作用。量变引起质变的规律性的规律性 预言新元素,研究新农药,寻找半导预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。体材料、催化剂、耐高温耐腐蚀材料。位置位置性质性质结构结构相似性相似性递变性递变性1.主要化合价主要化合价2.最高价氧化物及其水化物的组成最高价氧化物及其
15、水化物的组成3.氢化物组成氢化物组成1.金属性与非金属性金属性与非金属性2.“水化物水化物”的酸碱性的酸碱性3.氢化物的稳定性氢化物的稳定性“位位”、“构构”、“性性”理论理论最外层电子数最外层电子数电子层数电子层数(族)纵(族)纵(周期)横(周期)横原子序数原子序数项目项目同周期(左右)同周期(左右)同主族(上下)同主族(上下)原原子子结结构构核电荷数核电荷数最外层电子数最外层电子数电子层数电子层数原子半径原子半径性性质质化合价化合价元素的金属性和非金属元素的金属性和非金属性性单质的氧化性还原性单质的氧化性还原性最高价化合物对应水化最高价化合物对应水化物的酸碱性物的酸碱性气态氢化物的稳定性气
16、态氢化物的稳定性同周期、同主族元素的递变规律同周期、同主族元素的递变规律依次增大依次增大逐渐增多逐渐增多相同相同逐渐减小逐渐减小依次增大依次增大金属性减弱,非金属性增强金属性减弱,非金属性增强还原性减弱,氧化性增强还原性减弱,氧化性增强碱性减弱,酸性增强碱性减弱,酸性增强逐渐增强逐渐增强按周期元素数增加按周期元素数增加相同相同依次递增依次递增逐渐增大逐渐增大基本相同基本相同非金属性减弱,金属性增强非金属性减弱,金属性增强氧化性减弱,还原性增强氧化性减弱,还原性增强酸性减弱,碱性增强酸性减弱,碱性增强逐渐减弱逐渐减弱2、在短周期元素中,原子最外电子层只有、在短周期元素中,原子最外电子层只有1个个或或2个电子的元素是个电子的元素是()()A金属元素金属元素B稀有气体元素稀有气体元素C非金属元素非金属元素D无法确定为哪一类元素无法确定为哪一类元素D练习练习3、A、B、C是周期表中相邻的三种元素且原子序数依是周期表中相邻的三种元素且原子序数依次增加,其中次增加,其中A、B是同周期,是同周期,B、C是同主族。此三种是同主族。此三种元素原子最外层电子数之和为元素原子最外层电子数之和为17,质子数之和为,质子数之和为31,则,则A、B、C分别为什么元素?分别为什么元素?练习练习观察,可得观察,可得A是氮元素是氮元素 B是氧元素是氧元素 C是硫元素是硫元素 7N 8O 14P 16S
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
