 南大物化PPT02章热力学第二定律
南大物化PPT02章热力学第二定律


《南大物化PPT02章热力学第二定律》由会员分享,可在线阅读,更多相关《南大物化PPT02章热力学第二定律(146页珍藏版)》请在装配图网上搜索。
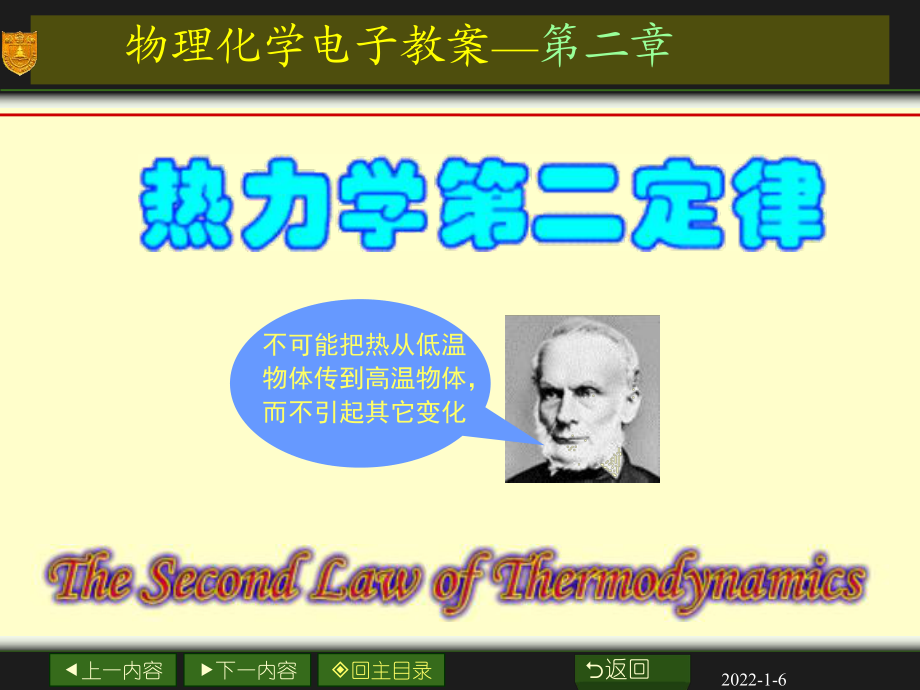
1、上一内容下一内容回主目录O返回2022-1-6不可能把热从低温物体传到高温物体,而不引起其它变化 物理化学电子教案第二章上一内容下一内容回主目录O返回2022-1-6第二章 热力学第二定律2.1 自发变化的共同特征2.2 热力学第二定律2.3 卡诺循环与卡诺定理2.4 熵的概念2.5 克劳修斯不等式与熵增加原理2.6 熵变的计算2.7 热力学第二定律的本质和熵的统计意义2.8 亥姆霍兹自由能和吉布斯自由能上一内容下一内容回主目录O返回2022-1-6第二章 热力学第二定律2.9 变化的方向和平衡条件2.10 G的计算示例2.11 几个热力学函数间的关系2.12 克拉贝龙方程2.13 热力学第三
2、定律与规定熵上一内容下一内容回主目录O返回2022-1-62.1自发变化的共同特征自发变化 某种变化有自动发生的趋势,一旦发生就无需借助外力,可以自动进行,这种变化称为自发变化。自发变化的共同特征不可逆性 任何自发变化的逆过程是不能自动进行的。例如:(1) 焦耳热功当量中功自动转变成热;(2) 气体向真空膨胀;(3) 热量从高温物体传入低温物体;(4)浓度不等的溶液混合均匀;(5)锌片与硫酸铜的置换反应等,它们的逆过程都不能自动进行。当借助外力,体系恢复原状后,会给环境留下不可磨灭的影响。上一内容下一内容回主目录O返回2022-1-62.2 热力学第二定律(The Second Law of
3、Thermodynamics)克劳修斯(Clausius)的说法:“不可能把热从低温物体传到高温物体,而不引起其它变化。”开尔文(Kelvin)的说法:“不可能从单一热源取出热使之完全变为功,而不发生其它的变化。” 后来被奥斯特瓦德(Ostward)表述为:“第二类永动机是不可能造成的”。第二类永动机:从单一热源吸热使之完全变为功而不留下任何影响。上一内容下一内容回主目录O返回2022-1-623 卡诺循环与卡诺定理卡诺循环热机效率冷冻系数卡诺定理上一内容下一内容回主目录O返回2022-1-6卡诺循环(Carnot cycle) 1824 年,法国工程师N.L.S.Carnot (179618
4、32)设计了一个循环,以理想气体为工作物质,从高温 热源吸收 的热量,一部分通过理想热机用来对外做功W,另一部分 的热量放给低温 热源。这种循环称为卡诺循环。()ThhQcQ()TcN.L.S.Carnot上一内容下一内容回主目录O返回2022-1-6卡诺循环(Carnot cycle)1mol 理想气体的卡诺循环在pV图上可以分为四步:过程1:等温 可逆膨胀由 到h()T11VpB)A(22Vp01U21h1lnVWnRTV 所作功如AB曲线下的面积所示。h1QW 上一内容下一内容回主目录O返回2022-1-6卡诺循环(Carnot cycle)上一内容下一内容回主目录O返回2022-1-6
5、卡诺循环(Carnot cycle)过程2:绝热可逆膨胀由 到22hp V T33c(BC)p V T02Qch22,mdTVTWUCT 所作功如BC曲线下的面积所示。上一内容下一内容回主目录O返回2022-1-6卡诺循环(Carnot cycle)上一内容下一内容回主目录O返回2022-1-6卡诺循环(Carnot cycle)过程3:等温(TC)可逆压缩由 到33VpD)C(44Vp343c30lnUVWnRTV 环境对体系所作功如DC曲线下的面积所示c3QW 上一内容下一内容回主目录O返回2022-1-6卡诺循环(Carnot cycle)上一内容下一内容回主目录O返回2022-1-6卡
6、诺循环(Carnot cycle)过程4:绝热可逆压缩由 到44cp V T1 1 h(DA)pVThc444,m0dTVTQWUCT 环境对体系所作的功如DA曲线下的面积所示。上一内容下一内容回主目录O返回2022-1-6卡诺循环(Carnot cycle)上一内容下一内容回主目录O返回2022-1-6卡诺循环(Carnot cycle)整个循环:0UQQQch hQ是体系所吸的热,为正值,cQ是体系放出的热,为负值。2413 (WWWWW和对消)即ABCD曲线所围面积为热机所作的功。上一内容下一内容回主目录O返回2022-1-6卡诺循环(Carnot cycle)上一内容下一内容回主目录O
7、返回2022-1-6卡诺循环(Carnot cycle)13c12hVTVT过程2:14c11hVTVT过程4:4312VVVV 相除得根据绝热可逆过程方程式24ch1313lnlnWWVVnRTnRTVV 所以2ch1()lnVnR TTV 上一内容下一内容回主目录O返回2022-1-6热机效率(efficiency of the engine ) 任何热机从高温 热源吸热 ,一部分转化为功W,另一部分 传给低温 热源.将热机所作的功与所吸的热之比值称为热机效率,或称为热机转换系数,用 表示。 恒小于1。)(hThQcQ)(cThchhQQWQQ)0(cQ12hc12h1()ln()ln()
8、VnR TTVVnRTV或hchch1TTTTT上一内容下一内容回主目录O返回2022-1-6冷冻系数 如果将卡诺机倒开,就变成了致冷机.这时环境对体系做功W,体系从低温 热源吸热 ,而放给高温 热源 的热量,将所吸的热与所作的功之比值称为冷冻系数,用 表示。)(cTcQ)(hThQcchcQTWTT式中W表示环境对体系所作的功。上一内容下一内容回主目录O返回2022-1-6卡诺定理卡诺定理:所有工作于同温热源和同温冷源之间的热机,其效率都不能超过可逆机,即可逆机的效率最大。卡诺定理推论:所有工作于同温热源与同温冷源之间的可逆机,其热机效率都相等,即与热机的工作物质无关。卡诺定理的意义:(1)
9、引入了一个不等号 ,原则上解决了化学反应的方向问题;(2)解决了热机效率的极限值问题。IR上一内容下一内容回主目录O返回2022-1-62.4 熵的概念从卡诺循环得到的结论任意可逆循环的热温商熵的引出熵的定义上一内容下一内容回主目录O返回2022-1-6从卡诺循环得到的结论hchchhhQQTTWQQThchc11TTQQhhccTQTQchch0QQTT 或:即卡诺循环中,热效应与温度商值的加和等于零。上一内容下一内容回主目录O返回2022-1-6iRii()0QT任意可逆循环的热温商证明如下:任意可逆循环热温商的加和等于零,即: 同理,对MN过程作相同处理,使MXOYN折线所经过程作的功与
10、MN过程相同。VWYX就构成了一个卡诺循环。R()0QT 或(2)通过P,Q点分别作RS和TU两条可逆绝热膨胀线,(1)在如图所示的任意可逆循环的曲线上取很靠近的PQ过程;(3)在P,Q之间通过O点作等温可逆膨胀线VW,使两个三角形PVO和OWQ的面积相等,这样使PQ过程与PVOWQ过程所作的功相同。 上一内容下一内容回主目录O返回2022-1-6任意可逆循环的热温商上一内容下一内容回主目录O返回2022-1-6任意可逆循环的热温商 用相同的方法把任意可逆循环分成许多首尾连接的小卡诺循环,前一个循环的等温可逆膨胀线就是下一个循环的绝热可逆压缩线,如图所示的虚线部分,这样两个过程的功恰好抵消。
11、从而使众多小卡诺循环的总效应与任意可逆循环的封闭曲线相当,所以任意可逆循环的热温商的加和等于零,或它的环程积分等于零。上一内容下一内容回主目录O返回2022-1-6任意可逆循环的热温商上一内容下一内容回主目录O返回2022-1-6熵的引出用一闭合曲线代表任意可逆循环。R()0QT 12BARRAB()()0QQTT可分成两项的加和在曲线上任意取A,B两点,把循环分成AB和BA两个可逆过程。根据任意可逆循环热温商的公式:上一内容下一内容回主目录O返回2022-1-6熵的引出 说明任意可逆过程的热温商的值决定于始终状态,而与可逆途径无关,这个热温商具有状态函数的性质。移项得: 12BBRRAA()
12、()QQTT任意可逆过程上一内容下一内容回主目录O返回2022-1-6熵的定义 Clausius根据可逆过程的热温商值决定于始终态而与可逆过程无关这一事实定义了“熵”(entropy)这个函数,用符号“S”表示,单位为: 1J KRd()QST对微小变化 这几个熵变的计算式习惯上称为熵的定义式,即熵的变化值可用可逆过程的热温商值来衡量。BBARA()QSSST R()0iiiQST R()iiiQST或设始、终态A,B的熵分别为 和 ,则:ASBS上一内容下一内容回主目录O返回2022-1-62.5 Clausius 不等式与熵增加原理Clausius 不等式熵增加原理Clausius 不等式
13、的意义上一内容下一内容回主目录O返回2022-1-6Clausius 不等式 设温度相同的两个高、低温热源间有一个可逆机和一个不可逆机。hchchR1TTTTTIRR根据卡诺定理:0hhccTQTQ则iIRii()0QT推广为与多个热源接触的任意不可逆过程得:hchchIR1QQQQQ则:上一内容下一内容回主目录O返回2022-1-6Clausius 不等式ARABB()QSSTABIR,ABi()0QST或 BAIR,ABi()QSST 设有一个循环, 为不可逆过程, 为可逆过程,整个循环为不可逆循环。ABBAAIR,ABRBi()()0QQTT则有如AB为可逆过程ABR,ABi()0QST
14、ABABi()0QST将两式合并得 Clausius 不等式:上一内容下一内容回主目录O返回2022-1-6Clausius 不等式 这些都称为 Clausius 不等式,也可作为热力学第二定律的数学表达式。ABABi()0QSTdQST或 是实际过程的热效应,T是环境温度。若是不可逆过程,用“”号,可逆过程用“=”号,这时环境与体系温度相同。Qd0QST对于微小变化:上一内容下一内容回主目录O返回2022-1-6熵增加原理对于绝热体系,所以Clausius 不等式为0Qd0S 等号表示绝热可逆过程,不等号表示绝热不可逆过程。熵增加原理可表述为:在绝热条件下,趋向于平衡的过程使体系的熵增加。或
15、者说在绝热条件下,不可能发生熵减少的过程。 如果是一个孤立体系,环境与体系间既无热的交换,又无功的交换,则熵增加原理可表述为:一个孤立体系的熵永不减少。上一内容下一内容回主目录O返回2022-1-6Clausius 不等式的意义Clsusius 不等式引进的不等号,在热力学上可以作为变化方向与限度的判据。dQST“” 号为不可逆过程“=” 号为可逆过程0disoS“” 号为自发过程“=” 号为处于平衡状态因为隔离体系中一旦发生一个不可逆过程,则一定是自发过程。上一内容下一内容回主目录O返回2022-1-6Clausius 不等式的意义 有时把与体系密切相关的环境也包括在一起,用来判断过程的自发
16、性,即:iso(0SSS 体系)环境)“” 号为自发过程“=” 号为可逆过程上一内容下一内容回主目录O返回2022-1-6 26 熵变的计算& 等温过程的熵变& 变温过程的熵变& 化学过程的熵变& 环境的熵变& 用热力学关系式求熵变& TS 图及其应用上一内容下一内容回主目录O返回2022-1-6等温过程的熵变(1)理想气体等温变化)ln(12VVnRS )ln(21ppnR(2)等温等压可逆相变(若是不可逆相变,应设计可逆过程)相变)相变)相变)(THS(3)理想气体(或理想溶液)的等温混合过程,并符合分体积定律,即总BBVVx BBmixBlnSRnx上一内容下一内容回主目录O返回2022
17、-1-6等温过程的熵变 例1:1mol理想气体在等温下通过:(1)可逆膨胀,(2)真空膨胀,体积增加到10倍,分别求其熵变。解:(1)可逆膨胀maxR()WQSTT体系)12lnVVnR1ln1019.14 J KnR0(环境)(体系)(隔离)SSS(1)为可逆过程。上一内容下一内容回主目录O返回2022-1-6熵是状态函数,始终态相同,体系熵变也相同,所以:等温过程的熵变(2)真空膨胀119.14 J KS(体系) 但环境没有熵变,则:119.14 J K0SS (隔离)(体系)(2)为不可逆过程上一内容下一内容回主目录O返回2022-1-6等温过程的熵变例2:求下述过程熵变。已知H2O(l
18、)的汽化热为-140.620 kJ mol22H O(1 mol,l,373.15 K)H O(1 mol,g,373.15 K)pp$R)(体系)TQSbmvapTH140.620 kJ mol373.15 K11108.9 J Kmol解:如果是不可逆相变,可以设计可逆相变求 值。S上一内容下一内容回主目录O返回2022-1-6等温过程的熵变例3:在273 K时,将一个 的盒子用隔板一分为二,一边放 ,另一边放 。322.4 dm20.5 mol O (g)20.5 mol N (g)解法1:122ln)O(VVnRS2 .124 .22ln5 . 0 R222.4(N0.5 ln12.2
19、SR)N()O(22mixSSS2ln2 .124 .22lnRR求抽去隔板后,两种气体混合过程的熵变?上一内容下一内容回主目录O返回2022-1-6等温过程的熵变解法2:BBBmixlnxnRS2211(O )ln(N )ln22R nn 1ln2Rln2R上一内容下一内容回主目录O返回2022-1-6变温过程的熵变(1)物质的量一定的等容变温过程21dm,TTVTTnCS21dm,TTpTTnCS(2)物质的量一定的等压变温过程上一内容下一内容回主目录O返回2022-1-6变温过程的熵变1. 先等温后等容21,m21dln()TVTnCTVSnRVT21,m12dln()TpTnCTpSn
20、RpT2. 先等温后等压22,m,m11ln()ln()pVVpSnCnCVp* 3. 先等压后等容(3)物质的量一定从 到 的过程。这种情况一步无法计算,要分两步计算,有三种分步方法:111,p V T222,p V T上一内容下一内容回主目录O返回2022-1-6变温过程的熵变(4)没有相变的两个恒温热源之间的热传导)()(21TSTSS)11(12TTQ*(5)没有相变的两个变温物体之间的热传导,首先要求出终态温度T212211)(CCTCTCT21SSS2211lnlnTTCTTC上一内容下一内容回主目录O返回2022-1-6化学过程的熵变(1)在标准压力下,298.15 K时,各物质
21、的标准摩尔熵值有表可查。根据化学反应计量方程,可以计算反应进度为1 mol时的熵变值。rmBmB(B)SS$B,mBrmrm298.15K(B)d( )(298.15K)pTCTSTST $(2)在标准压力下,求反应温度T时的熵变值。298.15K时的熵变值从查表得到:上一内容下一内容回主目录O返回2022-1-6化学过程的熵变(3)在298.15 K时,求反应压力为p时的熵变。标准压力下的熵变值查表可得rmrm( )()() dpppVSpSppT $TQSRmrrm()pESzFT(4)从可逆电池的热效应 或从电动势随温度的变化率求电池反应的熵变RQ上一内容下一内容回主目录O返回2022-
22、1-6环境的熵变(1)任何可逆变化时环境的熵变Rd ()()/()SQT 环环环(2)体系的热效应可能是不可逆的,但由于环境很大,对环境可看作是可逆热效应d ()()/()SQT 环体系环上一内容下一内容回主目录O返回2022-1-6用热力学关系式求根据吉布斯自由能的定义式GHTSTGHSSTHG/ )(对于任何等温变化过程这种方法运用于任何热力学平衡态体系。上一内容下一内容回主目录O返回2022-1-6T-S图及其应用T-S图以T为纵坐标、S为横坐标所作的表示热力学过程的图称为T-S图,或称为温-熵图。T-S图的用处:(1)体系从状态A到状态B,在T-S图上曲线AB下的面积就等于体系在该过程
23、中的热效应,一目了然。STQdR上一内容下一内容回主目录O返回2022-1-6T-S图及其应用(2)容易计算热机循环时的效率 热机所作的功W为闭合曲线ABCDA所围的面积。ABCDAABC的面积循环热机的效率曲线下的面积 图中ABCDA表示任一可逆循环。ABC是吸热过程,所吸之热等于ABC曲线下的面积; CDA是放热过程,所放之热等于CDA曲线下的面积。上一内容下一内容回主目录O返回2022-1-6T-S 图的优点:(1)既显示体系所作的功,又显示体系所吸取或释放的热量。p-V 图只能显示所作的功。(2)既可用于等温过程,也可用于变温过程来计算体系可逆过程的热效应;而根据热容计算热效应不适用于
24、等温过程。Rd d QT SQC T(可用于任何可逆过程)(不能用于等温过程)上一内容下一内容回主目录O返回2022-1-62.7热力学第二定律的本质和熵的统计意义 热与功转换的不可逆性 热是分子混乱运动的一种表现,而功是分子有序运动的结果。 功转变成热是从规则运动转化为不规则运动,混乱度增加,是自发的过程; 而要将无序运动的热转化为有序运动的功就不可能自动发生。上一内容下一内容回主目录O返回2022-1-62.7热力学第二定律的本质和熵的统计意义气体混合过程的不可逆性 将N2和O2放在一盒内隔板的两边,抽去隔板, N2和O2自动混合,直至平衡。这是混乱度增加的过程,也是熵增加的过程,是自发的
25、过程,其逆过程决不会自动发生。上一内容下一内容回主目录O返回2022-1-62.7热力学第二定律的本质和熵的统计意义热传导过程的不可逆性处于高温时的体系,分布在高能级上的分子数较集中;而处于低温时的体系,分子较多地集中在低能级上。 当热从高温物体传入低温物体时,两物体各能级上分布的分子数都将改变,总的分子分布的花样数增加,是一个自发过程,而逆过程不可能自动发生。上一内容下一内容回主目录O返回2022-1-6热力学第二定律的本质 热力学第二定律指出,凡是自发的过程都是不可逆的,而一切不可逆过程都可以归结为热转换为功的不可逆性。 从以上几个不可逆过程的例子可以看出,一切不可逆过程都是向混乱度增加的
26、方向进行,而熵函数可以作为体系混乱度的一种量度,这就是热力学第二定律所阐明的不可逆过程的本质。上一内容下一内容回主目录O返回2022-1-6热力学概率和数学概率热力学概率就是实现某种宏观状态的微观状态数,通常用 表示。数学概率是热力学概率与总的微观状态数之比。上一内容下一内容回主目录O返回2022-1-6热力学概率和数学概率例如:有4个小球分装在两个盒子中,总的分装方式应该有16种。因为这是一个组合问题,有如下几种分配方式,其热力学概率是不等的。04(0,4)1C分配方式 分配微观状态数44(4,0)1C34(3,1)4C24(2,2)6C14(1,3)4C上一内容下一内容回主目录O返回202
27、2-1-6热力学概率和数学概率 其中,均匀分布的热力学概率 最大,为6。(2,2)每一种微态数出现的概率都是1/16,但以(2,2)均匀分布出现的数学概率最大,为6/16,数学概率的数值总是从 。01 如果粒子数很多,则以均匀分布的热力学概率将是一个很大的数字。上一内容下一内容回主目录O返回2022-1-6Boltzmann公式这与熵的变化方向相同。另外,热力学概率 和熵 S 都是热力学能U,体积 V 和粒子数 N 的函数,两者之间必定有某种联系,用函数形式可表示为:宏观状态实际上是大量微观状态的平均,自发变化的方向总是向热力学概率增大的方向进行。()SS上一内容下一内容回主目录O返回2022
28、-1-6Boltzmann公式Boltzmann认为这个函数应该有如下的对数形式:lnSk这就是Boltzmann公式,式中 k 是Boltzmann常数。 Boltzmann公式把热力学宏观量 S 和微观量概率 联系在一起,使热力学与统计热力学发生了关系,奠定了统计热力学的基础。 因熵是容量性质,具有加和性,而复杂事件的热力学概率应是各个简单、互不相关事件概率的乘积,所以两者之间应是对数关系。上一内容下一内容回主目录O返回2022-1-62.8亥姆霍兹自由能和吉布斯自由能为什么要定义新函数亥姆霍兹自由能吉布斯自由能上一内容下一内容回主目录O返回2022-1-6为什么要定义新函数 热力学第一定
29、律导出了热力学能这个状态函数,为了处理热化学中的问题,又定义了焓。 热力学第二定律导出了熵这个状态函数,但用熵作为判据时,体系必须是孤立体系,也就是说必须同时考虑体系和环境的熵变,这很不方便。 通常反应总是在等温、等压或等温、等容条件下进行,有必要引入新的热力学函数,利用体系自身状态函数的变化,来判断自发变化的方向和限度。上一内容下一内容回主目录O返回2022-1-6亥姆霍兹自由能 亥姆霍兹(von Helmholz, H.L.P.,18211894,德国人)定义了一个状态函数 def AUTSA称为亥姆霍兹自由能(Helmholz free energy),是状态函数,具有容量性质。上一内容
30、下一内容回主目录O返回2022-1-6亥姆霍兹自由能TSSTUAddddddQWT SS T maxW (d)UQW (等温,可逆)dQT S,Rmax( d )TAW 或 即:等温、可逆过程中,体系对外所作的最大功等于体系亥姆霍兹自由能的减少值,所以把A称为功函(work function)。若是不可逆过程,体系所作的功小于A的减少值。上一内容下一内容回主目录O返回2022-1-6亥姆霍兹自由能如果体系在等温、等容且不作其它功的条件下0)d(0,fWVTA0)d(0,fWVTA或 等号表示可逆过程,不等号表示是一个自发的不可逆过程,即自发变化总是朝着亥姆霍兹自由能减少的方向进行。这就是亥姆霍
31、兹自由能判据。不等号的引入见下节。上一内容下一内容回主目录O返回2022-1-6吉布斯自由能吉布斯(Gibbs J.W.,18391903)定义了一个状态函数: def GHTSG称为吉布斯自由能(Gibbs free energy),是状态函数,具有容量性质。上一内容下一内容回主目录O返回2022-1-6吉布斯自由能ddddGHT SS Tefdd QWWp VV p fdQWV p )d(ddpVUH因为f,maxW ( 可逆), 0d, 0dpTfddddGQWV pT SS T 所以,Rf,max( d)T pGW 或即:等温、等压、可逆过程中,体系对外所作的最大非膨胀功等于体系吉布斯
32、自由能的减少值。若是不可逆过程,体系所作的功小于吉布斯自由能的减少值。e (d )Wp V 上一内容下一内容回主目录O返回2022-1-6吉布斯自由能如果体系在等温、等压、且不作非膨胀功的条件下,0)d(0,fWpTG0)d(0,fWpTG或 等号表示可逆过程,不等号表示是一个自发的不可逆过程,即自发变化总是朝着吉布斯自由能减少的方向进行。这就是吉布斯自由能判据,所以dG又称之为等温、压等位。因为大部分实验在等温、等压条件下进行,所以这个判据特别有用。不等号的引入见下节。上一内容下一内容回主目录O返回2022-1-6吉布斯自由能在等温、等压、可逆电池反应中f ,maxrGWnEF 式中n为电池
33、反应中电子的物质的量,E为可逆电池的电动势,F为法拉第常数。 这是联系热力学和电化学的桥梁公式。因电池对外作功,E 为正值,所以加“-”号。上一内容下一内容回主目录O返回2022-1-62.9变化的方向和平衡条件熵判据亥姆霍兹自由能判据吉布斯自由能判据上一内容下一内容回主目录O返回2022-1-6熵判据 熵判据在所有判据中处于特殊地位,因为所有判断反应方向和达到平衡的不等式都是由熵的Clausius不等式引入的。但由于熵判据用于隔离体系(保持U,V不变),要考虑环境的熵变,使用不太方便。,(d )0U VS表示可逆,平衡表示不可逆,自发 在隔离体系中,如果发生一个不可逆变化,则必定是自发的,自
34、发变化总是朝熵增加的方向进行。自发变化的结果使体系处于平衡状态,这时若有反应发生,必定是可逆的,熵值不变。上一内容下一内容回主目录O返回2022-1-6熵判据对于绝热体系d (0S绝热) 等号表示可逆,不等号表示不可逆,但不能判断其是否自发。因为绝热不可逆压缩过程是个非自发过程,但其熵变值也大于零。上一内容下一内容回主目录O返回2022-1-6亥姆霍兹自由能判据不等号的引入d0()QST环根据第一定律dQUW当,即体系的始、终态温度与环境温度相等,环21TTTdWA 即 (这就是定义A的出发点)表示可逆,平衡表示不可逆,自发, ,0(d )0fT V WA判据:(d()d )WUTS 环代入得
35、:d()UTSW得上一内容下一内容回主目录O返回2022-1-6吉布斯自由能判据当 , ,得:TTTT环21effdWWWp VW fdd()p VWUTS 当始、终态压力与外压相等时,即 ,ppppe21(d()d )WUTS 环根据第一定律 ,代入得:dQUWfd()UpVWTS dG d()HTS(这就是定义G的出发点)f, ,0(d )0T p WG判据:表示可逆,平衡表示不可逆,自发不等号的引入 d0()QST环上一内容下一内容回主目录O返回2022-1-62.10 G的计算示例等温物理变化中的G等温化学变化中的G上一内容下一内容回主目录O返回2022-1-6等温物理变化中的G根据G
36、的定义式:GHTSTSpVUApVTSSTHGddddpVVpAddd 根据具体过程,代入就可求得G值。因为G是状态函数,只要始、终态定了,总是可以设计可逆过程来计算G值。上一内容下一内容回主目录O返回2022-1-6等温物理变化中的G(1)等温、等压可逆相变的G因为相变过程中不作非膨胀功,edAW ddddApGVV peedd (d ,d0)Wp VV pWp Vp 0上一内容下一内容回主目录O返回2022-1-6等温物理变化中的G(2)等温下,体系从改变到,设11,p V22,p V0fW2112lnlnpVGnRTnRTpV对理想气体:eddd (d )GWp VV pWp V pVd
37、21dppGV p(适用于任何物质)上一内容下一内容回主目录O返回2022-1-6等温化学变化中的G(1)对于化学反应DEFGdefgGrFmDElnlnfgpdep pRTKRTp pGlnlnppRTKRTQ这公式称为 vant Hoff 等温式,也称为化学反应等温式。 是化学反应进度为1mol时的变化值, 是利用vant Hoff 平衡箱导出的平衡常数, 是反应给定的始终态压力的比值。mrGpKpQ上一内容下一内容回主目录O返回2022-1-6等温化学变化中的GrmlnlnppGRTKRTQ (2)若化学反应可安排成可逆电池,其电动势为E,则nEFGrrm0,ppQKG当时,反应正向进行
38、rm0,ppQKG当时,反应处于平衡状态rm0,ppQKG当时,反应不能正向进行上一内容下一内容回主目录O返回2022-1-6211 几个热力学函数间的关系 几个函数的定义式 函数间关系的图示式 四个基本公式 从基本公式导出的关系式 特性函数 Maxwell 关系式 Maxwell 关系式的应用上一内容下一内容回主目录O返回2022-1-6几个函数的定义式 定义式适用于任何热力学平衡态体系,只是在特定的条件下才有明确的物理意义。pVUHpQH )0, 0d(fWp(2)Helmholz 自由能定义式。在等温、可逆条件下,它的降低值等于体系所作的最大功。TSUAmax (d0,AWT 可逆)(1
39、)焓的定义式。在等压、 的条件下,。f0W pHQ上一内容下一内容回主目录O返回2022-1-6几个函数的定义式(3)Gibbs 自由能定义式。在等温、等压、可逆条件下,它的降低值等于体系所作最大非膨胀功。f,max (d0,d0,GWTp 可逆)TSHGpVAG或上一内容下一内容回主目录O返回2022-1-6函数间关系的图示式上一内容下一内容回主目录O返回2022-1-6四个基本公式dQST代入上式即得。dddUT Sp V(1) 这是热力学第一与第二定律的联合公式,适用于组成恒定、不作非膨胀功的封闭体系。 虽然用到了的公式,但适用于任何可逆或不可逆过程,因为式中的物理量皆是状态函数,其变化
40、值仅决定于始、终态。但只有在可逆过程中 才代表,才代表 。dQT SSTdRQdp VeW公式(1)是四个基本公式中最基本的一个。ddUQp V 因为上一内容下一内容回主目录O返回2022-1-6四个基本公式ddddHUp VV pVpSTUdddpVUH因为pVSTHddd所以dddHT SV p(2)上一内容下一内容回主目录O返回2022-1-6四个基本公式TSSTUAddddVpSTUdddTSUA因为dddAS Tp V (3)VpTSAddd所以上一内容下一内容回主目录O返回2022-1-6四个基本公式(4)dddGS TV p 因为TSHGTSSTHGddddpVSTHdddpVT
41、SGddd所以上一内容下一内容回主目录O返回2022-1-6从基本公式导出的关系式VpSTUddd(1)pVSTHddd(2)VpTSAddd(3)pVTSGddd(4)()()VpUHSTS从公式(1),(2)导出()()STpUAVV 从公式(1),(3)导出()()STHGpVp从公式(2),(4)导出()()VpSAGTT 从公式(3),(4)导出上一内容下一内容回主目录O返回2022-1-6特性函数 对于U,H,S,A,G 等热力学函数,只要其独立变量选择合适,就可以从一个已知的热力学函数求得所有其它热力学函数,从而可以把一个热力学体系的平衡性质完全确定下来。(,) US V 这个已
42、知函数就称为特性函数,所选择的独立变量就称为该特性函数的特征变量。:常用的特征变量为:( , ) G T p( , ) A T V(, )S H p ( , )H S p上一内容下一内容回主目录O返回2022-1-6特性函数 例如,从特性函数G及其特征变量T,p,求H,U,A,S等函数的表达式。( , )G T pdddGS TV p 导出:TpGV)()pGTS HGTSUHpVAGpV()pGGTT()()pTGGGTpTp()TGGpp上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式全微分的性质设函数 z 的独立变量为x,y, z具有全微分性质( , )zz x yd
43、() d() dyxzzzxyxyddM xN y()()xyMNyx所以M 和N也是 x,y 的函数22(), ()xyMzNzyx yxx y 上一内容下一内容回主目录O返回2022-1-6利用该关系式可将实验可测偏微商来代替那些不易直接测定的偏微商。 热力学函数是状态函数,数学上具有全微分性质,将上述关系式用到四个基本公式中,就得到Maxwell关系式:()()xyMNyxMaxwell 关系式()()VSpTVS VpSTUddd(1)()()pSTVpSpVSTHddd(2)()()TVSpVTVpTSAddd(3)()()pTSVpTpVTSGddd(4)Maxwell上一内容下一
44、内容回主目录O返回2022-1-6(1)求U随V的变化关系Maxwell 关系式的应用已知基本公式VpSTUddd等温对V求偏微分()()TTUSTpVV上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用()()TVSpVT不易测定,根据Maxwell关系式()TSV所以()()TVUpTpVT只要知道气体的状态方程,就可得到 值,即等温时热力学能随体积的变化值。()TUV上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用()VpnRTV解:对理想气体, /pVnRTpnRTV例1 证明理想气体的热力学能只是温度的函数。所以,理想气体的热力学能只
45、是温度的函数。 ()()VTpTpTUV 0nRTpV上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用 =d ()dVVpCTTpVT知道气体的状态方程,求出 的值,就可计算 值。U()VpTd ()dVVpUCTTpVT 例2 利用 的关系式,可以求出气体在状态变化时的 值。设某气体从P1,V1,T1至P2,V2,T2,求U()TUV ?U解:( ,)UU T Vd() d() dVTUUUTVTV上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用(2)求H 随 p 的变化关系已知基本公式dddHT SV p等温对p求偏微分()()TTHST
46、Vpp不易测定,据Maxwell关系式()TSp()()TpSVpT ()()TpHVVTpT所以只要知道气体的状态方程,就可求得 值,即等温时焓随压力的变化值。()THp上一内容下一内容回主目录O返回2022-1-6, /pVnRTVnRTpMaxwell 关系式的应用解:)()TppVVTHT例1 证明理想气体的焓只是温度的函数。所以,理想气体的焓只是温度的函数。对理想气体,()pVnRTp0nRVTp上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用 =d() dppVCTVTpT知道气体状态方程,求出 值,就可计算 值。()pVTH解:设某气体从P1,V1,T1
47、至 P2,V2,T2 , d() dppVHCTVTpT例2 利用 关系式,求气体状态变化时的 值。 ()THpH( , )HH T pd() d() dpTHHHTpTp上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用 解: 已知)=1 (ppVVTCT例3 利用 的关系式求 。J-T()THp从气体状态方程求出 值,从而得 值,并可解释为何 值有时为正,有时为负,有时为零。()pVTJ-TJ-TJ-T1()TpHCp 上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用(3)求 S 随 P 或V 的变化关系等压热膨胀系数(isobaric t
48、hermal expansirity)定义:1()pVVT则()pVVT根据Maxwell关系式:()()TpSVVpT dSV p () dpVSpT从状态方程求得 与 的关系,就可求 或 。,Vp()TSpS上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用例如,对理想气体()TSnRpp 21dppnRSpp ()pVVT pVnRT,nRp21lnVnRV12lnpnRp上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用(4)Cp与CV的关系()()pVpVHUCCTT根据热力学第一定律()=()pVUpVUTT()()() = ppVU
49、VUpTTT设 ,( ,)UU T Vd() d() dVTUUUTVTV则()()() () pVTpUUUVTTVT保持p不变,两边各除以 ,得:dT上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用 () () ppVTUVCCpVT将式代入式得 () () ppVVpVCCTTT根据应用(1)代入式得()()TVUpTpVT 只要知道气体的状态方程,代入可得 的值。若是理想气体,则pVCCpVCCnR上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用() () ()1VTppVTTpV 运用偏微分的循环关系式则()() () VpTpVp
50、TTV 将式代入式得2() () pVTppVCCTVT 定义膨胀系数 和压缩系数 分别为:11() ()pTVVVTVp 代入上式得:2 pVTVCC上一内容下一内容回主目录O返回2022-1-6Maxwell 关系式的应用2 pVTVCC由式可见:(2)因 总是正值,所以pVCC(3)液态水在 和277.15 K时, 有极小值,这时 ,则 ,所以 。pVCCp$()0pVT0mVpVCC(1)T 趋近于零时,上一内容下一内容回主目录O返回2022-1-6Gibbs-Helmholtz方程表示 和 与温度的关系式都称为Gibbs-Helmholtz方程,用来从一个反应温度的(或 )求另一反应
51、温度时的 (或 )。它们有多种表示形式,例如:rGrAr1()A Tr1()G Tr2()G Tr2()A T2()(4) VAUTTT ()(1) pGGHTT 2()(2) pGHTTT ()(3) VAAUTT 上一内容下一内容回主目录O返回2022-1-6Gibbs-Helmholtz方程()pGST 所以()pGGHTT 根据基本公式dddGS TV p ()pGST 根据定义式GHTS在温度T时,GHTS 公式 的导出()(1) pGGHTT GHST 则上一内容下一内容回主目录O返回2022-1-6Gibbs-Helmholtz方程2()pGHTTT 在公式(1)等式两边各乘 得
52、1T21()pGGHTTT 左边就是 对T微商的结果,则()GT移项得221()pGGHTTTT 公式 的导出2()(2) pGHTTT 移项积分得2d()dpGHTTT知道与T的关系式,就可从 求得 的值。 ,pH C1GT2GT上一内容下一内容回主目录O返回2022-1-6Gibbs-Helmholtz方程根据基本公式dddAS Tp V ()() VVAASSTT 根据定义式AUTS在T温度时AUTS 所以()VAAUTT 公式 的导出()(3) VAAUTT AUST 则上一内容下一内容回主目录O返回2022-1-6在公式(3)两边各乘 得1TGibbs-Helmholtz方程21()
53、VAAUTTT 2()VAUTTT 移项得221()VAAUTTTT 等式左边就是 对T微商的结果,则()AT公式 的导出2()(4) VAUTTT 移项积分得2d()dVAUTTT知道与T的关系式,就可从 求得 的值。,VU C1AT2AT上一内容下一内容回主目录O返回2022-1-62.12 克拉贝龙方程 在一定温度和压力下,任何纯物质达到两相平衡时,蒸气压随温度的变化率可用下式表示:ddpHTT V 为相变时的焓的变化值, 为相应的体积变化值。这就是克拉贝龙方程式(Clapeyron equation)。 变化值就是单组分相图上两相平衡线的斜率。HVTpddVTHTpvapvapdd对于
54、气-液两相平衡VTHTpfusfusdd对于液-固两相平衡克拉贝龙上一内容下一内容回主目录O返回2022-1-6 Clausius-Clapeyron方程 对于气-液两相平衡,并假设气体为1mol理想气体,将液体体积忽略不计,则)/(g)(ddmvapmmvappRTTHTVHTpvapm2dlndHpTRT这就是Clausius-Clapeyron 方程, 是摩尔气化热。mvapH假定 的值与温度无关,积分得: mvapHvapm211211ln()HppRTT这公式可用来计算不同温度下的蒸气压或摩尔蒸发热。上一内容下一内容回主目录O返回2022-1-6Trouton规则(Troutons
55、Rule) Trouton根据大量的实验事实,总结出一个近似规则。vapm-11b85 J KmolHT 这就称为楚顿规则。对极性液体、有缔合现象的液体以及Tb小于150 K的液体,该规则不适用。 即对于多数非极性液体,在正常沸点Tb时蒸发,熵变近似为常数,摩尔蒸发焓变与正常沸点之间有如下近似的定量关系:上一内容下一内容回主目录O返回2022-1-6外压与蒸气压的关系 如果液体放在惰性气体(空气)中,并设空气不溶于液体,这时液体的蒸气压将随着外压的改变而作相应的改变,通常是外压增大,液体的蒸气压也升高。g*meg*g(1)ln()pVppRTp式中 是总压, 是有惰气存在、外压为 时的蒸气压,
56、 是无惰气存在时液体自身的饱和蒸气压。当 时,则 。epgp*gp*egpp*ggppep假设气相为理想气体,则有如下的近似关系:上一内容下一内容回主目录O返回2022-1-62.13 热力学第三定律与规定熵热力学温标热力学第三定律规定熵值上一内容下一内容回主目录O返回2022-1-6 1848年,Kelvin 根据Carnot 定理引入了一种不依赖于测温物质特性的温标,称为热力学温标。 选定水的三相点热力学温度的数值为273.16,并取其的 作为热力学温度的单位,称为Kelvin一度,用符号“K”表示。任何体系的热力学温度都是与之相比较的结果。用公式表示为:1273.16热力学温标 当可逆热
57、机传给热源的热量Qc愈小,其热力学温度愈低。极限情况下,则该热源的热力学温度T等于零,称为绝对零度。0cQch273.16KQTQ上一内容下一内容回主目录O返回2022-1-6热力学第三定律凝聚体系的 和 与T的关系HG1902年,T.W.Richard研究了一些低温下电池反应的 和 与T的关系,发现温度降低时, 和 值有趋于相等的趋势(如图所示)。GHGH0lim()0TGH 用公式可表示为:上一内容下一内容回主目录O返回2022-1-6热力学第三定律上一内容下一内容回主目录O返回2022-1-6热力学第三定律Nernst热定理(Nernst heat theorem)00lim()lim(
58、)0pTTTGST1906年,Nernst经过系统地研究了低温下凝聚体系的反应,提出了一个假定,即这就是Nernst热定理的数学表达式,用文字可表述为:在温度趋近于0K的等温过程中,体系的熵值不变。上一内容下一内容回主目录O返回2022-1-6热力学第三定律并可用数学方法证明,该假定在数学上也是成立的。当 时HG 0KT ()()ppHGTT这个假定的根据是:从Richard得到的 和 与T的关系图,可以合理地推想在T趋向于0K时, 和 有公共的切线,该切线与温度的坐标平行,即:GHGH上一内容下一内容回主目录O返回2022-1-6热力学第三定律(3)“在0 K时,任何完整晶体(只有一种排列方
59、式)的熵等于零。”热力学第三定律有多种表述方式:(2)在温度趋近于热力学温度0 K时的等温过程中,体系的熵值不变,这称为Nernst 热定理。即:0lim()0TTS(1)“不能用有限的手续把一个物体的温度降低到0 K”,即只能无限接近于0 K这极限温度。上一内容下一内容回主目录O返回2022-1-6规定熵值(conventional entropy) 规定在0K时完整晶体的熵值为零,从0K到温度T进行积分,这样求得的熵值称为规定熵。若0K到T之间有相变,则积分不连续。已知TTCSpd)/(d 00(/ )dTpTSSCTTTpTC0lnd上一内容下一内容回主目录O返回2022-1-6用积分法
60、求熵值(1) 以 为纵坐标,T为横坐标,求某物质在40K时的熵值。/pCT如图所示:400(/)dpSCTT 阴影下的面积,就是所要求的该物质的规定熵。上一内容下一内容回主目录O返回2022-1-6用积分法求熵值(2)图中阴影下的面积加上两个相变熵即为所求的熵值。b()d TpTCTT气如果要求某物质在沸点以上某温度T时的熵变,则积分不连续,要加上在熔点(Tf)和沸点(Tb)时的相应熵,其积分公式可表示为:f0( )(0)dTpCS TSTT(固)meltfHTbf()+dTpTCTT液vapbHT上一内容下一内容回主目录O返回2022-1-6规定熵值(conventional entropy
61、)上一内容下一内容回主目录O返回2022-1-6用积分法求熵值(2) 如果以S为纵坐标,T为横坐标,所求得的熵值等于S-T图上阴影下的面积再加上两个相变时的熵变。上一内容下一内容回主目录O返回2022-1-6规定熵值(conventional entropy)上一内容下一内容回主目录O返回2022-1-6RUDOLF JULIUS EMMANUEL CLAUSIUSRUDOLF JULIUS EMMANUEL CLAUSIUS (1822-1888)German mathematical physicist,is perhaps best known for the statement of
62、the second law of thermodynamics in the form “Heat cannot of itself pass from a colder to a hotter body.”which he presented to the Berlin Academy in 1805.He also made fundamental contributions to the field of the knietic theory of gases and anticipated Arrhenius by suggesting that molecules in elect
63、rolytes continually exchange atoms.上一内容下一内容回主目录O返回2022-1-6WILLIAM THOMSON,Lord Kelvin WILLIAM THOMSON,Lord Kelvin (1824-1907) Irish-born British physicist,proposed his absolute scale of temperature,which is independent of the thermometric substance in 1848.In one of his earliest papers dealing with
64、heat conduction of the earth,Thomson showed that about 100 million years ago, the physical condition of the earth must have been quite different from that of today.He did fundamental work in telegraphy , and navigation.For his services in trans-Atlantic telegraphy,Thomson was raised to the peerage,w
65、ith the title Baron Kelvin of Larg.There was no heir to the title,and it is now extinct.上一内容下一内容回主目录O返回2022-1-6NICOLAS LEONHARD SADI CARNOTNICOLAS LEONHARD SADI CARNOT (1796-1832) a French military engineer.His only published work was Reflexions Sur la Puissance Motrice du Feu et sur les Machines Pr
66、opres a Developer catte Puissance (1824),in which he discussed the conversion of heat into work and laid the foundation for the second law of thermodynamics. He was the scion of a distinguished French family that was very active in political and military affairs. His nephew, Marie Francois Sadi Carnot (1837-1894),was the fourth president of the Third French Republic.上一内容下一内容回主目录O返回2022-1-6LUDWIG BOLTZMANN LUDWIG BOLTZMANN (1844-1906),Austrian scientist,is best known for his work in the kinetic t
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
