 高考化学一轮复习 第四单元 氧化还原反应课件 苏教版
高考化学一轮复习 第四单元 氧化还原反应课件 苏教版


《高考化学一轮复习 第四单元 氧化还原反应课件 苏教版》由会员分享,可在线阅读,更多相关《高考化学一轮复习 第四单元 氧化还原反应课件 苏教版(79页珍藏版)》请在装配图网上搜索。
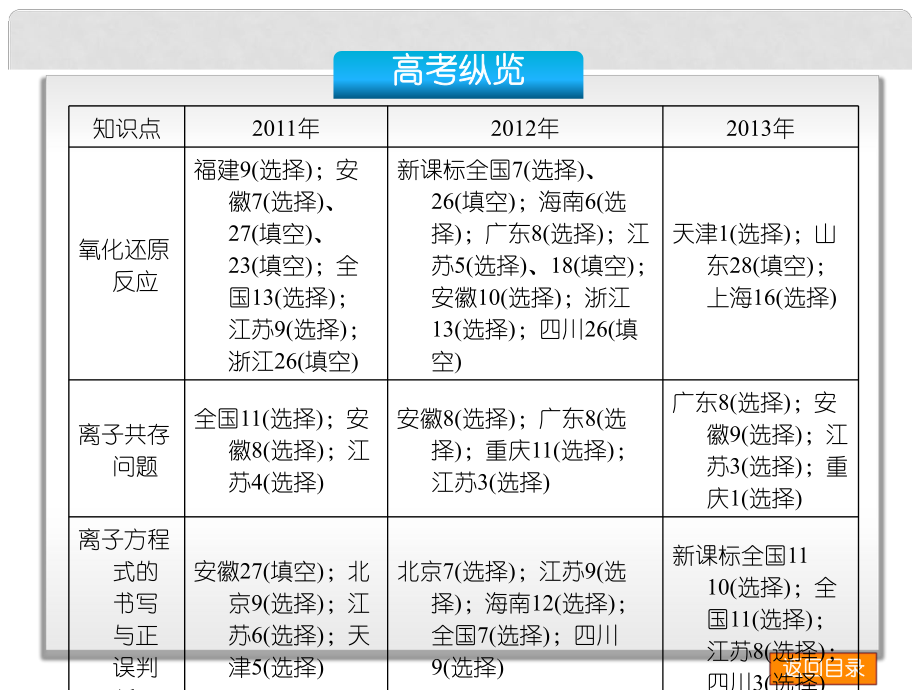
1、返回目录返回目录高考纵览高考纵览知识点2011年2012年2013年氧化还原反应福建9(选择);安徽7(选择)、27(填空)、23(填空);全国13(选择);江苏9(选择);浙江26(填空)新课标全国7(选择)、26(填空);海南6(选择);广东8(选择);江苏5(选择)、18(填空);安徽10(选择);浙江13(选择);四川26(填空)天津1(选择);山东28(填空);上海16(选择)离子共存问题全国11(选择);安徽8(选择);江苏4(选择)安徽8(选择);广东8(选择);重庆11(选择);江苏3(选择)广东8(选择);安徽9(选择);江苏3(选择);重庆1(选择)离子方程式的书写与正误判
2、断安徽27(填空);北京9(选择);江苏6(选择);天津5(选择)北京7(选择);江苏9(选择);海南12(选择);全国7(选择);四川9(选择)新课标全国11 10(选择);全国11(选择);江苏8(选择);四川3(选择)返回目录返回目录高考纵览高考纵览知识点2011年2012年2013年离子的检验与鉴别四川10、11(选择);重庆11(选择);上海13(选择)山东2、8(填空);浙江26(填空)江苏13(选择);浙江13(选择)氯、溴、碘及化合物江苏3(选择);安徽8(选择)、11(选择)、25(填空);海南15(填空) 福建25(填空) ;新课标全国7(选择);广东9(选择);江苏8(选
3、择);山东8(选择);北京26(填空)福建24(填空);四川1(选择);广东33(填空);北京28(填空)钠、镁及其化合物碱金属北京11(选择);全国7、12(选择);重庆7、9(选择)北京7(选择);四川9、10(选择);广东10(选择);江苏7(选择);重庆7(选择);全国12(选择);浙江28(填空)广东23(选择);江苏13(选择);上海11(填空)返回目录返回目录 教学建议教学建议本专题的内容综合性强,难点和易混淆点较多,其中本专题的内容综合性强,难点和易混淆点较多,其中氧化还原反应、离子反应贯穿于中学化学始终,是中学化氧化还原反应、离子反应贯穿于中学化学始终,是中学化学的重要内容之
4、一,考查面广,能以较有深度的综合题形学的重要内容之一,考查面广,能以较有深度的综合题形式考查,有较高的区分度,因此高考基本上年年都考。从式考查,有较高的区分度,因此高考基本上年年都考。从海水中获取的海水中获取的Cl2、Br2、I2、Na、Mg等物质也是中学化学等物质也是中学化学必须掌握的几种物质。必须掌握的几种物质。1氧化还原反应的高考命题除了注重基本概念的考氧化还原反应的高考命题除了注重基本概念的考查外,还出现了将氧化还原反应方程式的配平与物质的分查外,还出现了将氧化还原反应方程式的配平与物质的分析推断结合在一起的题型。因此对于氧化还原反应的复习析推断结合在一起的题型。因此对于氧化还原反应的
5、复习一定要紧扣概念,理清关系,明确概念的内涵与外延,并一定要紧扣概念,理清关系,明确概念的内涵与外延,并能灵活驾驭和运用这些概念解决具体的化学问题。能灵活驾驭和运用这些概念解决具体的化学问题。使用建议使用建议返回目录返回目录2离子反应也是历年高考的命题热点之一。如离子离子反应也是历年高考的命题热点之一。如离子方程式的书写及正误判断、离子的共存问题、离子的检验、方程式的书写及正误判断、离子的共存问题、离子的检验、鉴别与推断,有关离子反应的应用与计算等都是常考点。鉴别与推断,有关离子反应的应用与计算等都是常考点。关于离子方程式的正误判断有以下三个特点:关于离子方程式的正误判断有以下三个特点:(1)
6、所考查的离子反应大多是中学化学教材上的基本反所考查的离子反应大多是中学化学教材上的基本反应,其错因设置主要有:化学式的拆分不当、电荷不守恒、应,其错因设置主要有:化学式的拆分不当、电荷不守恒、产物不合理、忽略了限定条件产物不合理、忽略了限定条件(如溶液的酸碱性、无色透如溶液的酸碱性、无色透明、漏掉部分反应明、漏掉部分反应)等;等;(2)所涉及的化学反应类型大多是复分解反应和一些常所涉及的化学反应类型大多是复分解反应和一些常见的氧化还原反应;见的氧化还原反应;使用建议使用建议返回目录返回目录使用建议使用建议返回目录返回目录 课时安排课时安排本单元建议用本单元建议用10课时完成,其中课时完成,其中
7、6课时用于在课堂上课时用于在课堂上互动式完成第互动式完成第47单元,单元,2课时用于处理各讲的习题讲评,课时用于处理各讲的习题讲评,2课时用于测试和讲评。课时用于测试和讲评。使用建议使用建议返回目录返回目录考点核心突破高考真题体验基础知识巩固返回目录返回目录1了解氧化还原反应的本质是电子的转移。了解氧化还原反应的本质是电子的转移。2了解常见的氧化还原反应。了解常见的氧化还原反应。考试说明考试说明返回目录返回目录考情分析考情分析 一、氧化还原反应的基本概念 1氧化还原反应 (1)概念:有元素_升降的化学反应。 ( 2 ) 特 征 : 反 应 过 程 中 元 素 的_发生了改变。 (3)实质:反应
8、过程中有_转移。返回目录返回目录基础知识巩固第四单元氧化还原反应 化合价化合价 化合价化合价 电子电子返回目录返回目录第四单元第四单元氧化还原反应氧化还原反应基础知识巩固2氧化剂和还原剂的比较氧化剂和还原剂的比较3.氧化还原反应电子转移的表示方法氧化还原反应电子转移的表示方法(以以Cu与稀硝酸与稀硝酸的反应为例的反应为例)(1)双线桥法:双线桥法:_(2)单线桥法:单线桥法:_氧化剂还原剂得失电子_电子_电子化合价变化化合价_化合价_反应类型_反应_反应对应产物_产物_产物降低降低 得得 还原还原 还原还原 失失 升高升高 氧化氧化 氧化氧化 4四种基本反应类型与氧化还原反应的关系 (1)所有
9、的_都是氧化还原反应,所有的_都不是氧化还原反应。 (2)有_参加的化合反应都是氧化还原反应,而有些化合反应不属于氧化还原反应。 (3)有_生成的分解反应都是氧化还原反应,而有些分解反应不属于氧化还原反应。返回目录返回目录基础知识巩固复分解反应复分解反应 置换反应置换反应 单质单质 单质单质 第四单元第四单元氧化还原反应氧化还原反应二、常见的氧化剂和还原剂二、常见的氧化剂和还原剂1常见的氧化剂常见的氧化剂返回目录返回目录基础知识巩固第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录基础知识巩固物质类型举例对应还原产物活泼的非金属单质X2(卤素)_O2_元素处于高化合价时的化合物或离子氧化
10、物MnO2 _含氧酸浓硫酸_HNO3 _ 盐KMnO4_Fe3 _过氧化物Na2O2、H2O2_X H2O、OH Mn2 SO2 NO或或NO2 Mn2 Fe2、Fe H2O 第四单元第四单元氧化还原反应氧化还原反应2.常见的还原剂常见的还原剂(1)活泼的金属单质,如活泼的金属单质,如Na、Mg、Al、Fe等。等。(2)某些活泼的非金属单质,如某些活泼的非金属单质,如H2、C、Si等。等。(3)元素处于低化合价时的物质,如元素处于低化合价时的物质,如CO、Fe2、S2、I等。等。3具有中间价态的物质既有氧化性又有还原性具有中间价态的物质既有氧化性又有还原性返回目录返回目录基础知识巩固具有中间价
11、态的物质还原产物氧化产物Fe2_SO_H2O2_Fe S H2O Fe3 O2第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录基础知识巩固第四单元第四单元氧化还原反应氧化还原反应1判断正误判断正误(正确的用正确的用“”“”表示,错误的用表示,错误的用“”表示表示)。(1) 有单质参加或有单质生成的化学反应一定属于氧有单质参加或有单质生成的化学反应一定属于氧化还原反应化还原反应()返回目录返回目录基础知识巩固第四单元第四单元氧化还原反应氧化还原反应(2)金属最高价阳离子一定具有强氧化性金属最高价阳离子一定具有强氧化性()解析解析 Na虽具有氧化性,但氧化性不强。虽具有氧化性,但氧化性不强
12、。(3)氧化还原反应中有一种元素被氧化时,一定有另一氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原种元素被还原() 解析解析 氧化还原反应中的氧化剂和还原剂可以氧化还原反应中的氧化剂和还原剂可以是同一种物质,如是同一种物质,如Cl22NaOH=NaClNaClOH2O。 (4)氧化还原反应中的反应物,不是氧化剂就是还原剂氧化还原反应中的反应物,不是氧化剂就是还原剂()解析解析 反应反应Cl22NaOH=NaClNaClOH2O中的中的NaOH既不是氧化剂又不是还原剂。既不是氧化剂又不是还原剂。 (5)某元素从化合态变为游离态,该元素可能被氧化也某元素从化合态变为游离态,该元素可能被氧
13、化也可能被还原可能被还原()解析解析 如反应如反应2H2O 2H2O2中氧元素化合中氧元素化合价升高,被氧化,而氢元素化合价降低,被还原。价升高,被氧化,而氢元素化合价降低,被还原。返回目录返回目录基础知识巩固第四单元第四单元氧化还原反应氧化还原反应(6)H2O作为氧化剂时,产物中一般有作为氧化剂时,产物中一般有O2生成,生成,H2O作作为还原剂时,产物中一般有为还原剂时,产物中一般有H2生成生成()解析解析 H2O中中H为为1价,价,O为为2价,价,H2O作为作为氧化剂时,有氧化剂时,有H2生成,生成,H2O作为还原剂时,有作为还原剂时,有O2生成。生成。 返回目录返回目录基础知识巩固第四单
14、元第四单元氧化还原反应氧化还原反应22014东营质检东营质检 将磁性氧化铁放入稀硝酸中可发将磁性氧化铁放入稀硝酸中可发生如下反应:生如下反应:3Fe3O428HNO3=9Fe(NO3)xNO14H2O,下列判断合理的是,下列判断合理的是()AFe(NO3)x中的中的x为为2B稀硝酸在反应中只表现氧化性稀硝酸在反应中只表现氧化性C反应中每还原反应中每还原0.4 mol氧化剂,就有氧化剂,就有1.2 mol电子转电子转移移D磁性氧化铁中的所有铁元素全部被氧化磁性氧化铁中的所有铁元素全部被氧化返回目录返回目录基础知识巩固第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录基础知识巩固 C解析解析
15、 依据化合价守恒可知,依据化合价守恒可知,1 mol HNO3中的中的氮元素在反应中总共降低氮元素在反应中总共降低3价,所以价,所以Fe元素的化合价总共元素的化合价总共升高升高3价,价,1 mol Fe3O4中铁元素化合价应升高中铁元素化合价应升高1价,所以价,所以反应后反应后Fe的化合价均为的化合价均为3价,价,A项错误、项错误、C项正确;项正确;Fe3O4中有中有3价的铁,价的铁,D项错误。项错误。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录基础知识巩固32013聊城模拟聊城模拟 过氧化氢俗名双氧水,医疗上利用过氧化氢俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。回答下列关
16、于双氧水的问它杀菌消毒的作用来清洗伤口。回答下列关于双氧水的问题:题:ANa2O22HCl=2NaClH2O2BAg2OH2O2=2AgO2H2OC2H2O2=2H2OO2D3H2O2Cr2(SO4)310KOH=2K2CrO43K2SO48H2O( 1 ) 上 述 反 应 中 ,上 述 反 应 中 , H2O2仅 体 现 氧 化 性 的 反 应 是仅 体 现 氧 化 性 的 反 应 是_(填序号,下同填序号,下同),H2O2既体现氧化性又体现还原既体现氧化性又体现还原性的反应是性的反应是_。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录基础知识巩固(2)保存过氧化氢的试剂瓶上最适合
17、贴上的一个标签是保存过氧化氢的试剂瓶上最适合贴上的一个标签是_(填序号填序号)。图图41第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录基础知识巩固第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录基础知识巩固第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录基础知识巩固第四单元第四单元氧化还原反应氧化还原反应 考点一氧化还原反应的三大基本规律及应用 1守恒规律 得失电子守恒:氧化还原反应中,氧化剂得到的电子总数等于还原剂失去的电子总数。 2转化规律 (1)内容:同种元素不同价态之间发生氧化还原反应时,其反应规律可总结为:价态相邻能共存,价态相间能归中;归中价态不交叉,低升
18、高降只靠拢。考点核心突破返回目录返回目录第四单元第四单元氧化还原反应氧化还原反应考点核心突破返回目录返回目录 (2)应用应用 运用转化规律可判断氧化还原反应能否进行及反应运用转化规律可判断氧化还原反应能否进行及反应产物。产物。第四单元第四单元氧化还原反应氧化还原反应 3难易规律 (1)优先规律氧化性(还原性)强者优先反应: 一种氧化剂同时和几种还原剂相遇时,还原性最强的物质优先发生反应(先强后弱)。一种还原剂与多种氧化剂相遇时,氧化性最强的物质优先发生反应(先强后弱)。 (2)应用:判断物质的稳定性及反应的先后顺序。返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应返回目录返
19、回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 变式今有下列三个氧化还原反应:2FeCl32KI=2FeCl22KClI2,2FeCl2Cl2=2FeCl3,2KMnO416HCl(浓)=2KCl2MnCl28H2O5Cl2。若某溶液中有Fe2、I、Cl共存,要将I氧化除去而不氧化Fe2和Cl,则可加入的试剂是() ACl2 BKMnO4 CFeCl3 DHCl返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 C解析 由知氧化性Fe3I2,还原性IFe2;由知氧化性Cl2Fe3,还原性Fe2Cl
20、;由知氧化性MnOCl2,还原性ClMn2。由此推知氧化性强弱顺序为KMnO4Cl2FeCl3I2,还原性强弱顺序为IFe2ClMn2。所以KMnO4可氧化Cl、Fe2及I,Cl2可氧化Fe2及I,FeCl3只氧化I。返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 考点二物质氧化性、还原性强弱比较的常用方法 1依据反应原理 (还原性强)(氧化性强) (氧化性较弱) (还原性较弱) 氧化性:氧化剂氧化产物;还原性:还原剂还原产物 返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 2依据金属、非金属的活动性顺序返回目录返回目录考点核心突破第四单元第四单元氧
21、化还原反应氧化还原反应 3依据元素周期表 返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 4依据电化学原理 (1)原电池原理 一般情况下,两种不同的金属构成原电池的两极,其还原性:负极正极。 (2)电解池原理 用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破 A解析解析 反应反应氧化剂为氧化剂为B2
22、,氧化产物为,氧化产物为A2,氧化性:氧化性:B2A2;反应;反应D能置换出能置换出H2O中的氢,说明中的氢,说明D为活泼金属,为活泼金属,D2的氧化性非常弱;反应的氧化性非常弱;反应由电极反应由电极反应知知B为原电池负极,所以金属活动性为原电池负极,所以金属活动性BE,氧化性,氧化性E2B2;正极反应为;正极反应为E22e=E,说明阳离子氧化性,说明阳离子氧化性E2H。因此氧化性强弱顺序为。因此氧化性强弱顺序为E2B2A2D2,A项正确;项正确;中还原产物为中还原产物为B,中氧化剂为中氧化剂为H2O, B项错项错误;若发生反应误;若发生反应EA2AE2,则氧化性:,则氧化性:A2E2,与题干
23、事实不符,所以该反应不能进行,与题干事实不符,所以该反应不能进行,C项错误;项错误;虽然虽然D比比A活泼,但活泼,但D能与能与H2O反应,所以不能用反应,所以不能用D来置来置换溶液中的换溶液中的A2 ,D项错误。项错误。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应实验实验实验将铁钉放入硫酸铜溶液中向硫酸亚铁溶液中滴入几滴浓硝酸将铜丝放入氯化铁溶液中返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 【教师备用习题】 2013苏州检测 硫氰(SCN
24、)2的化学性质和卤素(X2)类似,称为拟卤素,如(SCN)2H2O=HSCNHSCNO,它们的阴离子的还原性强弱为ClBrSCNI。下列说法不正确的是() ACl2可以与KSCN溶液反应 B(SCN)2可以与KI溶液反应 CKSCN溶液可以与FeCl3溶液反应 D(SCN)2可以与KBr溶液反应 解析 D阴离子的还原性强弱顺序为ClBrSCNBr2(SCN)2I2,故(SCN)2不能将Br氧化,D错误。返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 考点三氧化还原反应方程式的有关计算 1氧化还原反应方程式配平四技巧 (1)正向配平法:适合反应物分别是氧化剂、还原剂的反应,
25、配平按以下5步进行。 返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 (2)逆向配平法:适用于一种元素的化合价既升高又降低的反应和分解反应中的氧化还原反应。先确定生成物的化学计量数,然后再确定反应物的化学计量数。 例如: 由于S的化合价既升又降,而且升降总数要相等,所以K2S的化学计量数为2,K2SO3的化学计量数为1,然后确定S的化学计量数为3。返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 (3)奇数配偶法:适用于物质种类少且分子组成简单的氧化还原反应。 如SCKNO3CO2N2
26、K2S,反应物KNO3中三种元素原子数均为奇数,而生成物中三种元素的原子数均为偶数,故可将KNO3乘以2,然后用观察法配平得:S3C2KNO3=3CO2N2K2S。返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 (4)缺项配平:对于化学反应方程式,所缺物质往往是酸、碱或水;如果是离子方程式,所缺物质往往是H、OH或水。可以根据质量守恒先写出所缺物质,再用其他守恒法配平。如果无法确定所缺物质,可先依据元素化合价的升降相等原则将已知的物质配平,然后再根据质量守恒确定所缺物质的化学式及化学计量数。 提醒 特殊氧化还原反应中电子转移数目的分析 特殊物质中元素的化合价,如H2O2、
27、Na2O2中的氧元素、FeS2中的硫元素的化合价均为1。返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破 例例32012上海卷上海卷 二氧化硒二氧化硒(SeO2)是一种氧化剂,是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓或浓H2SO4反应生成反应生成SeO2以回收以回收Se。完成下列填空:。完成下列填空: (1)Se和浓和浓HNO3反应的还原产物为反应的还原产物为NO和和NO2,且,且NO和和NO2的物质的量之比为的物质的量之比为1 1,写出,写出Se和浓和浓HNO3反应的
28、反应的化学方程式:化学方程式:_。 (2)回收得到的回收得到的SeO2的含量,可以通过下面的方法测定:的含量,可以通过下面的方法测定: SeO2KIHNO3SeI2KNO3H2O第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破 I22Na2S2O3Na2S4O62NaI 配平方程式配平方程式,标出电子转移的方向和数目。,标出电子转移的方向和数目。 (3)实验中,准确称量实验中,准确称量SeO2样品样品0.150 0 g,消耗了,消耗了0.200 0 mol/L的的Na2S2O3溶液溶液25.00 mL,所测定的样品中,所测定的样品中SeO2的质量分数为的质量分数为_。第四单
29、元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破 答案答案(1)Se2HNO3(浓浓)=H2SeO3NONO2 (2)SeO24KI4HNO3=Se2I24KNO32H2O (3)92.5% 解析解析 (1)硒被浓硝酸氧化后的产物是硒被浓硝酸氧化后的产物是SeO2,根据硝,根据硝酸的还原产物是酸的还原产物是NO和和NO2且物质的量之比为且物质的量之比为1 1可以写可以写出反应的化学方程式。出反应的化学方程式。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破(2)反应中反应中SeO2被还原成被还原成Se,Se元素的化合价由元素的化合价由4价价变成变成0价,价,K
30、I被氧化成被氧化成I2,I元素的化合价由元素的化合价由1价变成价变成0价,最小公倍数是价,最小公倍数是4,因此,因此SeO2与与Se的化学计量数均为的化学计量数均为1,KI的化学计量数为的化学计量数为4,I2的化学计量数为的化学计量数为2,根据元素守,根据元素守恒配平其他的物质。恒配平其他的物质。(3)根据根据(2)题配平后的反应方程式,找出题配平后的反应方程式,找出SeO2与与Na2S2O3的关系为:的关系为:SeO24Na2S2O3,根据消耗,根据消耗Na2S2O3的量可的量可以确定参加反应的以确定参加反应的SeO2的量。的量。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核
31、心突破第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应 【教师备用习题】 12013高密检测 金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为() aTiO2bCl2cC aTiCl4cCO TiCl42Mg Ti2MgCl2 关于反应、的分析不正确的是() TiCl4在反应中是还原产物,在反应中是氧化剂; C、Mg在两个反应中均为还原剂,被还原; 在反应、中Mg的还原性大于C的,C的还原性大于TiCl4的;返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应a1,bc2;
32、每生成19.2 g Ti,反应、中共转移4.8 mol e。ABC D返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应解析 D反应中,Cl从0价降到1价,每反应1 mol Cl2转移2 mol e,C从0价升到2价,每反应1 mol C转移2 mol e,配平方程式有a1,bc2,正确;根据化合价的变化情况,TiCl4在反应中是还原产物,在反应中是氧化剂,正确;还原剂被氧化,错误;在同一反应中,还原剂的还原性最强,但Mg和C不在同一反应中,无法判断其还原性相对大小,错误;反应中,Ti由4价降到0价,每生成1 mol Ti(即48 g)转移4 mol e,故每生成19.2 g
33、 Ti(即0.4 mol)转移1.6 mol e,结合反应每生成0.4 mol TiCl4转移1.6 mol e,反应、中共转移3.2 mol e,错误。返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应2已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:(1)该反应中,化合价升高的反应物是_,化合价没有发生变化的反应物是_。(2)写出一个包含上述七种物质的氧化还原反应方程式(不需配平) _。(3)上述反应中,氧化剂是_,1 mol氧化剂在反应中_(
34、填“得到”或“失去”)_mol电子。(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_。返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应答案 (1)KClH2SO4(2)KMnO4KClH2SO4K2SO4MnSO4Cl2H2O(3)KMnO4得到5(4)NaBiO3具有强氧化性(比KMnO4氧化性强)返回目录返回目录考点核心突破第四单元第四单元氧化还原反应氧化还原反应高考真题体验 12013上海卷上海卷 已知氧化性已知氧化性Br2Fe3。FeBr2溶液溶液中通入一定量的中通入一定量的Cl2,发生反应的离子方程式为,发生反应的离子方程
35、式为aFe2bBrcCl2dFe3eBr2fCl。下列选项中的数字与离。下列选项中的数字与离子方程式中的子方程式中的a、b、c、d、e、f一一对应,其中不符合反应一一对应,其中不符合反应实际的是实际的是()A243226B021012C201202 D222214B解析解析 根据题意,根据题意,Cl2先氧化先氧化Fe2,不可能只氧化,不可能只氧化Br,B选项错误。选项错误。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录返回目录返回目录高考真题体验2(双选双选)2013上海卷上海卷 汽车剧烈碰撞时,安全气囊中汽车剧烈碰撞时,安全气囊中发生反应发生反应10NaN32KNO3=K2O5Na
36、2O16N2。若氧。若氧化产物比还原产物多化产物比还原产物多1.75 mol,则下列判断正确的是,则下列判断正确的是()A生成生成40.0 L N2(标准状况标准状况)B有有0.250 mol KNO3被氧化被氧化C转移电子的物质的量为转移电子的物质的量为1.25 molD被氧化的被氧化的N原子的物质的量为原子的物质的量为3.75 mol第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验CD解析解析 根据反应方程式可知,每当生成根据反应方程式可知,每当生成16 mol N2,则氧化产物比还原产物多则氧化产物比还原产物多14 mol。转移电子的物质的量为。转移电子的物质的量为1
37、0 mol,被氧化的,被氧化的N原子的物质的量为原子的物质的量为30 mol,有,有2 mol KNO3被还原,现氧化产物比还原产物多被还原,现氧化产物比还原产物多1.75 mol,则生成,则生成2 mol N2,转移电子的物质的量为,转移电子的物质的量为1.25 mol,被氧化的,被氧化的N原子原子的物质的量为的物质的量为3.75 mol,因此,因此,C、D正确。正确。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验 3下列说法或设计错误的是下列说法或设计错误的是()A(2010安徽卷安徽卷)储氢原理可表示为储氢原理可表示为Li2NHH2=LiNH2LiH,该反应中,该反
38、应中H2既是氧化剂又是还原剂既是氧化剂又是还原剂 B(2011江苏卷江苏卷)石灰乳与石灰乳与Cl2的反应中,的反应中,Cl2既是氧化既是氧化剂又是还原剂剂又是还原剂C(2011安徽卷安徽卷)高效火箭推进剂高效火箭推进剂N(NO2)3既有氧化性既有氧化性又有还原性又有还原性 D(2012江苏卷江苏卷)SO2具有氧化性,可用于漂白纸浆具有氧化性,可用于漂白纸浆第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验 D解析解析 LiNH2中氢元素的化合价为中氢元素的化合价为1价,在价,在LiH中氢元素的化合价为中氢元素的化合价为1价,在该反应中氢元素的化合价既价,在该反应中氢元素的化合
39、价既升高又降低,因此升高又降低,因此H2既是氧化剂又是还原剂,既是氧化剂又是还原剂,A项正确;项正确;2Ca(OH)22Cl2=CaCl2Ca(ClO)22H2O,Cl2中中Cl元元素的化合价既升高又降低,所以素的化合价既升高又降低,所以Cl2既是氧化剂又是还原剂,既是氧化剂又是还原剂,B项正确;项正确;N(NO2)3中氮元素的化合价不是最高价,中氮元素的化合价不是最高价,3价氮价氮元素的化合价既可以升高,也可以降低,元素的化合价既可以升高,也可以降低,C项正确;项正确;SO2可可漂白纸浆,体现出漂白纸浆,体现出SO2的漂白性,的漂白性,D项错误。项错误。第四单元第四单元氧化还原反应氧化还原反
40、应返回目录返回目录高考真题体验 42012广东卷广东卷 下列应用不涉及氧化还原反应的是下列应用不涉及氧化还原反应的是()ANa2O2用作呼吸面具的供氧剂用作呼吸面具的供氧剂B工业上电解熔融状态的工业上电解熔融状态的Al2O3制备制备AlC工业上利用合成氨实现人工固氮工业上利用合成氨实现人工固氮D实验室用实验室用NH4Cl和和Ca(OH)2制备制备NH3第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验 D解析解析 A项,呼吸面具中的过氧化钠通过与项,呼吸面具中的过氧化钠通过与CO2和和H2O反应来提供氧气,发生的反应是氧化还原反应。反应来提供氧气,发生的反应是氧化还原反应。B
41、项,项,电解氧化铝制备金属铝,反应中有单质生成,是氧化还原电解氧化铝制备金属铝,反应中有单质生成,是氧化还原反应。反应。C项中的反应是合成氨反应,氮气与氢气反应生成氨项中的反应是合成氨反应,氮气与氢气反应生成氨气,是氧化还原反应。气,是氧化还原反应。D项是用铵盐与碱加热制氨气,属复项是用铵盐与碱加热制氨气,属复分解反应。分解反应。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验 62013山东卷山东卷 金属冶炼与处理常涉及氧化还原反金属冶炼与处理常涉及氧化还原反应。应。(1)由下列物质冶炼相应金属时采用电解
42、法的是由下列物质冶炼相应金属时采用电解法的是_。aFe2O3 bNaCl cCu2S dAl2O3(2)辉铜矿辉铜矿(Cu2S)可发生反应:可发生反应:2Cu2S2H2SO45O2=4CuSO42H2O,该反应的还原剂是,该反应的还原剂是_。当。当1 mol O2发生反应时,还原剂所失电子的物质的量为发生反应时,还原剂所失电子的物质的量为_mol。向。向CuSO4溶液中加入镁条时有气体生成,该溶液中加入镁条时有气体生成,该气体是气体是_。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验 (3)图图42为电解精炼银的示意图,为电解精炼银的示意图,_(填填“a”或或“b”)极为
43、含有杂质的粗银,若极为含有杂质的粗银,若b极有少量红棕色气体产生,极有少量红棕色气体产生,则生成该气体的电极反应式为则生成该气体的电极反应式为_。图图42(4)为处理银器表现的黑斑为处理银器表现的黑斑(Ag2S),将银器浸于铝质容,将银器浸于铝质容器里的食盐水中并与铝接触,器里的食盐水中并与铝接触,Ag2S转化为转化为Ag,食盐水的作,食盐水的作用是用是_。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验第四单元第四单元氧化还原反应氧化还原
44、反应返回目录返回目录高考真题体验第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验 8(1)2012福建卷节选福建卷节选 元素元素X、Y在周期表中位于在周期表中位于同一主族,化合物同一主族,化合物Cu2X和和Cu2Y可发生如下转化可发生如下转化(其中其中D是纤是纤维素水解的最终产物维素水解的最终产物):Cu2Y与过量浓硝酸反应有红棕色气体生成,化学方程与过量浓硝酸反应有红棕色气体生成,化学方程式为式为_。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验 (2)2013福建卷节选福建卷节选 纤维素还原法制纤维素还原法制ClO2是一种是一种新方法,其原理是纤维
45、素水解得到的最终产物新方法,其原理是纤维素水解得到的最终产物D与与NaClO3反应生成反应生成ClO2。完成反应的化学方程式:。完成反应的化学方程式:(D)24NaClO312H2SO4= ClO2 CO218H2O _ClO2和和Cl2均能将电镀废水中的均能将电镀废水中的CN氧化为无毒的物氧化为无毒的物质,自身被还原为质,自身被还原为Cl。处理含。处理含CN相同量的电镀废水,所相同量的电镀废水,所需需Cl2的物质的量是的物质的量是ClO2的的_倍。倍。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验 答案答案 (1)Cu2O6HNO3(浓浓)=2Cu(NO3)22NO23
46、H2O2.5第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验 解析解析 (1)悬浊液与悬浊液与D溶液溶液(葡萄糖溶液葡萄糖溶液)生成砖红色沉生成砖红色沉淀氧化亚铜,则淀氧化亚铜,则Y为氧元素,为氧元素,X、Y同主族,则同主族,则X为硫元素。为硫元素。Cu2Y与过量浓硝酸反应有红棕色气体生成,即与过量浓硝酸反应有红棕色气体生成,即1价铜被价铜被氧化为氧化为2价,而浓硝酸被还原生成的红棕色气体是价,而浓硝酸被还原生成的红棕色气体是NO2,综合得失电子守恒和质量守恒,可配平方程式为综合得失电子守恒和质量守恒,可配平方程式为Cu2O6HNO3(浓浓)=2Cu(NO3)22NO23H
47、2O。第四单元第四单元氧化还原反应氧化还原反应返回目录返回目录高考真题体验(2)纤维素水解得到的最终产物纤维素水解得到的最终产物D为葡萄糖,根据元为葡萄糖,根据元素守恒可知,产物还有素守恒可知,产物还有Na2SO4,依据氧化还原反应电子守,依据氧化还原反应电子守恒进行配平,反应的化学方程式为恒进行配平,反应的化学方程式为C6H12O624NaClO312H2SO4=24ClO26CO218H2O12Na2SO4。ClO2中的中的Cl元素是元素是4价,价,1 mol ClO2被还原为被还原为Cl,得,得到到5 mol e,Cl2中中Cl元素是元素是0价,价,1 mol Cl2被还原为被还原为Cl,得到得到2 mol e,处理含,处理含CN相同量的电镀废水,反应过程相同量的电镀废水,反应过程中转移的电子数相同,所需中转移的电子数相同,所需Cl2的物质的量是的物质的量是ClO2的的2.5倍。倍。第四单元第四单元氧化还原反应氧化还原反应
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
