 2020届高三高考化学一轮专题练习卷:沉淀溶解平衡
2020届高三高考化学一轮专题练习卷:沉淀溶解平衡


《2020届高三高考化学一轮专题练习卷:沉淀溶解平衡》由会员分享,可在线阅读,更多相关《2020届高三高考化学一轮专题练习卷:沉淀溶解平衡(22页珍藏版)》请在装配图网上搜索。
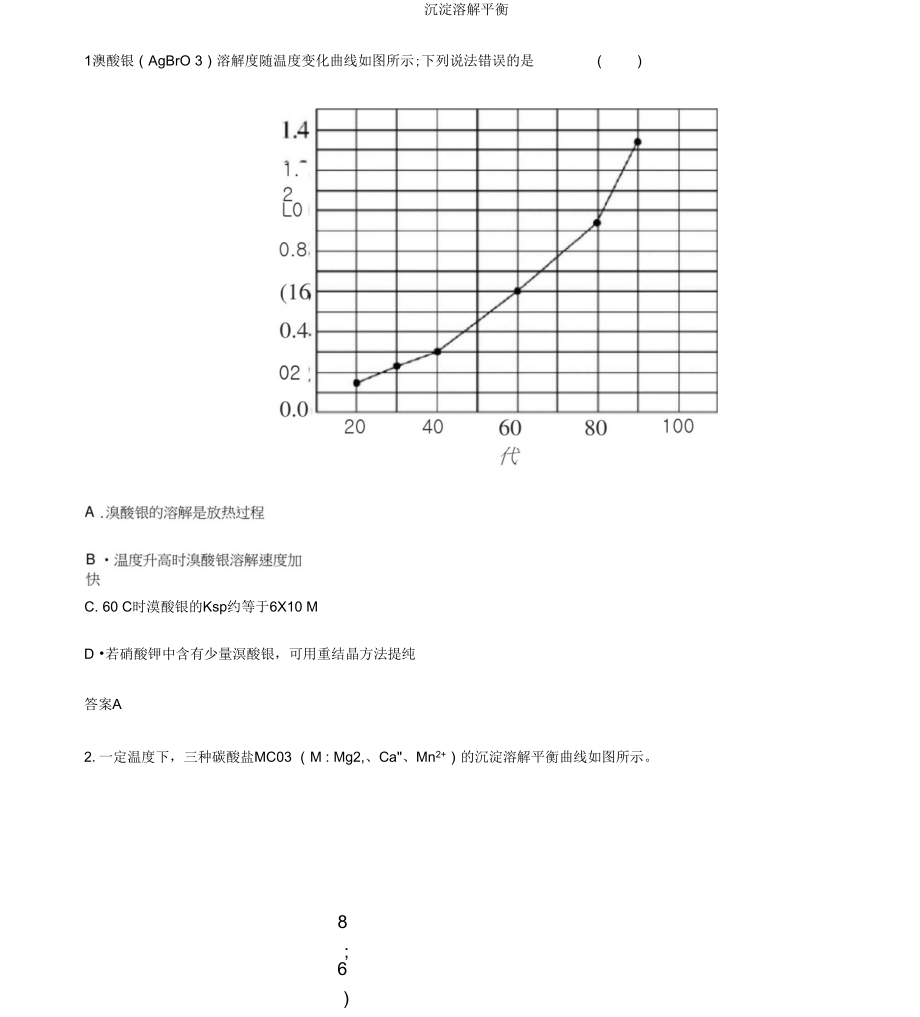
1、沉淀溶解平衡1澳酸银(AgBrO 3)溶解度随温度变化曲线如图所示;下列说法错误的是()C. 60 C时漠酸银的Ksp约等于6X10 MD 若硝酸钾中含有少量溟酸银,可用重结晶方法提纯答案A2.一定温度下,三种碳酸盐MC03 (M : Mg2,、Ca、Mn2+)的沉淀溶解平衡曲线如图所示。8;6)JF卜 Jd9Wr 4-i,|什4、M1CrrL3rX/FVk126 8 1(1p(c()r)已知:pM =- lg c(M), p(CO 亍)=Ig c(COs)。下列说法正确的是()A . MgCOs、CaCOs、MnCO 3 的 K$p 依次增大B. a点可表示MnCO 3的饱和溶液,且c(Mn
2、)二c(COs)C. b点可表示CaCO3的饱和溶液,且c(Ca2+) c(COh/(mol L-)A . x的数值为2X1(PB. c点时有碳酸钙沉淀生成C. b点与d点对应的溶度积相等D .加入蒸储水可使溶液由d点变到a点答案D-10,124. 25 c 时,Ksp(AgCI) = 1.56/RO , KsP(Ag 2CQ4)= 9.0 X0 ,下歹 U说法正确的是(A .向同浓度的Na2CrO4和NaCI混合溶液中滴加AgNO 3溶液,AgCI先析出B .向AgCI饱和溶液中加入NaCI晶体,有AgCI析出且溶液中c(C)二c(Ag十)c. AgCI和Ag2CrO4共存的悬浊液中,c(C
3、I )1.56 &2 - =12c(CrO4 ) 9.0 X0D .向Ag2CrO4悬浊液中加入NaCI浓溶液,AgzCrO,不可能转化为AgCI答案A5关于沉淀溶解平衡和溶度积常数,下列说法不正确的是()A .将饱和Na2s。4溶液加入到饱和石灰水中,有白色沉淀产生,说明 KspCa(OH)2大于KsP(CaSO4)B. Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关C.已知 25c 时,KsPFe(OH)3 = 4.038,该温度下反应 Fe(OH)3+ 3H +Fe3+ 3H2O 的平衡常数 K= 4.0 X04D .已知25c时,KspMg(OH)2 = 1.810,在
4、MgCI 2溶液中加入氨水,测得混合液的pH=11,则溶液中的2+-5-1c(Mg )= 1.8 10 mol L答案A6除了酸以外,某些盐也能溶解沉淀。利用下表三种试剂进行试验,相关分析不正确的是()编号分散质Mg(OH) 2HCINH4cl备注悬浊液1 mol L 1-11 mol LA 向中加入酚猷显红色说明物质的不溶性”是相对的B .分别向少量Mg(OH)2沉淀中加入适量等体积、均能使沉淀快速彻底溶解C.、混合后发生反应:Mg(OH)2(s)+ 2NH4 Mg2+ + 2NH3H2OD 向中加入,c(OH 一)减小,Mg(OH) 2溶解平衡正向移动答案B7 将足量的Agl分别放入下列物
5、质中,Agl的溶解度由大到小的排列顺序是()-1-1-1 5 mL 0.001 mol L KI 溶液 15 mL 0.002 mol L - Cab 溶液(3)35 mL 0.003 mol L HI 溶液 15 mL 蒸储水(5)45 mL 0.005 mol L 1 AgNO 3 溶液A .,B .皿,D .,C.,8. 25 c 时,在 BaSO4 的饱和溶液中存在:BaSO4(s)? Ba2+(aq) + So4- (aq), KsP= 1.1025 XIO-。,在该温度下有关BaSO4的溶度积和溶解平衡的叙述正确的是 ()A ,向 c(SO2 )= 1.05 TO 5 mol L1
6、 的 BaS04 溶液中加入 BaS04 固体,c(SO)增大C.向该饱和溶液中加入B.向该饱和溶液中加入Ba(NO 3)2固体,则BaSO4的溶度积常数增大Na2s04固体,则该溶液中c(BaH) c(SO2 )D .向该饱和溶液中加入 答案DBaCb固体,则该溶液中c(SO4)减小答案B9. 已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水:加入少量生石灰后恢复到原来温度;降低温度。这两种情况下,前后均保持不变的是 ()A.溶质的物质的量B. Ca(0H)2的溶解度C.溶液中Ca2的数目D 溶液中溶质的质量分数答案D+-1010 .已知:pAg =-lgc(Ag ) ,
7、 Ksp(AgCI) = 1.56 10如图是向10 mL AgNO 3溶液中逐渐加入0.1 mol L1的NaCI溶液时,溶液的pAg随着加入NaCI溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是提示:Ksp(AgCI) KsP(Agl)(A .原AgNO 3溶液的物质的量浓度为0.1 mol L 1B .图中x点的坐标为(100,6)C.图中x点表示溶液中Ag*恰好完全沉淀D .把0.1 mol L 的NaCI换成0.1 mol L Nai则图象在终点后变为虚线部分11 对某难溶电解质AnBm的饱和溶液中,下列说法正确的是()A 加水,它的溶度积减小、溶解度增大B
8、升高温度,它的溶解度和溶度积都增大C.饱和溶液中:c(Am*) = c(B”)D .加水,它的溶度积、溶解度均不变答案D12 已知几种硫化物的溶度积常数如下表所示:化学式FeSCuSMnSHgSKsp.186.3 10-361.3 XO.132.5 10.536.4 10F列离子方程式正确的是()2+2 +A . FeS(s)+ Hg2 (aq)=HgS(s) + Fe2 (aq)B.c.CuS(s) + Fe (aq)=FeS(s) + Cu (aq)HgS(s) + Cu (aq)=CuS(s) + Hg (aq)2+ 2 +D . HgS(s) + Mn (aq)=MnS(s) + Hg
9、 (aq)答案A13.KsP(Ag2CrO4)= 2.0 10中,Ag +浓度大小顺序正确的是(10- 16已知:Ksp(AgCI)= 1.8X0,则在下列难溶盐的饱和溶液)-12,Ksp(Agl) = 1.5 XO,A . AgCIAglAg 2CQ4B. AgCIAg 2CrO4AglC. Ag2CrO4AgCIAglD. Ag 2CrO4AglAgCI14.答案C卜列有关沉淀溶解平衡的说法正确的是()Ksp(AgCI)增大A .在AgCI的沉淀溶解平衡体系中,加入蒸储水,B .在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动C ,可直接根据KsP的数值大小比较难溶物在水中的溶解度
10、大小D . 25 c时,Ksp(AgCI) KsP(Agl) 向AgCI悬浊液中加入KI固体,有黄色沉淀生成答案D15. 有关CaC03的溶解平衡的说法中,不正确的是()A . CaC03沉淀析出和沉淀溶解不断进行,但速率相等B. CaC03难溶于水,其饱和溶液几乎不导电,属于弱电解质溶液C.升高温度,CaC03的溶解度增大D .向CaC03沉淀中加入纯碱固体,CaC03的溶解量降低答案B16 .下列说法不正确的是()A . Ksp只与难溶电解质的性质和温度有关B .由于Ksp(ZnS)Ksp(CuS),所以ZnS在一定条件下可转化为CuSC.其他条件不变,离子浓度改变时,Ksp不变D .两种
11、难溶电解质作比较时,Ksp越小的电解质,其溶解度一定越小答案D17 .已知某学习小组设计一组实验探究沉淀溶解平衡:实验I:已知常温下同物质的量浓度的醋酸和氨水,其电离程度相等。在氢氧化镁悬浊液中存在沉淀溶解平衡:2+-Mg(OH) 2(s) Mg (aq) + 20H (aq),在悬浊液中加入饱和氯化镂溶液,悬浊液变澄清。实验n:已知几种铅的化合物溶解度和颜色如下:化合物PbSO4PbC03PbS常温下溶解度/g1.0101,80-141.80固体颜色白色白色黑色取10 mL硝酸铅溶液滴加0.1 mol L的硫酸钠溶液产生沉淀一4,在固体混合物中继续滴加一0.1 mol L的NazCOs溶液搅
12、拌,产生沉淀B,继续在固体混合物中滴加0.1 mol L硫化钠溶液产生沉淀Co根据上述实验回答下列问题:(1)甲同学对实验I的浊液变澄清,提出两种假设:假设1 :氯化镂水解,溶液中H*结合0H,促进沉淀溶解平衡向右移动;为了证明上述假设,可在氢氧化镁悬浊液中加入下列试剂A . NH4HSO4B, CH3COONH4C. FeCbD. HCI(2)根据实验n回答:在这三种铅的化合物中,溶度积大小顺序为 乙同学根据实验得出结论:若沉淀甲转化为沉淀乙,则沉淀甲的溶度积一定大于沉淀乙的溶度积。你认为该 观点是否科学? (填科学”或不科学”,简述理由答案(1)B(2)Ksp(PbS)vKsp(PbCO3
13、)vKsp(PbSO4)不科学对于溶度积相差不大的沉淀,通过浓度控制,可使溶度积小的沉淀少 量的转化成溶度积较大的沉淀18.某自来水中含有Ca2*、Mg4、Na+ KS HCO3、SO-、C,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质在20 C时的溶解度数锅炉水垢中所 丫而除去。据如下表:物质Mg(OH) 2CaCOaMgCO 3Ca(OH)2CaSO4MgSO4溶解度/g9.0 x-4101.5x-3101.0x-2101.7x-1102.1 x-11026.7请用化学方程式表示锅炉水垢中含有Mg(OH) 2的原因:
14、(2)含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质 试剂X是(填序号)。A 食醋B 氯化钢假设2:氯化铁电离出的铁根离子与0H结合生成难电离的NH3H2。,促进沉淀溶解平衡向右移动。C,碳酸钠D .碳酸氢钠CaSO4能转化为物质丫的原因是(用文字叙述)升高温度,溶液中CQA的平衡转化率减小,则该反应的少0(填大于” “于”或等于“。(3)除含CaS04、Mg(OH) 2夕卜,锅炉水垢中还可能含有的物质是(写化学式)。(4)水中的Ca2+ Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+ Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40 g/L的自
15、来水样10 mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol 二的M溶液20.00 mL ,则该自来水样中Mg?+的物质的量浓度是。 答案 Mg(HC0 3) 2=MgCO3J+ H2O+ COzf、MgCOa + H20=Mg(0H) 2+ CO2T(2) CCaCO3的溶解度小于CaSO4的溶解度(3) CaCOa、MgCOa .1(4) 0.01 mol L -3+-2-2-20 .元素铭(Cr)在溶液中主要以Cr (蓝紫色)、Cr(OH) 4(绿色卜Cr25(橙红色)、CrO4(黄色)等形式存在。Cr(OH) 3为难溶 于水的灰蓝色固体。回答下列问题:(1) Cr3+
16、与AI3+的化学性质相似。在C2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是(2) CQ2-和cr?。2在溶液中可相互转化。室温下,初始浓度为1.0 mol L1 的 Na2CrO4溶液中 QCAO2 )|1 c(H +)的变化如图所示。用离子方程式表示Na2CrO4溶液中的转化反应_LO 20 3.0 4.0 | I I L 6.0 c(FT)/l()-7 mol * LJ)由图可知,溶液酸性增大,CrO4一的平衡转化率(填增大减小“或不变”。根据A点数据,计算出 该转化反应的平衡常数为升高温度,溶液中CQA的平衡转化率减小,则该反应的少0(填大于” “于”或等于“。(3
17、)在化学分析中采用K2CQ4为指示剂,以AgNO 3标准溶液滴定溶液中C,利用Ag与CrO4生成砖红色沉淀,指示到达滴定终点。当溶液中CI恰好沉淀完全(浓度等于1.0 10 5 mol L |)时,溶液中c(Ag+)为 mol L-二此时溶液中c(CrO4)等于 molL:1 o (已知Ag2CrO4、AgCI的 心口分别为2.00*和2.00叫。(4) + 6价铭的化合物毒性较大,常用NaHSO3将废液中的C2。7一还原成Cr3+,该反应的离子方程式为系如下图(忽略溶液体积的变化,H?S的挥发)。(13,5.7 xIO2)(33x10|_|11 III 35X*(9,13xl0,5) /(7
18、,6.8xl(rB) /(5,L4xQ13)/(3J_4xlO-s)fhl.4xl019)111 J J9 II 13 pH125 c和0.10 mol L- H2s溶液中,涌入HCI气体或加入NaOH固体以调节溶液PH 溶液pH与c(S*2 )关 pH= 13 时,溶液中的 c(H2S)+ c(HS )=mol 。某溶液含 0.020 mol L - 1 MM十、0.10 mol L _ 1 H2S,当溶液 pH =2.8 0 15 时,MM+开始沉淀。已知:Ksp(MnS)(3)25 &两种酸的电离平衡常数如下表。KalKa2H2s0321.3 xo86.3 10H2CO34.2 10 -
19、75.6 10-11HS03的 电离平衡常数表达式K=。 0.10 mol L - C + 2H2s0“浓)=2SO2 T+C02 件 2H 2。0.0435W2SO3溶液中离子浓度由大到小的顺序为答案B .向含有AgCI固体的溶液中加入适量的水使 H 2s03溶液和 NaHCO3 溶液反应的主 离子方升高温度,溶液中CrO八的平衡转化率减小,则该反应的 少0(填大于” “于”或等于“C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积Ksp小的一定先生成沉淀D 溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则E.难溶盐电解质的Ksp和温度有关F.加入与原难溶电
20、解质具有相同离子的物质,使难溶电解质的溶解度变小,也使Ksp变小-1-3- 1现向含有NaBr、KI均为0.002 mol L 的溶液中加入等体积的浓度为4X10 mol L AgN03溶液,则产生的沉淀是(填化学式);若向其中再加入适量的 Nai固体,则最终可发生沉淀转化的总反应式表示为。答案(1)变小不变变小变大(2) BE(3) Agl AgBrAgBr(s) + I (aq)=Agl(s) +Br (aq)答案(1)蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液2-+2-(2Kl)2CrO4 + 2H Cr2O? + 出 0 增大1. OXI。小于-5- 3(3)
21、2.0 1 5.0 0(4) Cr2O2- + 3HSO3 + 5H +=2Cr3+ + 3SO: + 4H2O21 研究硫元素及其化合物的性质具有重要意义。(1)硫离子的结构示意图为加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为2- cH_ cSO3 c HSO3 c(Na+ )c(SO2_ )c(OH _)c(HSO3)c(H+) H2so3+ HCO3 =HSO3+CO2f+ H2O22 .已知常温下,AgBr 的 KsP= 4.9 XIO 、Agl 的 Ksp= 8.3 10 仃。(1)现向含有Agl的饱和溶液中:加入固体AgNO3,贝Vc(L) (填变大变小或不变”,下同);若改加更多的Agl,则c(Ag +) ; 若改加AgBr固体,贝U c(l.) ;而c(Ag +)。(2)有关难溶盐的溶度积及溶解度(与AgBr、Agl无美),有以下叙述,其中正确的是A .两种难溶盐电解质,其中Ksp小的溶解度一定小AgCI溶解又达到平衡时,AgCI的溶度积不变,其溶解度也不
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 新人版英语八年级下册Unit5总复习ppt课件
- 新人教部编版一年级语文上第五单元ppt课件(全套)
- 高鸿业经济学基础第十五章-总需求-总供给模型-授课-河北工大宋建林课件
- 新人教版高中数学《等差数列前n项和》课件
- 新人教部编版五年级语文上册第六单元测试卷课件
- 高鸿业微观经济学课件第4章生产论
- 高鸿业--微观经济学-第一章课件
- 新人教版部编本五年级下册语文13 人物描写一组 ppt课件
- 新人教版高中化学必修第一册——电解质的电离ppt课件
- 新人教版部编教材二年级下册第一单元3《贝的故事》优质课教学ppt课件
- 高风险作业培训讲义_002
- 新人教版语文三年级下册第五单元全套ppt课件部编版
- 新人教版英语八年级上册第二单元全部ppt课件
- 《走一步再走一步》重点课件
- 新人教版语文一年级上册:识字1《天地人》课件
