 第四章离子聚合课件
第四章离子聚合课件


《第四章离子聚合课件》由会员分享,可在线阅读,更多相关《第四章离子聚合课件(39页珍藏版)》请在装配图网上搜索。
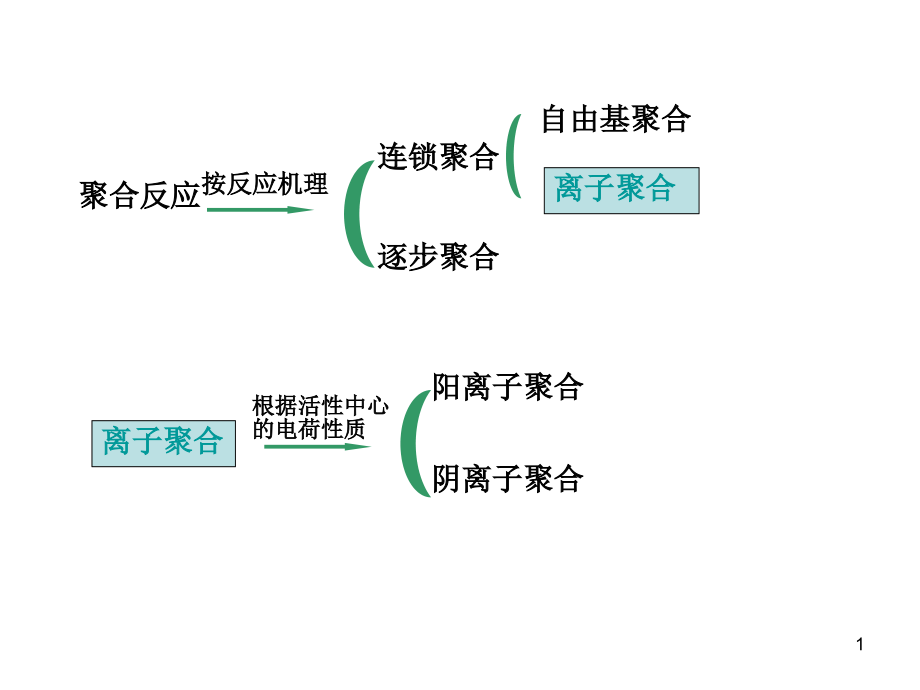
1、聚合反应聚合反应按反应机理按反应机理连锁聚合连锁聚合逐步聚合逐步聚合自由基聚合自由基聚合离子聚合离子聚合离子聚合离子聚合根据活性中心根据活性中心的电荷性质的电荷性质阳离子聚合阳离子聚合阴离子聚合阴离子聚合聚合反应按反应机理连锁聚合逐步聚合自由基聚合离子聚合离子聚合1离子聚合的特点离子聚合的特点单体的选择性高单体的选择性高聚合条件苛刻聚合条件苛刻聚合速率快,需在低温下进行聚合速率快,需在低温下进行反应介质对聚合有很大影响反应介质对聚合有很大影响微量的水、空气、杂质都微量的水、空气、杂质都有极大的影响有极大的影响离子聚合的特点单体的选择性高微量的水、空气、杂质都有极大的影24.1 4.1 阳离子聚
2、合阳离子聚合阳离子聚合通式:阳离子聚合通式:式中:式中:B B-:反离子,又称抗衡离子反离子,又称抗衡离子 (通常为引发剂碎片,带(通常为引发剂碎片,带反电荷)。反电荷)。A A+:阳离子活性中心(碳阳离子,氧鎓离子),难以孤阳离子活性中心(碳阳离子,氧鎓离子),难以孤立存在,往往与反离子形成离子对。立存在,往往与反离子形成离子对。4.1 阳离子聚合阳离子聚合通式:31.1.烯类单体:烯类单体:(95%(95%以上以上)2.2.含羰基(含羰基(C=OC=O)化合物:醛、酮、酸、酯。)化合物:醛、酮、酸、酯。3.3.杂环化合物:如环氧乙烷等。杂环化合物:如环氧乙烷等。含羰基化合物和杂环化合物:一
3、般多采用离子聚合。含羰基化合物和杂环化合物:一般多采用离子聚合。回顾:连锁聚合的单体种类:回顾:连锁聚合的单体种类:4.1.1 4.1.1 阳离子聚合的单体阳离子聚合的单体1.烯类单体:(95%以上)含羰基化合物和杂环化合物:一般4烯类单体通过电子效应判断进行何种聚合:烯类单体通过电子效应判断进行何种聚合:1)共轭单体能按三种机理聚合)共轭单体能按三种机理聚合(苯乙烯、丁二烯、异戊二烯)(苯乙烯、丁二烯、异戊二烯)2)带有吸电子基团的单体可自由基和阴离子聚合)带有吸电子基团的单体可自由基和阴离子聚合(除非吸电除非吸电子性很强)子性很强)3)带有供电子基团)带有供电子基团(二甲基、烷氧基)(二甲
4、基、烷氧基)的单体只能阳离子聚合的单体只能阳离子聚合4)记住特殊的聚合方式)记住特殊的聚合方式(乙烯、丙烯)(乙烯、丙烯)5)含)含X原子一般自由基聚合原子一般自由基聚合烯类单体通过电子效应判断进行何种聚合:1)共轭单体能按三种机5取代基对乙烯基单体聚合机理的影响如下取代基对乙烯基单体聚合机理的影响如下:第四章离子聚合课件64.1.2 阳离子聚合的引发体系阳离子聚合的引发体系常用引发剂常用引发剂Lewis酸酸质子酸质子酸亲电试剂亲电试剂4.1.2 阳离子聚合的引发体系常用引发剂Lewis酸质子酸74.1.2 阳离子聚合的引发体系阳离子聚合的引发体系1、质子酸、质子酸 如如H2SO4、H3PO4
5、、HClO4、Cl3CCOOH等强质子酸。等强质子酸。引发机理:引发机理:在非水介质中离解出部分质子,使烯烃质子化,引发在非水介质中离解出部分质子,使烯烃质子化,引发烯烃的阳离子聚合。烯烃的阳离子聚合。质子酸作为引发剂的条件:质子酸作为引发剂的条件:有足够的酸强度产生质子;有足够的酸强度产生质子;同时酸根亲核性不能太强,以免与质子或阳离子结合形同时酸根亲核性不能太强,以免与质子或阳离子结合形成共价键,造成链终止。成共价键,造成链终止。质子酸引发聚合温度较高(质子酸引发聚合温度较高(200300),且聚合生成低分子产物(),且聚合生成低分子产物(几千)几千)4.1.2 阳离子聚合的引发体系1、质
6、子酸质子酸引发聚合温度82、Lewis酸(最常用的阳离子引发剂酸(最常用的阳离子引发剂)AlCl3,BF3,SnCl4,ZnCl2,TiBr4等。等。Lewis酸酸单独使用时活性不高单独使用时活性不高,往往与少量共引发剂(如,往往与少量共引发剂(如水)共用,两者形成络合物离子对,才能引发阳离子聚合。水)共用,两者形成络合物离子对,才能引发阳离子聚合。例如例如BF3-H2O引发体系。引发体系。2、Lewis酸(最常用的阳离子引发剂)9共引发剂:共引发剂:质子或碳阳离子供给体质子或碳阳离子供给体质子供体,如质子供体,如H2O,ROH,RCOOH,HX等;等;碳阳离子供体,如碳阳离子供体,如RCl,
7、RCOX,(RCO)2O,ROR等。等。引发剂引发活性取决于向单体提供质子或碳阳离子的能力。引发剂引发活性取决于向单体提供质子或碳阳离子的能力。在工业上,一般采用反应速率较为适中的在工业上,一般采用反应速率较为适中的AlCl3-H2O引发体系。引发体系。共引发剂:质子或碳阳离子供给体引发剂引发活性取决于向单体提供104.1.3 阳离子聚合机理阳离子聚合机理链引发、链增长和链终止等基元反应;链引发、链增长和链终止等基元反应;快引发、快增长、易转移、难终止;快引发、快增长、易转移、难终止;链转移是终止的主要的方式等。链转移是终止的主要的方式等。4.1.3 阳离子聚合机理链引发、链增长和链终止等基元
8、反应;11(1)链引发链引发 主引发剂(主引发剂(C)与共引发剂()与共引发剂(RH)形成络合离子对,)形成络合离子对,小部分离解成质子和自由离子,两者之间建立平衡。小部分离解成质子和自由离子,两者之间建立平衡。与单体双键加成形成碳阳离子与单体双键加成形成碳阳离子特点:引发速率极快,引发活化能为特点:引发速率极快,引发活化能为Ei=8.421 kJ/mol (自由基聚合的(自由基聚合的Ei=105150 kJ/mol)。)。(1)链引发 主引发剂(C)与共引发剂(RH)12(2)链增长链增长 引发反应生成的碳阳离子活性中心与反离子引发反应生成的碳阳离子活性中心与反离子始终构成始终构成离子对离子
9、对,单体分子不断插入其中而增长单体分子不断插入其中而增长。特点:特点:增长反应是离子和分子间的反应,活化能增长反应是离子和分子间的反应,活化能低,增长速度快,几乎与引发同时完成低,增长速度快,几乎与引发同时完成。(Ep=8.421kJ/mol););中心阳离子始终与反离子形成离子对;中心阳离子始终与反离子形成离子对;常伴有分子内重排,异构成更稳定的结构,常伴有分子内重排,异构成更稳定的结构,例如例如3-甲基甲基-1-丁烯聚合。丁烯聚合。(2)链增长 引发反应生成的碳阳离子活性中心与反离13(3)链终止链终止 离子聚合的活性种带有电荷,离子聚合的活性种带有电荷,无法双基终止无法双基终止,因此只,
10、因此只能通过单基终止和链转移终止,也可人为添加终止剂终止。能通过单基终止和链转移终止,也可人为添加终止剂终止。阳离子聚合的链终止阳离子聚合的链终止动力学链不终止动力学链不终止动力学链终止动力学链终止(3)链终止 离子聚合的活性种带有电荷,无法双14动力学链终止动力学链终止 与反离子加成与反离子加成 反离子亲核性足够强时会与增长的碳阳离子以共价反离子亲核性足够强时会与增长的碳阳离子以共价键结合而终止。键结合而终止。添加终止剂(添加终止剂(XA)常用终止剂:水、醇、酸、醚、胺、醌等常用终止剂:水、醇、酸、醚、胺、醌等 活性中心与反离子的一部分结合而终止活性中心与反离子的一部分结合而终止动力学链终止
11、 与反离子加成15动力学链不终止动力学链不终止链转移链转移 碳阳离子活性中心与亲核物质(如碳阳离子活性中心与亲核物质(如单体、反离子单体、反离子等)等)发生电荷转移,即链转移。发生电荷转移,即链转移。向单体转移终止向单体转移终止最主要的终止方式最主要的终止方式 活性种向单体转移,形成含不饱和端基的大分子,活性种向单体转移,形成含不饱和端基的大分子,同时引发剂再生,动力学链不终止。同时引发剂再生,动力学链不终止。动力学链不终止链转移 碳阳离子活性中心与亲核16 自发终止(向反离子转移终止)自发终止(向反离子转移终止)增长阳离子对重排导致活性链终止成聚合物,再生出引增长阳离子对重排导致活性链终止成
12、聚合物,再生出引发剂共引发剂络合物,继续引发单体,动力学链不终止。发剂共引发剂络合物,继续引发单体,动力学链不终止。自发终止(向反离子转移终止)174.1.4 影响阳离子聚合的因素影响阳离子聚合的因素(1)反应介质(溶剂)的影响反应介质(溶剂)的影响 在阳离子聚合中,活性中心离子与反离子形成离子对,在阳离子聚合中,活性中心离子与反离子形成离子对,增长反应在离子对中进行。增长反应在离子对中进行。溶剂的极性大小溶剂的极性大小影响影响离子对的离子对的松紧程度松紧程度,从而影响聚合速率。,从而影响聚合速率。一般情况下,离子对为松对时的聚合速率和聚合度均较一般情况下,离子对为松对时的聚合速率和聚合度均较
13、大。溶剂的极性越大,松对比例越高,因此聚合速率和聚合大。溶剂的极性越大,松对比例越高,因此聚合速率和聚合度都较大。度都较大。共价键化合物共价键化合物离子紧对离子紧对离子松对离子松对自由离子自由离子 虽然高极性溶剂有利于增长,聚合速率和聚合度都较大,但溶虽然高极性溶剂有利于增长,聚合速率和聚合度都较大,但溶剂不应与中心离子反应,故应用中常选用剂不应与中心离子反应,故应用中常选用低极性溶剂低极性溶剂,如卤代烷。,如卤代烷。4.1.4 影响阳离子聚合的因素(1)反应介质(溶剂)的影18(2)反离子的影响)反离子的影响影响显著影响显著反离子亲核性对能否进行阳离子聚合有很大的影响。亲核反离子亲核性对能否
14、进行阳离子聚合有很大的影响。亲核性强,易与活性中心离子结合,使链终止。如性强,易与活性中心离子结合,使链终止。如Cl-一般不宜作一般不宜作为反离子。为反离子。反离子的体积越大,离子对越疏松,聚合速率越大。反离子的体积越大,离子对越疏松,聚合速率越大。(2)反离子的影响影响显著19根据根据Arrhenius公式,聚合速率和聚合度的综合活化能分别为:公式,聚合速率和聚合度的综合活化能分别为:聚合速率总活化能聚合速率总活化能ER=2141.8 kJ/mol 聚合速率有随温度降低而增加的现象。聚合速率有随温度降低而增加的现象。EXn一般为一般为12.5 29 kJ/mol 聚合度随温度降低而增加聚合度
15、随温度降低而增加低温减弱链转移反应引起低温减弱链转移反应引起的终止反应,延长活性种寿命,从而提高分子量。的终止反应,延长活性种寿命,从而提高分子量。(3)聚合温度的影响)聚合温度的影响较小较小(3)聚合温度的影响较小20举例一:异丁烯聚合举例一:异丁烯聚合 AlCl3为引发剂为引发剂,氯甲烷为溶剂,在氯甲烷为溶剂,在0 40聚合聚合,得低分得低分子量(子量(5万)聚异丁烯,主要用于粘结剂、密封材料等;在万)聚异丁烯,主要用于粘结剂、密封材料等;在100下聚合,得高分子量产物(下聚合,得高分子量产物(5万万100万),主要用作万),主要用作橡胶制品。橡胶制品。举举例二:例二:丁基橡胶制备丁基橡胶
16、制备 异丁烯和少量异戊二烯(异丁烯和少量异戊二烯(16%)为单体)为单体,AlCl3为引发剂为引发剂,氯甲烷为稀释剂氯甲烷为稀释剂,在在100下聚合下聚合,瞬间完成,分子量达瞬间完成,分子量达20万万以上。以上。丁基橡胶冷却时不结晶,丁基橡胶冷却时不结晶,-50柔软,耐候,耐臭氧,柔软,耐候,耐臭氧,气密性好,主要用作内胎。气密性好,主要用作内胎。例子例子举例一:异丁烯聚合例子214.2 4.2 阴离子聚合阴离子聚合阴离子聚合通式:阴离子聚合通式:式中:式中:A A+:反离子,反离子,一般为金属离子。,一般为金属离子。B B-:阴离子活性中心,一般由亲核试剂提供。阴离子活性中心,一般由亲核试剂
17、提供。4.2 阴离子聚合阴离子聚合通式:224.2.1 4.2.1 阴离子聚合的单体阴离子聚合的单体单体:单体:烯类化合物烯类化合物、羰基化合物、含氧杂环化合物等、羰基化合物、含氧杂环化合物等原则上原则上,取代基为,取代基为吸电子基吸电子基的烯类单体的烯类单体4.2.1 阴离子聚合的单体单体:烯类化合物、羰基化合物、含234.2.2 阴离子聚合的引发体系阴离子聚合的引发体系阴离子聚合的引发剂:阴离子聚合的引发剂:电子给体(亲核试剂)电子给体(亲核试剂)根据根据引发机理引发机理可分两类:可分两类:q 电子转移引发电子转移引发 如碱金属,碱金属如碱金属,碱金属-芳烃引发剂芳烃引发剂q 阴离子引发阴
18、离子引发 如有机金属化合物如有机金属化合物4.2.2 阴离子聚合的引发体系阴离子聚合的引发剂:电子给体24(1)电子转移引发)电子转移引发 碱金属(碱金属(Li、Na、K等)等)电子直接转移引发电子直接转移引发碱金属原子将最外层一价电子直接转移给单体,生成单碱金属原子将最外层一价电子直接转移给单体,生成单体自由基体自由基-阴离子,自由基阴离子末端很快偶合终止,形成阴离子,自由基阴离子末端很快偶合终止,形成双阴离子双阴离子,两端阴离子同时引发单体聚合。,两端阴离子同时引发单体聚合。如丁钠橡胶。如丁钠橡胶。缺点:非均相引发体系缺点:非均相引发体系(1)电子转移引发 碱金属(Li、Na、K等)电子直
19、接转25如萘如萘钠引发体系在四氢呋喃溶液中引发苯乙烯的聚合。钠引发体系在四氢呋喃溶液中引发苯乙烯的聚合。碱金属亦可将电子转移给中间体(如萘),使中间体碱金属亦可将电子转移给中间体(如萘),使中间体转变为自由基转变为自由基-阴离子,然后再将活性转移给单体。这种引阴离子,然后再将活性转移给单体。这种引发能量较低,反应速度快。发能量较低,反应速度快。碱金属碱金属-芳烃引发剂芳烃引发剂电子间接转移引发电子间接转移引发萘自由基阴离子萘自由基阴离子苯乙烯自由基双阴离子苯乙烯自由基双阴离子苯乙烯自由基单苯乙烯自由基单阴离子阴离子如萘钠引发体系在四氢呋喃溶液中引发苯乙烯的聚合。碱金属-26(2)阴离子引发)阴
20、离子引发 有机金属化合物:如金属胺基化合物、金属烷基化合物和有机金属化合物:如金属胺基化合物、金属烷基化合物和格利雅试剂等。格利雅试剂等。l 金属胺基化合物金属胺基化合物 如如NaNH2 和和KNH2在液氨体系可呈自由阴离子形式引发聚在液氨体系可呈自由阴离子形式引发聚合,是研究得最早的阴离子引发剂。合,是研究得最早的阴离子引发剂。这类引发剂的活性太大,聚合不易控制,故目前已不使用。这类引发剂的活性太大,聚合不易控制,故目前已不使用。单阴离子单阴离子(2)阴离子引发 有机金属化合物:如金属胺基化合27l 金属烷基化合物金属烷基化合物最常用的阴离子聚合引发剂最常用的阴离子聚合引发剂引发剂的活性与金
21、属电负性有关,若引发剂的活性与金属电负性有关,若M-C的极性越的极性越大,引发活性越大。大,引发活性越大。RLi、RNa、RK都是引发活性很大的引发剂,其中以都是引发活性很大的引发剂,其中以RLi最为常用,如最为常用,如丁基锂丁基锂。Mg 的电负性较大,的电负性较大,R2Mg 不能直接引发阴离子聚合。但不能直接引发阴离子聚合。但制备成格利雅试剂制备成格利雅试剂 MgRX 以增加以增加Mg-C键的极性,也能引键的极性,也能引发活性较大的单体聚合,如丙烯腈、硝基乙烯等。发活性较大的单体聚合,如丙烯腈、硝基乙烯等。金属烷基化合物最常用的阴离子聚合引发剂 284.2.3 阴离子聚合引发剂与单体的匹配阴
22、离子聚合引发剂与单体的匹配 阴离子聚合的单体和引发剂的活性各不相同,并具阴离子聚合的单体和引发剂的活性各不相同,并具有选择性。只有某些引发剂才能引发某些单体。有选择性。只有某些引发剂才能引发某些单体。基本原则为:基本原则为:活性大的引发剂可引发活性活从小至大的各种单体;活性大的引发剂可引发活性活从小至大的各种单体;而引发活性小的引发剂,只能引发活性大的单体,而引发活性小的引发剂,只能引发活性大的单体,4.2.3 阴离子聚合引发剂与单体的匹配 阴离子聚294.2.4 阴离子聚合的机理阴离子聚合的机理阴离子聚合只有阴离子聚合只有引发引发和和增长增长两步基元反应:两步基元反应:引发反应引发反应取决于
23、引发体系。取决于引发体系。增长反应增长反应与阳离子聚合类似,也以离子紧对、松对,甚与阳离子聚合类似,也以离子紧对、松对,甚至以自由离子的方式进行。至以自由离子的方式进行。阴离子聚合无双基终止。增长反应中的活性链直到阴离子聚合无双基终止。增长反应中的活性链直到单体完全耗尽仍可保持活性,因此有单体完全耗尽仍可保持活性,因此有“活性聚合活性聚合”的概的概念。念。4.2.4 阴离子聚合的机理阴离子聚合只有引发和增长两步基元30阴离子聚合无终止的原因阴离子聚合无终止的原因从活性链上脱去负氢离子从活性链上脱去负氢离子H-困难,能量很高。困难,能量很高。反离子一般为金属离子,碳反离子一般为金属离子,碳-金属
24、键解离倾向大,无金属键解离倾向大,无法夺取每个原子或法夺取每个原子或H+而终止。而终止。活性链间相同电荷静电排斥,不可能双基终止;活性链间相同电荷静电排斥,不可能双基终止;阴离子聚合需在高真空、惰性气氛或完全除水等条件下阴离子聚合需在高真空、惰性气氛或完全除水等条件下进行,试剂和反应器都必须十分洁净。进行,试剂和反应器都必须十分洁净。微量杂质,如水、氧气、二氧化碳都会使阴离子聚合终止。微量杂质,如水、氧气、二氧化碳都会使阴离子聚合终止。在无终止聚合条件下,常通过人为加在无终止聚合条件下,常通过人为加入水、醇、胺等物质使聚合终止。入水、醇、胺等物质使聚合终止。阴离子聚合无终止的原因从活性链上脱去
25、负氢离子H-困难,能量很31自由基聚合:慢引发、快增长、速终止(双基终止)自由基聚合:慢引发、快增长、速终止(双基终止)阳离子聚合:快引发、快增长、易转移、难终止阳离子聚合:快引发、快增长、易转移、难终止阴离子聚合:快引发、慢增长、无终止、无转移阴离子聚合:快引发、慢增长、无终止、无转移慢增长是相对于引发而言较慢,其实慢增长是相对于引发而言较慢,其实它的增长较自由基聚合快的多它的增长较自由基聚合快的多自由基聚合:慢引发、快增长、速终止(双基终止)慢增长是相对于324.2.5 活性聚合物和活性聚合活性聚合物和活性聚合活性聚合物(活性聚合物(Living Polymer)当单体转化率达到当单体转化
26、率达到100%,聚合仍不终止,形成,聚合仍不终止,形成具有反应活性的聚合物,即具有反应活性的聚合物,即活性聚合物活性聚合物。活性聚合物主要由阴离子聚合得到,活性聚合物主要由阴离子聚合得到,但现在在阳离子和自由基活性聚合方但现在在阳离子和自由基活性聚合方面的研究也非常活跃。面的研究也非常活跃。活性聚合活性聚合 引发体系在引发聚合之前,预先引发体系在引发聚合之前,预先100%迅速转变成活迅速转变成活性中心,然后以相同的速率同时引发单体增长,至单体性中心,然后以相同的速率同时引发单体增长,至单体耗尽仍保持活性,即耗尽仍保持活性,即活性聚合活性聚合。4.2.5 活性聚合物和活性聚合活性聚合物(Livi
27、ng P33活性聚合的应用活性聚合的应用1、制备遥爪聚合物、制备遥爪聚合物 分子链分子链两端两端都带有活性官能团的聚合物,两官能团遥都带有活性官能团的聚合物,两官能团遥遥位居于分子链两端,像两个爪子。遥位居于分子链两端,像两个爪子。-COOH:CO2 -OH:环氧乙烷:环氧乙烷 -NCO:二异氰酸酯:二异氰酸酯活性聚合的应用1、制备遥爪聚合物34CH2Li活的PBCH2COOHCH2COOLiCH2CH2CH2OLiCH2CH2CH2OHCH2CH2CH2SLiCH2CH2CH2SHCH2CHCHCH2CH2CHCHCH2OOCH2CH2SCH2CH2OHHHHCO2OH|OLi|CH2LiC
28、H2COOHCH2COOLiCH352、制备、制备梳形和星形聚合物ClH2CClH2CCH2ClCH2Cl4CH2CHKCH2CHCH2CH2CHCH2CH2CHCH2CH2CHCH21,2,4,5-四氯甲基苯活的PS星形聚合物CH2CCH2CHKCH2CCH3CH3COOCH3COCHCH2PMMA活的PS梳形聚合物2、制备梳形和星形聚合物ClH2CClH2CCH2ClCH2363、制备嵌段共聚物、制备嵌段共聚物 先制备一种单体的先制备一种单体的“活的聚合物活的聚合物”,再加另一种,再加另一种单单体共聚,制得任意链段长度的嵌段聚合物。体共聚,制得任意链段长度的嵌段聚合物。顺序加料嵌段(顺序加
29、料嵌段(SBS树脂)树脂)nS Sn SnBm SnBmSi SnBmSi偶合嵌段(偶合嵌段(ABBA形嵌段)形嵌段)2AnBmLiBr(CH2)6BrAnBm-(CH2)6-BmAn+顺序加料嵌段(SBS树脂)+374.2.6 开环聚合开环聚合 环状单体在引发剂或催化剂作用下形成环状单体在引发剂或催化剂作用下形成线性聚合物线性聚合物的过的过程称为开环聚合。程称为开环聚合。与缩聚反应相比,其聚合过程中无小分子生成;与烯烃与缩聚反应相比,其聚合过程中无小分子生成;与烯烃加聚相比,其聚合过程中无双键断裂,因此是一类加聚相比,其聚合过程中无双键断裂,因此是一类独特的独特的聚合反应聚合反应。开环聚合单
30、体开环聚合单体:环醚、环缩醛、环酯、环酰胺、环硅烷环醚、环缩醛、环酯、环酰胺、环硅烷等。等。环氧乙烷、环氧丙烷、己内酰胺、三聚甲醛等的开环聚环氧乙烷、环氧丙烷、己内酰胺、三聚甲醛等的开环聚合都是重要的工业化开环聚合反应。合都是重要的工业化开环聚合反应。4.2.6 开环聚合 环状单体在引发剂或催化剂作用38单体聚合类型实例环氧化合物环氧丁烷四氢呋喃噻丙环噻丁环吖丙啶吖啶环缩醛环酯环酰胺阳离子、阴离子、配位阴离子阳离子阳离子阳离子、阴离子、配位阴离子阳离子、阴离子阳离子阳离子阳离子阳离子、阴离子、配位阴离子阳离子、阴离子、水解聚合环氧乙烷、环氧丙烷3,3-双(氯甲基)环氧丁烷四氢呋喃硫化丙烯噻丁环亚乙基亚胺吖啶二氧五环、三聚甲醛-丙内酯、-已内酯已内酰胺 开环聚合从活性中心角度分类分为阳离子型、阴离子开环聚合从活性中心角度分类分为阳离子型、阴离子型以及配位阴离子型开环聚合,其中以第一种为主。型以及配位阴离子型开环聚合,其中以第一种为主。单体聚合类型实例环氧化合物阳离子、阴离子、配位阴离子39
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
