 物质结构 元素周期律
物质结构 元素周期律


《物质结构 元素周期律》由会员分享,可在线阅读,更多相关《物质结构 元素周期律(62页珍藏版)》请在装配图网上搜索。
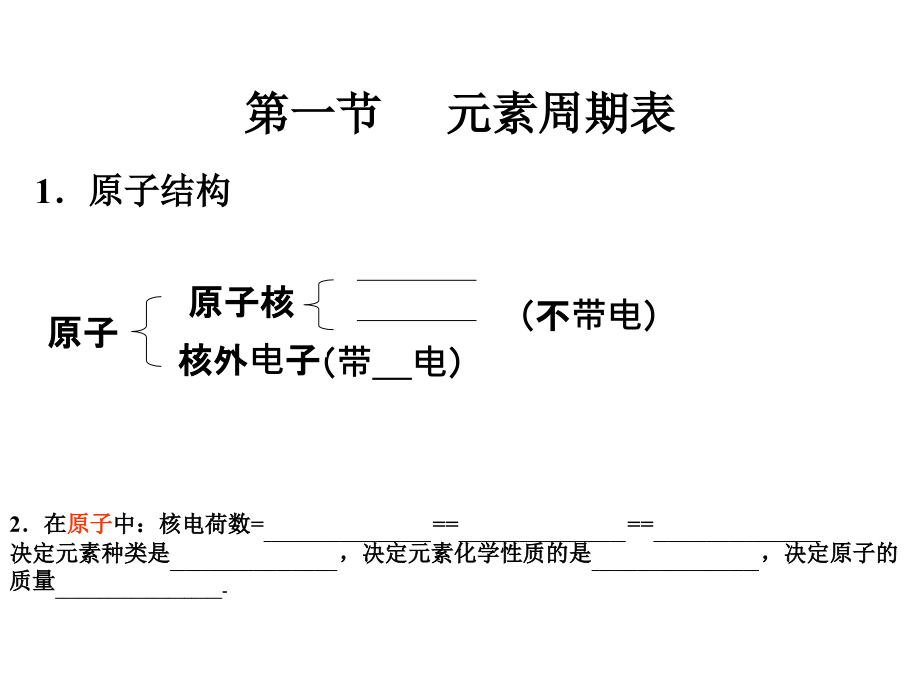
1、第一节第一节 元素周期表元素周期表原子核原子核(不(不带电)(带 电)原子原子核外核外电子子 1原子结构原子结构2在在原子原子中:核电荷数中:核电荷数=_=_=_决定元素种类是决定元素种类是_,决定元素化学性质的是,决定元素化学性质的是_,决定原子的,决定原子的质量质量_-一、元素周期表结构一、元素周期表结构1、编排原则、编排原则(1)横行)横行(2)纵行)纵行2、结构、结构(1)周期)周期7个横行个横行7个周期个周期特点:每一周期中元素的特点:每一周期中元素的电子层数电子层数相同相同分类:短周期、长周期分类:短周期、长周期周期序数周期序数=电子层数电子层数类别周期序数周期序数起止元素起止元素
2、包括元包括元素种数素种数核外核外电子子层数数稀有气体原子稀有气体原子序数序数_短短_周期周期1HHe2122LiNe82103NaAr8318长_周期周期4KKr184365RbXe185546CsRn32686不完全不完全_周期周期7Fr112号号26(目(目前)前)7118思考:思考:53、88号元素位置?号元素位置?(2)族)族18个纵行个纵行16个族个族分类:主族、副族、分类:主族、副族、0族、族、族族常见族的特别名称常见族的特别名称主族序数主族序数=主族最外层电子数主族最外层电子数思考:最外层电子数为思考:最外层电子数为2的元素一定在的元素一定在A族族吗?吗?练习:练习:就元素周期表
3、中第就元素周期表中第3横行第横行第17纵行的元素,纵行的元素,回答:回答:(1)该元素符号)该元素符号 ,其原子结构示,其原子结构示意图意图 ,属于,属于 元素(填元素(填“金属金属”或或“非金属非金属”)(2)该元素位于第)该元素位于第 周期,周期,族,该族族,该族的名称是的名称是 。二、核素二、核素1、元素:具有相同核电荷数(即质子数)的、元素:具有相同核电荷数(即质子数)的同一类原子同一类原子核素:有一定数目的质子和一定数目的中子核素:有一定数目的质子和一定数目的中子的一种原子的一种原子同位素:质子数相同而中子数不同的同一元同位素:质子数相同而中子数不同的同一元素的不同原子素的不同原子定
4、义定义限定词限定词中心中心词词质子质子中子中子元素元素核电荷数相同核电荷数相同的一类的一类原子原子相同相同未要未要求求核素核素一定数目的质一定数目的质子和一定数目子和一定数目的中子的中子原子原子未具未具体要体要求求未具未具体要体要求求同位同位素素质子数相同而质子数相同而中子数不同中子数不同原子原子相同相同不同不同2、原子组成的方法、原子组成的方法质量数质量数=质子数质子数+中子数中子数3、常见元素的同位素、常见元素的同位素氢的三种同位素氢的三种同位素氢元素的原子核氢元素的原子核原子名称原子名称质子数质子数(Z)中子数中子数101112三种同位素的相同点:三种同位素的相同点:-不同点:不同点:原
5、子符号原子符号碳元素有碳元素有 、和和 三种同位素三种同位素氧有氧有 、和和 三种同位素三种同位素铀有铀有 、和和 三种同位素三种同位素二、元素的性质与原子结构二、元素的性质与原子结构1、碱金属元素、碱金属元素(1)碱金属元素结构的相同点和不同点)碱金属元素结构的相同点和不同点同:最外层电子数都是同:最外层电子数都是1异:随核电荷数的增加,原子的电子层数逐渐增多,异:随核电荷数的增加,原子的电子层数逐渐增多,原子半径逐渐增大原子半径逐渐增大决定性质的相似性决定性质的相似性导致性质的差异、导致性质的差异、递变性递变性思考:元素的化学性质决定于原子结构中的哪一部思考:元素的化学性质决定于原子结构中
6、的哪一部分?根据上述结构的异同,推测碱金属元素性质的分?根据上述结构的异同,推测碱金属元素性质的异同点?异同点?序号序号钾钾钠钠对比实验对比实验1与氧气反与氧气反应应相同现象相同现象不同现象不同现象对比实验对比实验2与水反应与水反应相同现象相同现象不同现象不同现象实验探究实验探究都能与氧气反应都能与氧气反应燃烧更剧烈,火焰呈紫燃烧更剧烈,火焰呈紫色色剧烈燃烧,火焰剧烈燃烧,火焰呈黄色呈黄色浮、熔、游、响、红浮、熔、游、响、红轻微爆炸,火花轻微爆炸,火花剧烈反应,火星剧烈反应,火星小结:钾、钠化学性质相似小结:钾、钠化学性质相似最外层都是一个电子最外层都是一个电子 差异差异钾原子比钠原子多一个电
7、子层钾原子比钠原子多一个电子层(3)碱金属元素原子结构与性质的关系)碱金属元素原子结构与性质的关系原子结构原子结构化学性质化学性质相似性相似性最外层只有一个电子最外层只有一个电子 都能与都能与O2、H2O反反应,生成应,生成+1价化合价化合物物递变性递变性电子层数逐渐增多,电子层数逐渐增多,原子半径逐渐增大原子半径逐渐增大与与O2、H2O反应越反应越来越剧烈来越剧烈碱金属物理性质的变化规律碱金属物理性质的变化规律相似性:银白色固体、硬度小、密度小、相似性:银白色固体、硬度小、密度小、熔点低、导热性和导电性好熔点低、导热性和导电性好递变性:随着递变性:随着核电荷数的增加核电荷数的增加,单质的,单
8、质的熔熔点点和沸点逐渐和沸点逐渐降低降低研究方法:元素的金属性强弱比较(教材研究方法:元素的金属性强弱比较(教材P7注释)注释)元素的金属性比较可以从两个方面比较:元素的金属性比较可以从两个方面比较:元素的金属性越强,其单质越容易与水元素的金属性越强,其单质越容易与水(或酸)反应置换出氢气;(或酸)反应置换出氢气;元素的金属性越强,它们的最高价氧化物元素的金属性越强,它们的最高价氧化物的水化物的水化物氢氧化物碱性越强。氢氧化物碱性越强。小结:小结:碱金属元素的原子结构碱金属元素的原子结构元素名称元素名称锂锂钠钠钾钾铷铷铯铯元素符号元素符号LiNaKRbCs相同点相同点最外层电子数都是最外层电子
9、数都是1递变性递变性从从LiCs,核电荷数逐渐增大,核电荷数逐渐增大,电子层数逐渐增多,原子半径电子层数逐渐增多,原子半径逐渐增大逐渐增大碱金属的物理性质碱金属的物理性质碱金属单质碱金属单质 Li、Na、K、Rb、Cs相同点相同点除除Cs外,都是银白色固体,密度小,硬度外,都是银白色固体,密度小,硬度小,熔点较低,延展性、导电、导热性均小,熔点较低,延展性、导电、导热性均良好良好递递变变性性密度密度逐渐增大(但逐渐增大(但KNa)熔点熔点逐渐降低逐渐降低个性特点个性特点铯略带金色光泽铯略带金色光泽碱金属的化学性质碱金属的化学性质(1)碱金属单质化学性质)碱金属单质化学性质相似相似,都能与氧气,
10、都能与氧气等非金属单质及水反应等非金属单质及水反应(2)随着原子序数的递增,碱金属元素金属随着原子序数的递增,碱金属元素金属性逐渐增强性逐渐增强用途:用途:液态钠可用作核反应堆的传热介质液态钠可用作核反应堆的传热介质、卤族元素、卤族元素()原子结构()原子结构原子结构原子结构性质推测性质推测相相同同点点递递变变性性位于周期表第位于周期表第AA族,族,最最外层电子数都是外层电子数都是从从FI,核电荷数逐渐,核电荷数逐渐增加,电子层数逐渐增增加,电子层数逐渐增多,原子半径逐渐增大多,原子半径逐渐增大卤族元素性质卤族元素性质相似相似随核电荷数的增加(同随核电荷数的增加(同主族从上到下),卤族主族从上
11、到下),卤族元素性质发生元素性质发生递变递变()卤族元素单质的物理性质()卤族元素单质的物理性质(随原子序随原子序数的递增数的递增)颜色颜色浅浅深深状态状态气气液液固固密度密度小小大大熔点熔点低低高高沸点沸点低低高高(3)卤素单质与氢气的反应)卤素单质与氢气的反应相似性相似性:都能与:都能与H2反应反应 H2+X2=2HX (X=F、Cl、Br、I)递变性递变性:F2Cl2Br2I2与与H2反应反应剧烈程度:逐渐减弱剧烈程度:逐渐减弱难易程度:越来越难难易程度:越来越难HX稳定性稳定性逐渐减弱逐渐减弱随核原子序数的增加,卤素单质与随核原子序数的增加,卤素单质与H2化合越来越难,化合越来越难,氢
12、化物稳定性逐渐减弱氢化物稳定性逐渐减弱(4)卤素单质的置换反应)卤素单质的置换反应结论:随核电荷数(原子序数)的递增,卤结论:随核电荷数(原子序数)的递增,卤素单质氧化性逐渐减弱素单质氧化性逐渐减弱研究方法:元素的非金属性强弱比较(教材研究方法:元素的非金属性强弱比较(教材P9注释)注释)元素的非金属性比较可以从两个方面比较:元素的非金属性比较可以从两个方面比较:元素的非金属性越强,其单质越容易与元素的非金属性越强,其单质越容易与H2反应,氢化物越稳定;反应,氢化物越稳定;元素的非金属性越强,它们的最高价氧化元素的非金属性越强,它们的最高价氧化物的水化物(最高价含氧酸)酸性越强。物的水化物(最
13、高价含氧酸)酸性越强。3、同主族元素的性质与原子结构的关系、同主族元素的性质与原子结构的关系(1)元素性质的影响因素)元素性质的影响因素元素性质元素性质主要与原子核外电子的排布,特别主要与原子核外电子的排布,特别是是与最外层电子数有关与最外层电子数有关元素周期表元素周期表元素的性质与原子结构的关系元素的性质与原子结构的关系LiNaKRbCsFrFClBrIAtIAA金金属属性性非非金金属属性性电电子子层层数数原原子子半半径径失失电电子子能能力力逐逐渐渐得得电电子子能能力力逐逐渐渐 原子原子结构相似结构相似的一族元素,它们在化学的一族元素,它们在化学性性质质上有上有相似性和递变性相似性和递变性。
14、递递增增递递增增增增强强增增强强减减弱弱减减弱弱2、同主族元素性质的递变规律、同主族元素性质的递变规律从从上上到到下下电子层数逐渐增多电子层数逐渐增多原子半径逐渐增大原子半径逐渐增大失电子能力逐渐增强,得电子能力逐渐减弱失电子能力逐渐增强,得电子能力逐渐减弱金属性逐渐增强,非金属性逐渐减弱金属性逐渐增强,非金属性逐渐减弱本节课归纳与总结本节课归纳与总结 同一主族元素性质具有一定的相似性和递同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐变性;同一主族,从上到下:原子半径逐渐 ,失电子能力逐渐,失电子能力逐渐 ,得电子能力逐渐,得电子能力逐渐 ,金属性逐渐,金属性逐渐
15、,非金属性逐渐,非金属性逐渐 ;增大增大增强增强减弱减弱增强增强减弱减弱位置位置结构结构性质性质反映反映决定决定决定决定反映反映思考:思考:1、根据所学过的知识比较:、根据所学过的知识比较:元素元素S与与Se(第(第4周期第周期第A族)形成的气族)形成的气态氢化物的稳定性强弱。态氢化物的稳定性强弱。H2CO3与与H2SiO3的酸性强弱的酸性强弱2、HCl的酸性大于的酸性大于H2SO3的酸性,能否说明的酸性,能否说明非金属性:非金属性:ClS?元素元素最高价氧化物最高价氧化物对应的水化物对应的水化物CCO2H2CO3SiSiO2H2SiO3NN2O5HNO3PP2O5H3PO4SSO3H2SO4
16、ClCl2O7HClO4第二节第二节 元素周期律元素周期律一、原子核外电子排布一、原子核外电子排布1、电子的能量、电子的能量(1)多电子原子,电子能量)多电子原子,电子能量不同不同(2)离核近,电子能量低;)离核近,电子能量低;离核远,电子能量高离核远,电子能量高2、核外电子排布规律、核外电子排布规律电子总是尽可能从电子总是尽可能从内层内层排起,当一层排起,当一层充满充满后后再填充下一层再填充下一层核外电子分层排布核外电子分层排布电子按能量高低在核外分层排布。电子按能量高低在核外分层排布。1234567KLMNOPQ由内到外,能量逐渐升高思考探究:思考探究:1、结合表、结合表1-2,探究核外电
17、子排布的规律,探究核外电子排布的规律(1)核外电子在各电子层排布时,从内向外排布)核外电子在各电子层排布时,从内向外排布还是从外向内排布?还是从外向内排布?(2)原子核外各电子层最多容纳多少个电子?)原子核外各电子层最多容纳多少个电子?(3)原子最外层电子数目不超过几个?若)原子最外层电子数目不超过几个?若K层为层为最外层时不超过几个?最外层时不超过几个?(4)次外层最多容纳的电子数目不超过几个?)次外层最多容纳的电子数目不超过几个?称有气体元素原子电子层排布称有气体元素原子电子层排布核核电电荷数荷数元素元素名称名称元素元素符号符号各各电子层的电子数电子层的电子数KLMNOP最外层最外层电子电
18、子数数2氦氦He2210氖氖Ne28818氩氩Ar288836氪氪Kr28188854氙氙Xe2818188886氡氡Rn2818321888各层最多电子数各层最多电子数281832?排排 布布 规规 律律电子总是尽先排布在能量电子总是尽先排布在能量最低的电子层里。最低的电子层里。每个电子层最多只能排布每个电子层最多只能排布2n2n2 2个电子。个电子。最外层电子数不超过最外层电子数不超过8 8;(K K层为最外层时不超过层为最外层时不超过2 2)次外层最多不超过次外层最多不超过1818个电个电子。子。K L MN O P2 8 183250 2n21 2 3 4 5 62、结合表格、结合表格
19、1-2,根据核外电子排布的规律,根据核外电子排布的规律,分析分析K原子的核外电子排布原子的核外电子排布3、离子结构示意图和原子结构示意图有什么、离子结构示意图和原子结构示意图有什么关系?你能根据此关系画出关系?你能根据此关系画出Cl-和和Na+的结构的结构示意图吗?示意图吗?现有四种元素现有四种元素A A、B B、C C、D D,已知,已知A A核核外有外有1818个电子,个电子,B B原子最外层电子数比原子最外层电子数比D D原子核外电子数多原子核外电子数多2 2个,个,B B原子比原子比D D原子多原子多两个电子层;两个电子层;D D核外没有电子;核外没有电子;C C元素原元素原子核外电子
20、比子核外电子比B B元素的原子核外电子多元素的原子核外电子多5 5个。个。(1 1)写出四种元素的名称和符号;)写出四种元素的名称和符号;(2 2)画出)画出C C和和D D原子及原子及A A的结构示意图的结构示意图练习练习4、在前、在前20号元素中有哪些离子的核外电子号元素中有哪些离子的核外电子排布与稀有气体核外电子排布相同?排布与稀有气体核外电子排布相同?如:如:与与He原子电子层结构相同的离子原子电子层结构相同的离子H-、Li+、Be2+与与Ne原子电子层结构相同的离子?原子电子层结构相同的离子?与与Ar原子电子层结构相同的离子?原子电子层结构相同的离子?5、含有、含有10个电子的微粒有
21、哪些?个电子的微粒有哪些?(1)分子?)分子?(2)阳离子?)阳离子?(3)阴离子?)阴离子?四、元素周期表和元素周期律的应用四、元素周期表和元素周期律的应用内容内容同周期(从左到右)同周期(从左到右)同主族(从上到下)同主族(从上到下)实例实例第三周期元素(除第三周期元素(除Ar)碱金属元素、卤族元素碱金属元素、卤族元素原子半径原子半径逐渐逐渐 逐渐逐渐 电子层结构电子层结构 相同相同 递增递增 递增递增 相同相同失电子能力失电子能力得电子能力得电子能力逐渐逐渐 逐渐逐渐 逐渐逐渐 逐渐逐渐 金属性金属性非金属性非金属性逐渐逐渐 逐渐逐渐 逐渐逐渐 逐渐逐渐 主要化合价主要化合价最高正价:最
22、高正价:非金属负价:非金属负价:主族最高正价数主族最高正价数=最高价氧化物最高价氧化物对应水化物的对应水化物的酸碱性酸碱性酸性逐渐酸性逐渐 碱性逐渐碱性逐渐 酸性逐渐酸性逐渐 碱性逐渐碱性逐渐 非金属元素气非金属元素气态氢化物的形态氢化物的形成与稳定性成与稳定性气态氢化物的形成逐渐气态氢化物的形成逐渐 气态氢化物逐渐气态氢化物逐渐 气态氢化物的形成逐渐气态氢化物的形成逐渐 气态氢化物逐渐气态氢化物逐渐 (1)已知磷元素位于第)已知磷元素位于第3周期周期A族族画出磷的原子结构示意图;画出磷的原子结构示意图;磷元素的最高化合价为磷元素的最高化合价为 ,其氢化物的,其氢化物的化学式为化学式为 。(2
23、)已知某元素的原子结构示意图如图所示)已知某元素的原子结构示意图如图所示它在周期表中的位置是它在周期表中的位置是 ,预测,预测它的化学性质它的化学性质 。反映反映位位 置置周期序数周期序数=主族序数主族序数=决定决定原子原子结构构反映反映决定决定性 质主要化合价得失电子能力在整个周期表中,金属性最强的元素是在整个周期表中,金属性最强的元素是 ,非金,非金属性最强的元素是属性最强的元素是 ,常温下液态的金属单质是,常温下液态的金属单质是 ,液态的非金属单质是,液态的非金属单质是 ,碱性最强的碱是,碱性最强的碱是 ,含氧酸酸性最强的酸是含氧酸酸性最强的酸是 ,原子半径最大的元素,原子半径最大的元素
24、是是 ,氢化物最稳定的元素是,氢化物最稳定的元素是 ,没有正价的,没有正价的非金属元素是非金属元素是 ,在金属和非金属交界处,能,在金属和非金属交界处,能够找到作为够找到作为 的元素,你所知道的半导体的元素,你所知道的半导体有有 。五、元素周期表的重要意义五、元素周期表的重要意义1学习和研究化学的重要工具;学习和研究化学的重要工具;2指导科学研究,如发现新元素;指导科学研究,如发现新元素;3指导生产实践,如寻找新材料、催化剂、指导生产实践,如寻找新材料、催化剂、制冷剂、探矿等;制冷剂、探矿等;4论证了论证了“量变质变规律量变质变规律”第三节第三节 化学键化学键实验实验1-22Na+Cl2 现象
25、象钠剧烈燃烈燃烧、集气瓶内、集气瓶内产生生大量白烟大量白烟化学方程式化学方程式 2NaCl思考:氯化钠是一个分子吗?思考:氯化钠是一个分子吗?讨论:讨论:1、请写出、请写出Na和和Cl的原子结构示意图?的原子结构示意图?2、Na和和Cl的原子结构是否稳定?通过什么的原子结构是否稳定?通过什么途径才能达到稳定结构?途径才能达到稳定结构?3、请写出、请写出Na+和和Cl-结构示意图,思考钠离结构示意图,思考钠离子与氯离子为什么会结合在一起?子与氯离子为什么会结合在一起?一、离子键一、离子键1、形成过程、形成过程不稳定不稳定稳定稳定失去失去1个电子个电子得到得到1个电子个电子2、定义:带相反电荷离、
26、定义:带相反电荷离子之间的相互作用(静电子之间的相互作用(静电作用)称为离子键作用)称为离子键 讨论:讨论:(1)形成离子键的粒子是什么?这些粒子又)形成离子键的粒子是什么?这些粒子又是怎样形成的?它们的活泼性怎样?是怎样形成的?它们的活泼性怎样?(2)离子键的本质是什么?)离子键的本质是什么?你是怎样理解你是怎样理解的?的?(3)Na+与与OH-、CO32-、SO42-能形成离子能形成离子键吗?你还能举出哪些粒子可以形成离子键键吗?你还能举出哪些粒子可以形成离子键?成成键本本质成成键微粒微粒成成键条件条件实例例静静电作用作用阴阳阴阳离子离子活活泼金属金属-活活泼非金属非金属(A、A-A、A)
27、离子也可是离子也可是带电的原子的原子团。NaClMgBr2NaOH3、由离子键构成的化合物叫离子化合物、由离子键构成的化合物叫离子化合物 在元素符号在元素符号周围周围用小黑点用小黑点 (或或)来表示原来表示原子的子的最外层电子最外层电子电子式电子式 二、共价键二、共价键 1概念:原子间通过共用电子对形成的相互概念:原子间通过共用电子对形成的相互作用叫做共价键。作用叫做共价键。2、共价键的表示方法、共价键的表示方法分子分子电子式子式H2N2H2OCO2CH4成成键本本质成成键微粒微粒成成键条件条件实例例共用共用电子子对原子原子非金属非金属-非金属非金属不活不活泼的金属的金属-非金非金属属Cl2H
28、Cl3、共价化合物:由共价键形成的化合物、共价化合物:由共价键形成的化合物 4、共价键分类:非极性键与极性键、共价键分类:非极性键与极性键非极性键非极性键:同种同种元素的原子形成的共价键,元素的原子形成的共价键,共用电子对共用电子对不偏向不偏向任何一方。任何一方。极性键极性键:不同种不同种元素的原子形成的共价键,元素的原子形成的共价键,共用电子对共用电子对偏向偏向吸引电子能力强的一方吸引电子能力强的一方判断:判断:H-O-O-H、O=C=O、O=O、NN存存在的键是极性键还是非极性键?你从中能得在的键是极性键还是非极性键?你从中能得出什么启示吗?出什么启示吗?H-O-O-H:即有极性键又有非极
29、性键:即有极性键又有非极性键O=C=O:极性键:极性键 NN O=O:非极性键:非极性键 在单质分子中只有非极性键在单质分子中只有非极性键在化合物分子中:一定有极性键,也可能有在化合物分子中:一定有极性键,也可能有非极性键非极性键 实例实例化学键化学键成键微粒成键微粒原子或离子之间原子或离子之间共同点共同点离离子子化化合合物物NaCl离子键离子键Na+、Cl-相邻离子或原子相邻离子或原子之间都存在强烈之间都存在强烈的相互作用力,的相互作用力,使它们结合在一使它们结合在一起。起。NaOH离子键离子键 共价键共价键Na+、OH-形形成离子键,成离子键,OH-内部形成内部形成共价键共价键共共价价化化
30、合合物物HCl共价键共价键原子原子 5、化学键:使离子相结合或原子相结合的作、化学键:使离子相结合或原子相结合的作用力,通称为化学键用力,通称为化学键 化学键化学键离子键离子键共价键共价键极性键极性键非极性键非极性键物物质质单单质质化合物化合物离离子子化化合合物物共共 价价化化 合合物物金金属属非金属非金属可能可能一定一定一定一定可能可能可能可能(稀稀有有气气体体中中没没有有化化学学键)键)一定一定练习:写出你学过的阳离子与阴离子,这些阴阳离练习:写出你学过的阳离子与阴离子,这些阴阳离子结合时哪些会形成离子键,哪些会形成共价键?子结合时哪些会形成离子键,哪些会形成共价键?阳离子阳离子H+、NH4+、K+、Na+、Ca2+、Mg2+等等阴离子阴离子F-、Cl-、Br-、I-、O2-、OH-、CO32-、HCO3-、NO3-、SO42-等等(1)H+与阴离子结合后,都自动转化为形成共用与阴离子结合后,都自动转化为形成共用电子对电子对共价键共价键(2)OH-与与NH4+结合形成共价键结合形成共价键(3)其它阴阳离子都形成离子键。)其它阴阳离子都形成离子键。
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
