 无机化学原子结构与元素周期表课件
无机化学原子结构与元素周期表课件


《无机化学原子结构与元素周期表课件》由会员分享,可在线阅读,更多相关《无机化学原子结构与元素周期表课件(51页珍藏版)》请在装配图网上搜索。
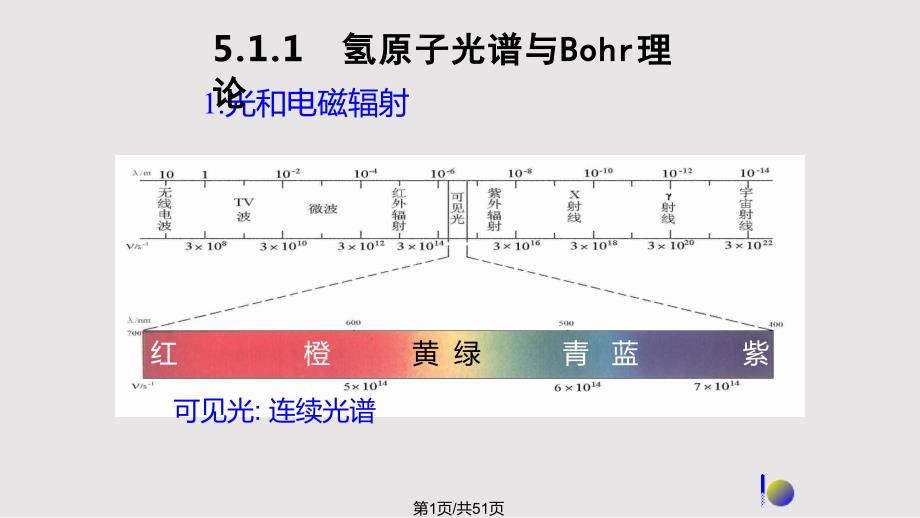
1、1.光和电磁辐射5.1.1 氢原子光谱与氢原子光谱与BohrBohr理理论论红 橙 黄 绿 青 蓝 紫可见光:连续光谱第1页/共51页2.氢原子光谱HHHH第2页/共51页 不连续光谱,即线状光谱 其频率具有一定的规律n=3,4,5,6式中 2,n各代表什么意义?经验公式:氢原子光谱特征:第3页/共51页3.Bohr理论 三点假设:核外电子只能在有确定半径和能量的圆形轨道上运动,且不辐射能量;通常,电子处在离核最近的轨道上,能量最低基态;原子获得能量后,电子被激发到高能量轨道上,原子处于激发态;从激发态回到基态释放光能,光的频率取决于轨道间的能量差。E:轨道能量h:Planck常数第4页/共5
2、1页n=3 红(H)n=4 青(H)n=5 蓝紫 (H)n=6 紫(H)Balmer线系第5页/共51页原子能级Balmer线系第6页/共51页 1924年,Louis de Broglie认为:质量为 m,运动速度为的粒子,相应的波长为:5.1.2 电子的波粒二象性电子的波粒二象性 1927年,Davisson和Germer进行电子衍射实验,证实电子具有波动性。=h/(m)=h/p,h=6.62610-34Js,Plank常量。第7页/共51页微观粒子运动的特性:从波粒二象性的特点出发,原子中电子的运动规律是怎样的?由慢射电子枪实验,推论:原子中个别电子某时刻在什么地方出现虽然不能确切知道,
3、但核外电子的分布是有规律的:电子在核外空间某区域出现的几率较大,而另一些区域电子出现的几率较小。量子力学认为:原子核外电子的运动具有按几率分布的统计规律性。第8页/共51页5.2 5.2 原子轨道原子轨道5.2.15.2.1、波函数、波函数19261926年年薜薜定定谔谔根根据据波波一一粒粒二二象象性性的的概概念念提提出出了了一一个个描描述述微微观观粒粒子子运动的方程运动的方程薜定谔波动方程薜定谔波动方程。式式中中:波波函函数数,E E为为体体系系的的总总能能量量,V V为为微微粒粒势势能能,h h为为普普朗朗克克常常数,数,m m为微粒的质量,为微粒的质量,x x、y y、z z为空间直角坐
4、标。为空间直角坐标。对对氢氢原原子子体体系系:描描述述氢氢原原子子核核外外电电子子运运动动状状态态的的数数学学表表示示式式,是是空空间间直直角角坐坐标标(x.y.z)(x.y.z)的的函函数数。=f(x.y.z)=f(x.y.z);E E为为氢氢原原子子H H的的总总能能量量;V V为电子的势能(即核对电子的吸引能);为电子的势能(即核对电子的吸引能);m m为电子质量。为电子质量。第9页/共51页 可可见见,量量子子力力学学是是用用波波函函数数和和与与其其对对应应的的能能量量来来描描述述微微观观粒粒子子运运动状态的。动状态的。既然是描述电子运动状态的数学表示式,而且又是空间坐标的既然是描述电
5、子运动状态的数学表示式,而且又是空间坐标的函数,函数,=f(x.y.z)=f(x.y.z)可以用其作图,可以用其作图,其空间图象可以形象地理解为电其空间图象可以形象地理解为电子运动的空间范围子运动的空间范围俗称俗称“原子轨道(原子轨函)原子轨道(原子轨函)”。波函数的空间图像波函数的空间图像就是就是原子轨道原子轨道,原子轨道的数学表示式是波,原子轨道的数学表示式是波函数函数,故,故波函数和原子轨道波函数和原子轨道常作同义语使用。常作同义语使用。对氢原子对氢原子,第10页/共51页2 2、原子轨道角度分布图、原子轨道角度分布图=f(x.y.z)=f(x.y.z),将将直直角角坐坐标标变变为为球球
6、坐坐标标(r.r.)然然后后利利用数学中的变量分离法,将用数学中的变量分离法,将 =f(r.)=f(r.)=R(r)R(r)Y(.)Y(.)。波波函函数数就就分分成成了了径径向向分分布布部部分分R(r)R(r)和和角角度度分分布布部部分分Y(.)。用角度部分用角度部分Y(.)Y(.)作的图称为原子轨道的角度分布图。作的图称为原子轨道的角度分布图。注注意意图图中中的的“+”“”不不是是正正、负负电电,而而是是 函函数数的的正负值。正负值。第11页/共51页第12页/共51页4.3 4.3 电子云电子云1 1、概率密度、概率密度电电子子在在原原子子核核外外空空间间某某处处单单位位体体积积内内出出现
7、现的的概概率率,称称为为概概率率密度(密度()。)。概率密度概率密度与与 间的关系间的关系:电子在原子核外某处出现的概率密度电子在原子核外某处出现的概率密度可直接用 来表示。第13页/共51页2、电子云 为了形象地表示核外电子运动的概率分布情况,化学上常用黑点分布的疏密来表示电子出现概率密度的相对大小。密 概率密度大,单位体积内电子出现的机会多.用小黑点的疏密来描述电子在核外出现的概率密度分布所得的空间图像称电子云。由于概率密度 ,若以 作图,可得到电子云的近似图象。将它的角度分布部分作图,所得图象称为电子云角度分布图。第14页/共51页第15页/共51页比较原子轨道角度分布图Y和电子云角度分
8、布图Y2:相似点:图形基本相似。不同点:(1)原子轨道角度分布图Y有“+”、“-”之分,而电子云图均为“+”;(2)电子云图Y2要“瘦”些,因Y值一般是小于1的。第16页/共51页(四)量子数描述原子中各电子的状态(电子所在的电子层,原子轨道能级,形状,方向及电子自旋方向等)需要四个参数:1、主量子数(n)含义:(1)描述电子层离核的远近;(2)描述电子层能量的高低。取值:取零以外的正整数,每一个数代表一个电子层。主量子数(n):1 2 3 4 5 电子层:第一层 第二层 第三层 第四层 第五层电子层符号:K L M N O n值越小,电子层离核越近,能量越低。第17页/共51页2、副(角)量
9、子数(l l)意义:(1)在多电子原子中与n一起决定电子亚层的 能量,l l值越小,亚层能量越低。(2)每一个l l值决定电子层中的一个亚层;(3)每一个l l值代表一种电子云或原子轨道的形状。取值:0,1,2,3,(n-1)正整数副量子数L:0 1 2 3 (n-1)电子亚层符号:s p d f 原子轨道(亚层):球形 哑铃形 花瓣形第18页/共51页3、磁量子数(m)含义:描述原子轨道或电子云在空间取向。取值:-ll,-2,-1,0,1,2,+ll(即0,12ll)原子轨道符号:s Px,Pz,Py dyz dxz,dz2 dx2-y2,dxy4、自旋量子数(ms)含义:描述核外电子的自旋
10、状态(绕电子自身的轴旋转运动)。取值:综合上述,对原子核外的电子运动状态可用四个参数结合描述。第19页/共51页 n,l,m 一定,轨道也确定l 0 1 2 3 轨道 s p d f 例如:n=2,l=0,m=0,2s n=3,l=1,m=0,3pz n=3,l=2,m=0,3dz2思考题:当n为3时,l,m 分别可以取何值?第20页/共51页3d态:n=3,l=2,m=0,第21页/共51页研究表明:在同一原子中,不可能有运动状态完全相同的电子存在。原子结构的近代概念,要点:(1)由于电子具有波粒二象性,所以核外电子运动没有确定的轨道,但具有按照几率分布的统计规律性。(2)可用薜定谔方程描述
11、核外电子的运动,方程中每一个合理的解,就表示核外电子的某一种可能的运动状态。(3)原子轨道为 的空间图象,角度分布的空间图象作为原子轨道角度分布的近似描述。(4)以|2的空间图象电子云来表示核外空间电子出 现的概率密度。(5)以四个量子数来确定核外任意电子的运动状态。第22页/共51页轨道:其电子运动状态(轨道)可描述为 1s,2s,2px,2py,2pz,3s能量:能量不仅与n有关,也与l有关;在外 加场的作用下,还与m有关。5.2.1 多电子原子轨道能多电子原子轨道能级级第23页/共51页(二)多电子原子轨道的能级:原子中各原子轨道能级的高低,主要根据光谱实验确定,也可从理论上计算,原子轨
12、道能级的相对高低,用图示法近似表示就为近似能级图。(1)各电子层能级相对高低为KLMNO(2)同一原子同一电子层内,各亚层能级的相对高低为:EnsEnpEndEnf(3)同一电子亚层内各原子轨道能级相同,如Enpx=Enpy=Enpz。(4)同一原子内,不同类型的亚层间,有能级交错现象。如E4sE3dE4p等。(5)若把能级相近的电子亚层组合,可得到若干能级组,它与元素所在周期有关。第24页/共51页1.Pauling近似能级图第25页/共51页第26页/共51页5.2.2 核外电子的分布:1.原子中电子分布原理:根据原子光谱实验的结果,总结出核外电子分布的基本原理(两个原理一个规则):(1)
13、、泡利(Pauli)不相容原理 每一个轨道内最多只能容纳两个自旋方向相反的电子。(2)、能量最低原理 多电子原子处于基态时,核外电子的分布在不违反泡利原理前提下,总是尽先分布在能量较低的轨道,以使原子处于能量最低状态。(3)、洪特(Hund)规则 原子在同一亚层的等价轨道上分布电子时,尽可能单独分布不同的轨道,而且自旋方向相同。第27页/共51页如N原子1s22s22p3的轨道表示式第28页/共51页对鲍林能级图,需明确几点:(1)近似能级图是一归纳结果,不能完全反映情况,所以只有近似含义。(2)它是反映同一原子内各原子轨道间的相对高低,所以不能用来比较不同元素原子轨道能级的相对高低。第29页
14、/共51页5.2.3 基态原子中电子的分布1、核外电子填入轨道的顺序 根据“两个原理一条规则”,可排出核外电子填入轨道顺序图。据此顺序图,可以准确写出91种元素原子的核外电子分布式。在110种元素中,只有19种元素原子层外电子的分布稍有例外:若再对它们进一步分析归纳得到一条特殊规律:全充满、半充满规则:对同一电子亚层,当电子分布为全充满(P6、d10、f14)、半充满(P3、d5、f7)或全空(P0、d0、f0)时,电子云分布呈球状,原子结构较稳定,挑出8种元素,剩余11种作例外。第30页/共51页2、基态原子的价层电子构型(1)价电子所在亚层,称价层。(2)原子的价层电子构型指价层的电子分布
15、式,它能反映该元素原子电子层结构的特征。注意:价层电子不一定全部都是价电子,如Ag价层电子构型为4d105s1,但氧化数只有+1、+2、+3。第31页/共51页3.简单基态阳离子的电子分布 基态原子外层(最高能级组)轨道能级顺序为:EnsE(n-2)fE(n-1)dEnpFe的电子分布式:Ar3d64s2Fe2+的电子分布式 似乎为Ar3d44s2,实际:Ar3d64s0,原因:阳离子的有效核电荷比原子的多,造成基态阳离子的轨道能级与基态原子的轨道能级有所不同。从大量光谱数据归纳出经验规律:基态原子外层电子填充顺序:ns(n2)f(n-1)dnp 价电子电离顺序:npns(nl)d(n2)f第
16、32页/共51页4.4.元素周期系与核外电子分布的关系元素周期系与核外电子分布的关系 (1)(1)、周期、周期 如何确定元素在周期表中的周期数如何确定元素在周期表中的周期数?方法方法:最后一个电子填入的能级组序号最后一个电子填入的能级组序号,为该元素的周期数。,为该元素的周期数。如如:3535Br Ar3dBr Ar3d10104s4s2 24p4p5 5 ;4747Ag Ag Kr4dKr4d10105s5s1 1 显然:显然:各周期内所含的元素种数各周期内所含的元素种数 =相应能级组内轨道所能容纳的电子数相应能级组内轨道所能容纳的电子数第33页/共51页2、元素周期系中元素的分区:根据原子
17、价层电子构型的不同,可以把周期表中的元素所在位置分成s.p.d.ds 和 f五个区。3、族(主族、副族):周期系分为7个主族(A),7个副族(B)及第族,零族。第34页/共51页s 区:ns12 p区:ns2np16 d 区:(n1)d1-9ns12 ds区:(n1)d10ns12 (Pd无 s 电子)f 区:(n2)f014(n1)d02ns2结构分区:第35页/共51页4.4 4.4、原子性质的周期性、原子性质的周期性 原原子子的的电电子子层层结结构构随随核核电电荷荷的的递递增增呈呈现现周周期期性性变变化化,原原子子的的某某些些性性质质,如如原原子子半半径径、电电离离能能、电电子子亲亲合合
18、能能和和电电负性等负性等,也呈周期性变化。,也呈周期性变化。第36页/共51页1.原子半径 原子没有鲜明的界面,所以原子半径是根据原子存在的不同形式来定义,常用的有三种:(1)共价半径:两相同原子形成共价键时,其核间距的一半,称原子的共价半径,如ClCl核间距为198pm,rCl=99pm。有共价单键、双键、叁键。通常指共价单键半径。(2)金属半径:金属单质的晶体中,两相邻金属原子核间距离的一半,称金属原子的金属半径,如dCu-Cu=256pm,rCu=128pm。(3)范德华半径:在分子晶体中,分子间以范德华力结合,如稀有气体相邻两原子核间距的一半,称该原子的范德华半径。如dNe-Ne=32
19、0pm,rNe=160pm。第37页/共51页原子半径变化规律:(1)周期:主族:由左向右,随核电荷的增加,原子共价半径的变化趋势总的是减少的。d区:由左向右,随核电荷的增加,原子半径会略有减少,从IB起略有增大。这是由于(n1)d轨道的充满,较为显著地抵消核电荷对外层ns电子的引力。第38页/共51页f区:镧系元素从La到Lu整个系列的原子半径减小不明显的现象称为镧系收缩。从La到Lu共经过15种元素,原子半径仅收缩了12pm左右,La系收缩影响很大,使La后第六周期元素与上周期同族元素半径接近。第39页/共51页 元素的原子半径变化趋势第40页/共51页(2)族:主族,从上到下,r显著增大
20、。副族除Sc副族外从上到下一般略增大,第五、六周期元素半径接近。r对性质的影响:r越大,越易失电子;r越小,越易吸电子。注意:难失电子不一定易得电子,如稀有气体,得失电子都不易.第41页/共51页2.电离能(I)和电子亲合能(EA):(1)、电离能(I)气态原子失电子变成气态阳离子克服核电荷的引力所需要的能量,单位:kJmol-1。从基态中性气态原子失去1个电子形成气态“+1”氧化值阳离子所需能量,称I1。依次类似有I2等。如:Mg(g)-e-Mg+(g)I1=H1=783kJmol-1 Mg+(g)-e-Mg2+(g)I2=H2=1451kJmol-1显然I值越大,失电子越难,因此I可用于衡
21、量失电子难易。I的变化规律:(1)周期:主族,从左到右,I1渐增大;过渡元素,不规律;(2)族:主族,从上到下,I1渐减少(原子半径增大);过渡元素略增大(核电荷起较显著作用,r增加不多)。第42页/共51页注意:I只能衡量气态原子失电子变为气态离子的难易,至于金属在溶液中发生化学反应形成阳离子的难易,应根据电极电势来估量。第43页/共51页(2)、电子亲合能(EA)基态的气态原子得到一个电子形成气态-1氧化值阴离子所放出的能量,称原子的EA1 。如 O(g)+e-O-(g)EA1=-141kJmol-1 一般为负值,因电子落入中性原子的核场里,势能降低,体系能量减小,稀有气体(ns2np6)
22、和IIA原子(ns2)最外电子亚层已全充满,若加合一个电子,环境必须对体系做功,EA1 为正值。所有EA2都为正值。O-(g)+e-O2-(g)EA2=780 kJmol-1 EA1代数值越小,原子越易得电子。EA1 得电子难易变化规律:无论是周期或族中,主族元素的EA1 的代数值一般都是随着原子半径减小而减小的。同周期从左到右EA1 总的是(代数值)减小的(r减小)。主族从上到下,EA1 总的趋势(代数值)是增大的(r增大)。第44页/共51页注意:I和 EA1 仅表示孤立气态原子或离子得失电子的能力。EA1(N)为正值,是 p 区元素中除稀有气体外唯一的正值。EA1 代数值最小的是 Cl
23、原子而不是 F 原子。第45页/共51页 原子在分子中吸引电子的能力称为元素的电负性,用 表示。电负性标度不同,数据不同,但在周期系中变化规律是一致的。电负性可以综合衡量各种元素的金属性和非金属性。同一周期从左到右电负性依次增大;同一主族从上到下电负性依次变小,F 元素 为3.98,非金属性最强。电负性的标度有多种,常见的有Mulliken标度(),Pauling标度()和Allred-Rochow 标度()。3.电负性第46页/共51页电负性()变化第47页/共51页4.元素的氧化数元素的氧化数与原子的价电子数直接相关。(1)、主族元素的氧化数主族元素原子只有最外层是价电子,能参与成键,因此
24、:主族(该F.O外),最高氧化数=价电子总数。(2)、副族元素的氧化数IIIB-VIIB:元素的最高氧化数=价电子总数,价电子(n-1)d1-5ns2。但:IB和族元素的氧化数变化不规律,IIB的最高氧化数为+2第48页/共51页5.元素的金属性和非金属性规定:易失电子变成阳离子即金属性强;若易得电子变成阴离子则非金属性强。元素金属性与非金属性的强弱,可用原子参数(原子的半径、I、EA、X等)进行比较:元素原子的I越小,或电负性X越小元素金属性越强。元素原子的EA的代数值越小,或X越大元素非金属性越强。变化规律:(1)同周期:主族:从左到右,X渐增大,元素的金属性渐减弱,非金属性渐强。副族,不规律(2)同族:主族,从上到下,元素原子的X减小,金属性渐强,非金属性渐弱。副族,不规律第49页/共51页基本要求:1、掌握四个量子数对核外电子运动状态的描述,及s、p、d原子轨道和电子云角度部分的形状和伸展方向。2、熟练掌握原子核外电子排布的一般规律及其与元素周期表的联系。3、能从原子半径、电子层结构和有效核电荷来了解元素一些性质(电离能、电子亲合能、电负性、元素的氧化数、元素的金属性和非金属性)的周期性变化规律。第50页/共51页感谢观看!第51页/共51页
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
