 单质、氧化物、酸碱盐的相互转化关系
单质、氧化物、酸碱盐的相互转化关系


《单质、氧化物、酸碱盐的相互转化关系》由会员分享,可在线阅读,更多相关《单质、氧化物、酸碱盐的相互转化关系(7页珍藏版)》请在装配图网上搜索。
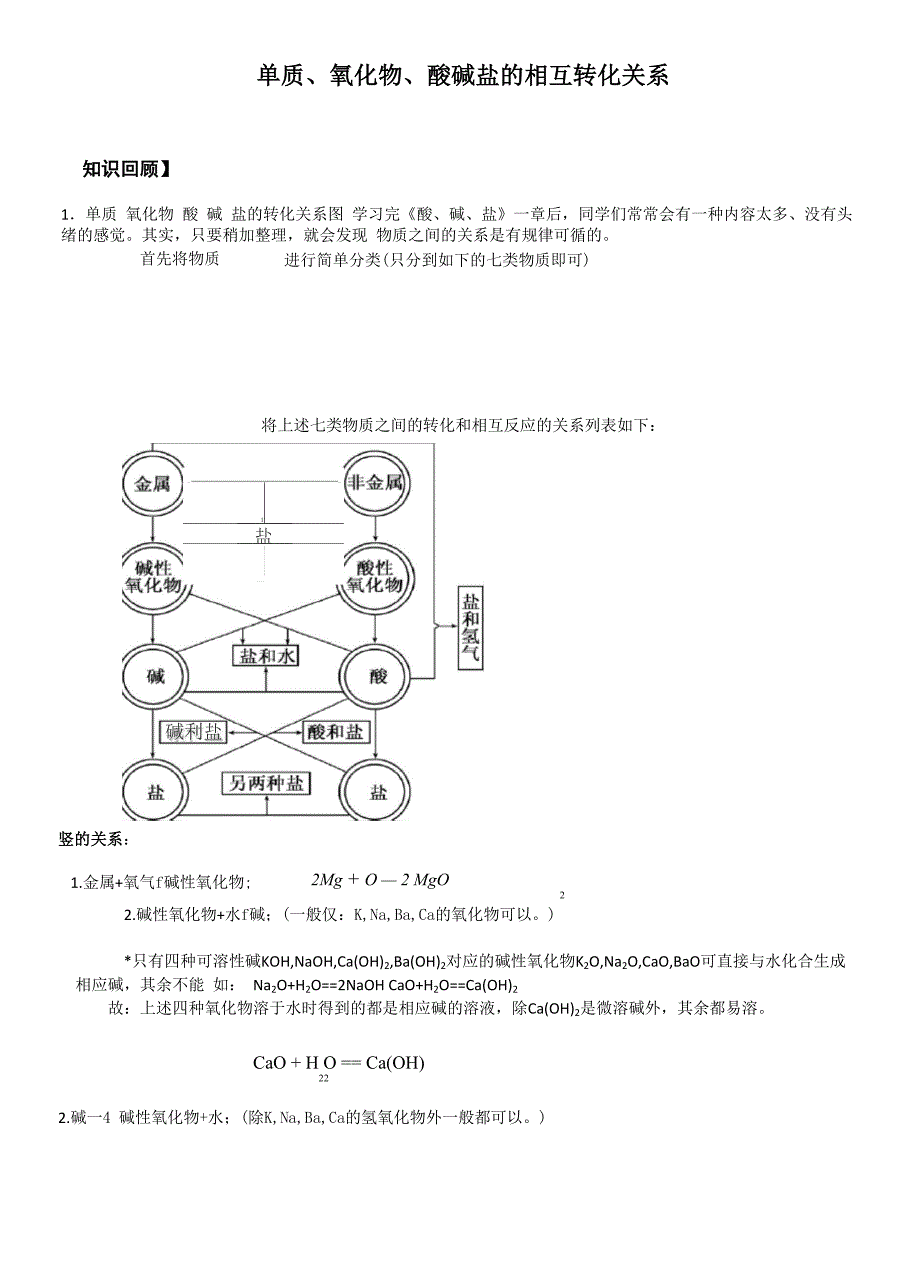
1、单质、氧化物、酸碱盐的相互转化关系知识回顾】1单质 氧化物 酸 碱 盐的转化关系图 学习完酸、碱、盐一章后,同学们常常会有一种内容太多、没有头绪的感觉。其实,只要稍加整理,就会发现 物质之间的关系是有规律可循的。进行简单分类(只分到如下的七类物质即可)首先将物质将上述七类物质之间的转化和相互反应的关系列表如下:碱利盐1盐竖的关系:1.金属+氧气f碱性氧化物;2Mg + O 2 MgO22.碱性氧化物+水f碱;(一般仅:K,Na,Ba,Ca的氧化物可以。)*只有四种可溶性碱KOH,NaOH,Ca(OH)2,Ba(OH)2对应的碱性氧化物K2O,Na2O,CaO,BaO可直接与水化合生成 相应碱,
2、其余不能 如: Na2O+H2O=2NaOH CaO+H2O=Ca(OH)2故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH)2是微溶碱外,其余都易溶。CaO + H O = Ca(OH)222.碱一4 碱性氧化物+水;(除K,Na,Ba,Ca的氢氧化物外一般都可以。)Cu(OH)上=CuO + H O22a、不溶性碱受热才能发生分解反应b、反应前后元素的化合价不变(特别注意金属元素的化合价)如:2Fe(OH)3 亠 Fe2O3+ H2OCu(OH)2 亠 2CuO+H2O3.碱+酸一盐+水;碱+盐一新碱+新盐)4.非金属+氧气一酸性氧化物;4 P + 50 =燃 2 PO225
3、5.酸性氧化物+水一酸;(一般都可以,但Si02不行。)CO + H O = H CO2 2 2 3碱盐(有三种方法);(即:酸性氧化物+碱一盐+水;氧外的非金属元素的化合价)* a除SiO2外,其余酸性氧化物一般都能直接与水化合生成相应酸 b、反应前后元素的化合价一定不变(特别注意除氢、 如: CO2+ H2O=H2CO3SO3+ H2O= H2SO4故:酸性氧化物溶于水时得到的都是相应酸的溶液。6.酸一4 酸性氧化物+水;(一般都可以,但硫酸不行。)H CO = CO T + HO2 3 2 2氧外的非金属元素的化合价)* a、仅有含氧酸才能分解b、反应前后元素的化合价一定不变(特别注意除
4、氢、c、酸性氧化物又叫酸酐(原因是:酸性氧化物可看作是含氧酸脱水的产物) 如: H2SO3 亠 h2o+ so2f H2CO3 亠 h2o+ co2 f例1根据下表列出的氯的含氧酸跟它对应的氧化物(叫酸酐)的化合价关系判断HN0的酸酐是3含氧酸HC1Ohcio2hcio3HclO4对应酸酹012OCI2O3C12O5叫5A.NO B N2O5 巴。3UNO例2-写出下列几种含氧酸的酸酐:H2SO4HNO3 IPO7.酸盐(有三种方法);横的关系:H2SO31.金属+非金属一盐(无氧酸盐);2 Na + Cl =燃 2 NaCl22.碱性氧化物+酸性氧化物一盐(含氧酸盐);CaO + CO =
5、CaCO233.碱+酸一盐+水(中和反应);4.盐+盐一新盐+新盐()Cu (OH ) + 2HCl = CuCl + 2H O2 2 2AgNO + NaCl = NaNO + AgCl I 白色)33斜的关系:1.碱性氧化物+酸f盐+水;Fe O + 6HCI = 2FeCl + 3H O23322. 酸性氧化物+碱f盐+水;3. 碱+盐f新碱+新盐;(SO + 2NaOH = Na SO + HO2232Ca(OH) + Na CO = 2NaOH + CaCO l 白色)2233* a、参加反应的碱和盐必须都是可溶的b、必须符合复分解反应发生的条件c、可溶性碱跟铵盐一定能反应(原因是该
6、反应一定有水和氨气生成)如:2NaOH+CuSO4=Na2SO4+Cu(OH)2 (3NaOH+FeCI3=3NaCI+Fe(OH)3 (Ca(OH)2+2NH4Cl=CaCl2+H2O+NH3 f4. 酸+盐f 新酸+新盐;()CaCO + 2HCl = CaCl + CO T+ H O3222*a、只要符合复分解反应发生的条件即可b、碳酸盐跟酸一定能反应(原因是该反应一定有水和二氧化碳生成)如: HCI+AgNO3=AgCM +HNO3H2SO4+BaCI2= BaSO4 ; +2 HCI2 HCI+CaCO3=CaCI2+H2O+CO2f5. 金属+酸f 盐+氢气;()Zn + H SO
7、 ZnSO + H T2 4 4 2* a、这里的酸通常是指盐酸和稀硫酸(硝酸、浓硫酸跟金属反应一般不产生氢气)b 、只有排在(氢)前面的金属才能置换出酸中的氢c、铁跟盐酸和稀盐酸反应生成亚铁盐如: Mg+2HCI=MgCI2 +H 2fFe+H2SO4= Fe SO4+ H2f6.金属+盐f新金属+新盐。()Fe + CuSO = FeSO + Cu44*a、盐必须是可溶的b、参加反应的金属必须排在盐中金属的前面c、K.Ca.Na 等活泼金属放入盐溶液时,发生的反应有两个,但不能置换出盐中的金属。如:把钠放入溶液中 发生的反应为:2Na+2H2O=2NaOH+H 2 f2NaOH+CuSO4
8、=Cu(OH)2 ; +Na2SO4d、铁跟盐反应生成的是亚铁盐。如 Fe+CuSO4=FeSO4 +CuCu+Hg(NO3)2=Cu(NO3 ) 2+ Hg 生成物要有沉淀或气体或水。反应物一般要能溶于水;但在4中,若酸是强酸,盐是碳酸盐,则盐能否溶于水 不做要求。 按金属元素活动顺序,进行反应。酸碱盐化学方程式(归纳总结)试题两个置换反应规律1酸+金属=盐+氢气反应条件:酸不能用强氧化性酸 金属必须位于氢以前Mg+ HCI=AI+ HCI= Zn+ HCI=Fe+ HCI=2.盐+金属=新盐+新金属如硝酸、浓硫酸,(常用稀硫酸、盐酸)常用 Mg、Al、Zn、Fe)Mg+ H2SO4=AI+
9、 H2SO4=Zn+ H2SO4= Fe+ H SO =24=反应条件:盐(反应物)必须溶于水123.12.3.金属单质(反应物)比盐中金属活泼,不用钾、钙、钠AI+ CuSO4=Cu+ AgNO3=Fe+CuSO4=Zn+CuSO4=Cu+Hg(NO3)2= 二.三个分解反应规律酸(含氧酸) =非金属氧化物+水 = H2O+CO2 f 碱(难溶性)=金属氧化物+水Cu(0H)2碳酸盐(难溶性)=金属氧化物+二氧化碳CaCO3日趕四个化合反应规律金属+氧气=金属氧化物 点魅Mg+O2金属氧化物+水=碱(可溶性)CaO+H2O=非金属+氧气=非金属氧化物占唸S+O2 f .占诞c+o2Fe(OH
10、)3 仝Fe+ O2点魅ACu+ O2 =Na2O+H2O=占堆p+o2=(碳不充分燃烧)点煙c+o2(碳充分燃烧)H2+O2点堆4.非金属氧化物+水=酸co2+h2o=四.五个复分解反应规律酸+碱=盐+水so3+h2o=SO2+H2O=(亚硫酸)1.Cu(OH)2+ HCI= AI(OH)3+ hci=Cu(OH)2+H2SO4= Mg(OH)2+ HNO3=2.酸+盐=新酸+新盐 反应条件:符合复分解反应发生的条件(实际反应条件很复杂)CaCO3+ HCI= Na2CO3+ HCI=AgNO3+ HCI=Na2CO3+H2SO4= H2SO4+BaCI2=H2SO4+Ba(NO3)2=3.
11、盐+碱=新盐+新碱反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉)CuSO4+ NaOH= FeCI3+ NaOH=Na2CO3+Ca(OH)2= CuSO4+Ba(OH)2=4.盐+盐=新盐+新盐反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉)NaCI+AgNO3= Na2SO4+BaCI2=Na2SO4+Ba(NO3)2=5.酸+金属氧化物=盐+水Fe2O3+ HCI= Fe2O3+H2SO4=CuO+ HCI= CuO+ H2SO4=MgO+ HNO3=五.其它反应1.碱+非金属氧化物=盐+水(不属于四种化学反应基本类型)2.3.4.NaOH+CO2=NaOH+SO3=三种还原剂虫2H2+CuONaOH+SO2=Ca(OH)2+CO2=C、o2 )跟氧化物反应(置换反应)高逞CO+Fe2O3C+CO2实验室制取三种气体(常用方法)KMnO4 Zn+ HCl=CaCO3+HCl=盐分解Cu2(OH)2CO3 =KMnO4 三种有机物燃烧 占魅CH4+ O2CH3OH+O2点魅C+CuOCO+CuO高逞(置换反应)(化合反应)KClO3 mOgZn+ H2SO4=CaCO3KClO3C2H5OH+O2高逞 n0 2点魅
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 新人版英语八年级下册Unit5总复习ppt课件
- 新人教部编版一年级语文上第五单元ppt课件(全套)
- 高鸿业经济学基础第十五章-总需求-总供给模型-授课-河北工大宋建林课件
- 新人教版高中数学《等差数列前n项和》课件
- 新人教部编版五年级语文上册第六单元测试卷课件
- 高鸿业微观经济学课件第4章生产论
- 高鸿业--微观经济学-第一章课件
- 新人教版部编本五年级下册语文13 人物描写一组 ppt课件
- 新人教版高中化学必修第一册——电解质的电离ppt课件
- 新人教版部编教材二年级下册第一单元3《贝的故事》优质课教学ppt课件
- 高风险作业培训讲义_002
- 新人教版语文三年级下册第五单元全套ppt课件部编版
- 新人教版英语八年级上册第二单元全部ppt课件
- 《走一步再走一步》重点课件
- 新人教版语文一年级上册:识字1《天地人》课件
