 物化公式归纳完整版
物化公式归纳完整版


《物化公式归纳完整版》由会员分享,可在线阅读,更多相关《物化公式归纳完整版(25页珍藏版)》请在装配图网上搜索。
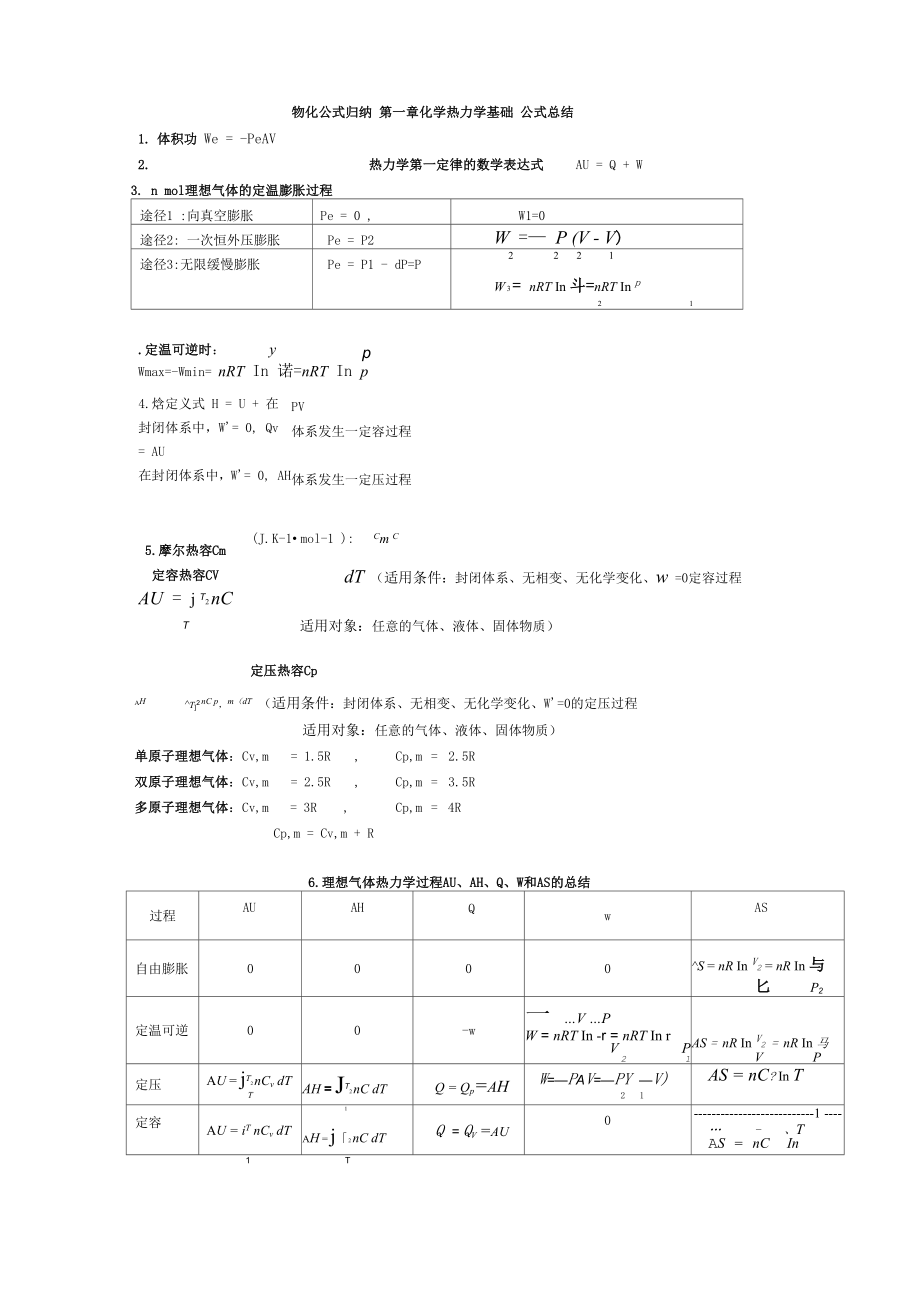
1、物化公式归纳 第一章化学热力学基础 公式总结1. 体积功 We = -PeAV2. 热力学第一定律的数学表达式AU = Q + W3. n mol理想气体的定温膨胀过程途径1 :向真空膨胀Pe = 0 ,W1=0途径2: 一次恒外压膨胀Pe = P2W = P (V - V)途径3:无限缓慢膨胀Pe = P1 - dP=P2221W 3 = nRT In 斗=nRT In p21.定温可逆时:ypWmax=-Wmin= nRT In 诺=nRT In p4.焓定义式 H = U + 在封闭体系中,W= 0, Qv = AU在封闭体系中,W= 0, AHPV体系发生一定容过程体系发生一定压过程5
2、.摩尔热容Cm定容热容CVAU = j T2 nCT(J. K-1 mol-1 ):Cm C适用对象:任意的气体、液体、固体物质)dT (适用条件:封闭体系、无相变、无化学变化、w =0定容过程定压热容CpAHt2 nC p,m(dT (适用条件:封闭体系、无相变、无化学变化、W=0的定压过程适用对象:任意的气体、液体、固体物质)单原子理想气体:Cv,m=1.5R,Cp,m=2.5R双原子理想气体:Cv,m=2.5R,Cp,m=3.5R多原子理想气体:Cv,m=3R,Cp,m=4RCp,m = Cv,m + R6.理想气体热力学过程AU、AH、Q、W和AS的总结过程AUAHQwAS自由膨胀00
3、00S = nR In V2 = nR In 与匕P2定温可逆00-w一 V PW = nRT In -r = nRT In rVP21AS = nR In V2 = nR In 马VP定压AU = jT2 nCv dTTAH = Jt2 nC dTQ = Qp=ahW=PAV=PY V)21AS = nC? In T定容AU = iT nCv dT1AH = j2 nC dTQ = QV =au01-、TAS = nCIn11T7. 定义:fHm。(kJ.mol-1)-标准摩尔生成焓H焓变;ArUm反应的摩尔焓变rHm。一298K时反应的标准摩尔焓变; fHm 0 (B)298K时物质B的标
4、准摩尔生成焓;cHm 0 (B) 298K时物质B的标准摩尔燃烧焓。8. 热效应的计算由物质的标准摩尔生成焓计算反应的标准摩尔焓变rH 0 m = Ev BfH 0 m ,B由物质的标准摩尔燃烧焓计算反应的标准摩尔焓变rH 0 m = -Ev BcH 0 m ,B9. Kirchhoff (基尔霍夫)方程rHm (T2) = rHm (T1)+如果ACp为常数,则rHm (T2) = rHm (T1)+ Cp ( T2 - T1)10.热机的效率为n = _也=4W = 1+Q对于卡诺热机QQ1Q1W = 3 = 2RQ1Q1To=可逆循环过程T + J 0 .T T12 X (-r)Ti(不
5、等式中, ”号表示不可逆过程,=”号表示可逆过程 “ T ”一环境温度,对可逆过程也是体系温度.)13.熵增原理 S孤立N 0(孤立体系的嫡永不减少)不可逆过程,自发过程=可逆过程,体系达平衡.对于封闭体系 S孤立=,封闭+ ,环境 N 0-不可逆过程,自发过程-=可逆过程,体系达平衡AS环境14. 定温定压的可逆相变 AS = nH m,相变T15. 化学反应熵变的计算rS 0 m = EVBs 0 m,B16. rH 0 m 和rS0m 与温度的关系:ArH 0 m (T2) = rH 0 m (T1) + j 2 C dT rS 0 m (T2) = rS 0 m (T1) + jTT2
6、 ACdT TT1第二章自由能、化学势和溶液 公式1. 第一和第二定律的联合公式为TdS -dU -PdV +5 WM 0ee2. 吉布斯自由能定义式G = U + PV - TS = H - TS G= AH-T AS(G-体系的状态函数(J ),绝对值无法测量)3.在定温定压下 有如下关系: G=W最大4.吉布斯自由能判据厂 不可逆过程,自发过程dG 0T, P ,WfJ= 可逆过程,平衡态AG反方向为自发过程5.判断过程方向及平衡条件的总结状态函数体系应用条件判据S隔离任意过程AS 0自发过程=0可逆过程,平衡S封闭任意过程AS体+ AS环 0自发=0可逆,平衡G封闭定温定压W=0 0
7、反方向自发F封闭定温定容不做其它功 0 反方向自发6定压下.对任意相变或化学变化(竺G AS dT P7.定温物理变化AG的计算(W=0的封闭体系).理想气体定温过程AG =jP2 VdP = jP2 LdP = nRT In 乌T P P PP.纯液体或纯固体的定温过程A G_ j P2VdP_ V (P-P )Tp 11l 21A G_ j P2 V dP_ V (P-P)Tp ss 211.定温定压可逆相变dG = -SdT + VdPdT = 0dP=0G T , P, W = 0。定温定压不可逆相变必须设计可逆过程来求算,由于AG定温条件下的计算公式简单,因此设计定温变压 可逆途径求
8、解.而计算不可逆相变的AH和AS时,是设计定压变温可逆途径进行求解.8 .化学反应AG的计算 化学反应 r Gm 9的计算 。由物质的fGm9求算rG 9 m = Ev BAfG 9 m ,B。由反应的 rH 9 m 和 ArS 9 m求算rG 9 m = rH 9 m - TrS 9 m 。估计该反应能自发进行的最高温度/0 反方向为自发过程A S J - 424 c9.在指定压力下温度对反应自发性的影响AHASAG=AH-TAS反应的自发性+在任意温度下反应均可自发+任意温度下反应都不能自发+低温时+高温时一在低温下反应不能自发在高温下反应能自发进行低温时一高温时+在低温下反应能自发进行
9、在高温下反应不能自发进转折温度T = AH/AS10.偏摩尔量的定义式:条件:定温定压(Z代表任一广度性质)对于纯物质的均相系统,偏摩尔量即为该物质的摩尔量11. 偏摩尔量的集合公式Z = 5 ,m12. 化季势定义式=(冬在一定的温度, 用下式计算纯组分:13. 化学雷(偏摩条箸布斯自由能)集合公式压力和浓度的条件下,多组分体系处于一定的状态,体系的吉布斯自由能可Z G =n B BBG厂 = = Gn m14. 化学势与温度的关系(虬)=_ S2T P, nB ,m15. 化学势与压力的关系5r(-b )= VQP T , nB ,m16. 化学势判据在定温、定压、W=0的封闭体系中 自发
10、过程dG = BdnB 反方向为自发过程17. 化学势判据与相平衡设在定温、定压、W=0的条件下,有dni mol的i物质从a相转移到p相, dG T, P, W=0 = (uiB -ui a)dni若uiBuia则dG uia则dG 0;物质从B-a相的转移是自发过程;(3)若uiB=uia则dG =0;体系处于相平衡状态.18. 化学势判据与化学平衡对定温、定压、W= 0 ,且g = 1mol的化学反应 aA + bB gG + hHZLrGm =V b b=gG + hH 一 aA 一 bPB(定T ,定P , W 0 ,= 0 ,0 ,=0的封闭体系,反应正方向自发反应达到平衡逆反应方
11、向自发化学反应方向与限度的判据.由化学势高的物质自发生成化学势低的物质)19.气体的化学势与标准态物质化学势表示式标准态标准态符号备注单组分理 想气体P (T, P) = o (T) + RT In PoT、P。下的理想气, P):=O(T)+P为该理想气体 的压力P混合理想 气体之B 组分P四(T, P)=日0 (T) + RT ls- BBP0T和分压为P。下的纯,P组 分的理想气体状态.日0(T) +BPT宛P中理想 气体的分压单组分实 际气体f日(T, P)=日0 (T) + RT lnfP0T、P。下的理想气体阳,P )二:呻(T)+一Tl为逸度混合实际 气体之B 组分七(T, P)
12、=四 B (T) + RT ln fT、P。下,具有理想气体 性质的纯气体状态(假想 状态)目(T , P )二B目0 (T )- BfB=yBPB、P卜 RT ln bp理想溶液 混合物中 组分B旦= (T, P) + RT ln x 一 P *日* (T ,P*)=日 o (T) + RT ln 部日B(t,PB)P各组分遵守Raoult忽略压力对PB*的影响稀溶液溶 剂旦=旦 * Q, P*) + RT ln xT、P。下,纯溶剂状态日A(T,PA)该溶剂遵守Raoult定律稀溶液溶 质七=日0 (T, P ) + RTln xs八k% P) M +R*T, P时,仍然符合Henry 定
13、律的液态纯溶质(假想状 态)谡,x(T,P )该溶质遵守Henry定律非理想溶液中的组分B日A =心(T, P*) + RT lna A & =诚/ T,P ) + RTlnaBT、P。下,纯溶剂状态T, P时,仍然符合Henry 定律的液态纯溶质(假想状 态)日A(t,p*) 吧 x(T,P )溶剂不遵守Raoult定律溶质不遵守Henry定律20.拉乌尔定律PA = P*七(PA,PA*分别表示定温时稀溶液中的溶剂的饱和蒸气压与 该温度时的纯溶剂的饱和蒸气压,xA是溶液中溶剂的摩 尔分数).溶液的蒸气压下降Ap =p*-p = p* - p*xA =p*(1-xA)= p*xB.溶液沸点升
14、高Atb = tb tb* = Kb. bB(Kb沸点上升常数,与溶剂有关。)气=R (t2 M (A)vap m(tb*一纯溶剂的沸点,AvapHin 一溶剂的摩尔蒸发焓) .溶液的凝固点降低Atf = tf*tf = Kf bB(Kf凝固点下降常数,与溶剂性质有关。) H A M (A)fus mR(t *)2(tf*一纯溶剂的凝固点,AfusHm一溶剂的摩尔熔化焓)难挥发非电介质稀溶液依数性总结溶液的依数性公式单位溶液蒸汽压下降Ap = p*xBkPa溶液沸点升高Atb = Kb bBC溶液凝固点下降Atf = Kf bBC溶液渗透压n= bBRTkPa第三章公式归纳1. C = S -
15、 R - RC组分数S 物种数R体系中独立的化学平衡数R-体系中独立的浓度关系数(只有在同一相中才能用此条件)2. 相律f = C - P + 2(只适用于平衡体系,式中“2”指的是温度和压力)另外:f* = C - P + 1定温过程或定压过程f* = C- P定温和定压过程(f*-条件自由度)3. 单组分体系f = C - P + 2=3-P4. 水的相图:pZkPj101.3250.6110 00985.Clapeyron 方程dP _ AHm_dTTAVm对 z L g100(1) 相区-面AOB面一气态水的单相区。P = 1 f = 2AOC面一液态水的单相区。P = 1f = 2B
16、OC面一固态水的单相区。P = 1f = 2(2) 相线OA线一水的饱和蒸气压曲线,水和水蒸气两相平衡共存,P = 2 , f = 1 ;OB线一冰的饱和蒸气压曲线,冰与水蒸气两相平衡共存,P = 2 , f = 1 ;OC线一冰的熔点曲线,冰和水两相平衡共存,P = 2 , f = 1 ;(3)三相点O点一三相点,液、固、气三相平衡,P = 3 , f = 0(适用条件-任何纯物质的任意两相平衡.)T, P-为可逆相变时的温度和压力.AHm -定温、定压可逆相变时的摩尔相变热.j AVm -定温、定压可逆相变时的摩尔体积变化 AaHdTRT 2d In P _ A H对 s = g 的mdT
17、RT 26.Clausius - Clapeyron 方程d In P _ AH mdT RT 2其定积分式in P * (1 -1)PR 二 T27. 二组分双液体系f = C - P + 2 = 4 - P8.二组分双液体系图定温,p-x图,y)图9 .杠杆规则:蒸气相组成:yA=pA/p=(pA*xA)/pyB=pB/p=(pB*xB)/pPbpA=pA*xApB=pB*xBp=pA+pBc是总压与溶液组成的关系线,称 为液相线p与x呈线性函数关系两相共存!i液相iBf X物系点M,相点P, Q,联结线PQ,系统温度Tb,总组成XB,M,物质的量ng,nl,n总互比量n PMg - n
18、mq第四章化学平衡1.化学平衡的条件(适用条件-定T,P,W= 0的封闭体系化学反应方向与限度的判据)aA + bB gG + hHzr 0 ,逆反应方向自发=gG + 四 H a A b B2.化学反应定温式(ce=1mol.L-1;分压以Pa或kPa为单位代入,p0=105Pa=100kPa;)(1)理想气体反应分压商P,P,(孑)g(寸)h Q =P eP eP(XL) a (PPePe化学反应定温式ArG = ArG 0 + RT ln Q(rGm (T)所求状态(任意)下反应的自由能变rGm 9 (T)标准状态下反应的自由能变Q所求状态(任意)下的分压商(反应商)ArG = rGe
19、+ RT In QpQP KP0 KP0 QP = KP0=-RT In K e + RT In Qp = RT 吐P反应向右自发进行反应向左自发进行反应达到平衡,则 ArGm 0,贝U ArGm = 0在反应达到平衡时,ArGm = 0-ArGe =- RT ln K emP(2)溶液中的反应日=(T) + RT InB B反应商:Q =C(CCA)a (C)CB_C e任意状态ArGe( Ce) = - RT In K emCArG = ArG。+ RT In QC=-RT In K C + RT In QC = RT QC若溶质的浓度用m表示,&G。(渺)=-RT ln KemmWG =
20、-RT In K e + RT In Q其中(土)g(也)hmmmq = memem (书a(兴沪meme(3)实际溶液(溶质参加反应)用活度代替浓度即可.ArG =- RT ln K e + RT In Qk e = aG&aH”a aAaaDdQ = (aj) (a Z)a (a A)a (a B)b(4)多相反应反应体系中,气体是理想气体,液体和固体是纯物质,则平衡常数的表达式中只出现气体的 分压和溶液浓度.例:CO2 (g) + H2 (g) = CO (g) + H2O ()PCO3. 标准平衡常数的计算(1) .对气相反应或纯物质间发生的反应A rG e = - RT ln K e
21、m(ArG Om = v BAfG 0 m ,BrG 0 m = ArH 0 m - TArS 0 m )(2) .对稀溶液中的反应ArG (Ce)=-RTlnKe mC(ArGo(Co) = Z vBAfGe(Ce)5.- Vant Hoff 公式d In Ke _ ArHe=mdTRT 2ln 0 = AH dKe (T)R T1 J第五章电解质溶液1. Faraday 定律Q =顽广Q -通入溶液的总电量(c );F1mol电子所带的电量(Faraday常数)F = Le = 96485 c/moln -在阴极或阳极上发生电极反应、只含单位元电荷的物质的摩尔数.也是阴极-或阳极上转移的电
22、子的摩尔数。-2. 含单位元电荷的物质对正离子对负离子对电解质3. 离子的电迁移对只有一种正负离子的电解质:+U-q+ + qU+ +U-q+ + qU+U-U+对给定的溶质、溶剂,在一定的温度和浓度下,离子的迁移速率只与电场强度有关:dEdEdl4. 电导G =K厂G电导,导体的导电能力A -r-电概面租3 ) 口两电极i团的距离5.电导率=gL = 1A R Al / A -电导池常数6.摩尔电导率(C -电解质的浓度)7.Kohlrausch (科尔劳施)离子独立移动定律M A tv Mz + +v Az-A =v A +v Am,+m .一如 H2SO4A- = 2 A-+A-.、一叽
23、m, H +m, SO 2-例也.弱电解质4J、财口 = A.+ A却丁岫匕- + %: 十 A; w + A:f.27.AC,Nq*CI用 0难溶盐二.;皿,i 7 .广 ,CaF 狎 丁【1秫、厂A00 _L 7 V + ? 或 + V _- 7,vrn,Ca+, F-flf ,Mi+ftt ,Cl_ J A .Cad?,iJjMCL8.测弱电A质的离解度 a =mAm9. 求难溶盐的电导率K (盐):K (盐)=K (溶液)- K (H2O)10.求难溶盐的溶解度C (mol - m-3),(把溶液看作是 无限稀的溶液):C = K(盐)=K(溶液)-K(H2O)A-(盐)A-(盐)mm
24、、/”定、山的侑的 .3/ir 4 T x _M +1-4 =离于平均活度十l =11+1 r 离子平均活度系数:/土离子平均浓度:=y=(W,旦在一运浓度范国内可计算。12. 某强电解质Mv+Av-的浓度为b13. 离子强度14. DebyeHuckel (德拜一休克尔)极限定律logy =-AZ Z公式适用条件:log Y71/b=-AZ Z.一 +、I / bo公式适用条件:=L b)v+ (v b)v+-I 0.01 mol kg-10.01 I 6 E0ArGm V0电池反应可以自发进行6 +=6 E = 0ArGm =0平衡;。+V6 E V0ArGm 0电池反应不可以自发进行6.
25、dEAS 广 nF (祈)p切E.A H =-nFE + nFT ()8EQ = TA S = nFT (-)7.In K 0nFE 0rT298K:E0= 0.059lgK0nRr m0J p8. 浓差电池例 Ag (s)AgNO3 (a1)| |AgNO3 (a 2)| Ag (s)E =竺In久 nF 与9.求 PH醌氢醌电极n2.303RTq = y phQ QFQHQH将醌氢醌电极与甘汞电极组成原2电池:甘汞电极I醌氢醌饱和的PH待测液I Pt2.303RT 风E =0PH qqF甘汞QH 2(Q0Q E) FPH =-甘汞2.303RT第八章动力学1. 化学反应速率对定容条件下的化
26、学反应 aA +dD gG +hH化学反应速率_ 1 dC _ 1 dC _ 1 dC _ 1 dCa dtd dtg dt hdt2. 化学反应速率方程(动力学方程):对基元反应:a A + b B + 一 产物质量作用定律r = kCaCb A Ba + b +反应级数零级反应r=k , k的量纲为mol.L-1.s-1一级反应r=kc, k的量纲为s-1;二级反应r=kc2 , k的量纲为(molL -1)-1 s-13.经验速率方程复合反应经验速率方程a A +b B +一 产物r = kCnACnBA Bk -速率常数;有量纲。nA、nB。- A物质、B物质的分级数。n = nA +
27、 nB +反应级数;4.简单级数反应的特征(重要)级数类型K的量纲速率公式积分式直线关 系t1/21A Pt-1、a 一 x 7 ln= k ta1ln(a-x)tln2 0.693 t =1/2 kk2nA P(只有一种反应物)c-1t-1171a x - k2t + a1t a 一 x111 n = -12k aA+B P(A和B初始浓度 相等)C-1.t-11 1 a x + a1 ta 一 xt y(A)11(B) 7 /2/2k2aA+ P(A和B初始浓 度不相等)C-1.t-11 i b(a x) In k a ba (b x)2a疽) (b x)tA)” 12( B)0廿 PC.
28、t-1x k txtat / 15.vant Hoff经验规律:温度每升高10C,反应速率大约增加2t + 10k 4 倍=2Arrhenius经验公式(1).微分形式d ln k E a dT RT 2(2).不定积分形式(3).定积分形式(4).指数形式 E 1 八 ln k a + CR Tln k(T2) - Ea C1 1) k (T)R 二T2k AeEa rtaC -积分常数T: K 1 )(公式应用范围:中等压力,单分子层吸附)7. Langmuir吸附定温式M1 + bP第十二章溶胶1.分散体系的分类类型颗粒大小例子特 性粗分散体系(乳状液、悬浊液) 10-7 m泥浆牛奶红血
29、球(7500nm)粒子不能透过滤纸,不扩散,在一般显 微镜下可见,多相态。胶体分散系(溶胶、高分子 溶液)10-710-9 mFe(OH)3 溶胶蛋白质溶液(均相 体系)粒子能透过滤纸,不能透过半透膜,扩 散慢,多相态,在超显微镜下可见。高分子溶液是均相体系。分子分散系(离子分散系) Cl- Br- I-对负溶胶:Cs + Rb + K + Na + Li+3)同号离子对溶胶有一定的稳定作用,降低电解质的聚沉能力,且同号离子的价数越高, 电解质的聚沉能力越弱。4)混合电解质(了解)(1)离子加和作用(2)离子敏化作用(3)离子对抗作用第十三、十四章乳状液和高分子溶液1. 乳状液-一种液体以小液
30、滴(直径大于100nm)的形式分散于另一不相溶的液体中而 形成的多相分散体系,属于粗分散体系。2. 乳状液的分类:1)水包油型(O / W ):2)油包水型(W/O )3. 要得到较稳定的乳状液,需要添加稳定剂-乳化剂,到底能形成何种类型的乳状液,只与所用乳化剂的性质有关,而与两种液体的相对数量无关。4. 乳状液的类型与乳化剂的关系1)如果乳化剂的亲水性大(对表面活性剂,则是HLB值大),则较易形成O/W型乳状液.2)如用憎水性的物质作乳化剂,则形成W/O型乳状液.5. 钠肥皂作乳化剂时,形成O/W型乳化剂,往此体系中加入CaCl2,则生成钙肥皂,使乳 状液转变为W/O型。6. 高分子溶液高分
31、子化合物在适当的介质中自动溶解而形成的均相分散体系,属于胶体分散体系.7. 高分子化合物的分子是由许多结构单体连接。如,天然橡胶分子:由几千个异戊二稀单体连接而成化学式表示为一(C5H8)n一C5H8 称为链节n 聚合度,数值在几百以上由同一种链节联结而成的高分子化合物称为均聚物.由多种链节联结而成的高分子化合物称为共聚物.不论是天然的还是合成的高分子化合物,其聚合度不一定相同,即所有分子的大小不一定相 同,是多级分散体系,因此,高分子化合物的相对分子质量是一个平均值。8.数均相对分子质量 Mn质均相对分子质量 Mm黏均相对分子质量 M门z均相对分子质量 MZ 相对分子质量小的级分对 相对分子
32、质量大的级分对 相对分子质量大的级分对 相对分子质量大的级分对Mn 贡献较大M贡献较大mM 的贡献介于M z的贡献大于Mn 与Mm之间9.1)对多级分体系 mz M M M2)分子越不均匀,即相对分子质量分布越色它们的差别就越大3)对单级分体系 mz = Mm = M = Mn10. 高分子化合物的相对分子质量分布D -分布宽度指数, 单分散系,D = 1 多分散系,D 1,且相对分子质量分布越宽,D越大.11. 高分子溶液与溶胶的异同:相同性质:1 .分散相粒子的大小均在10-710-9 m范围内2.分散相粒子的相对粒子质量皆不均一,且显一定分布,都是多级分散体系3 .扩散速度缓慢4. 不能透过半透膜不同性质:高分子溶液溶胶1.热力学稳定体系 不需稳定剂热力学不稳定体系 需要稳定剂2.均相体系分子自动溶解于分散介质溶质为单个的大分子体系服从相律多相体系粒子不能自动在介质中分散 粒子是许多小分子的集合体 体系不服从相律3.对电解质不很敏感对电解质非常敏感4. Tyndall弱Tyndall 强5.黏度大黏度小12. 由于空间稳定作用,使高分子对溶胶产生稳定作用,表现在体积限制效应和渗透压效应 两方面13.高分子溶液和电解质溶液对溶胶稳定性破坏之区别高分子溶液电解质溶液聚沉原因桥联效应压缩双电层, 使Z电势降低速度快慢沉淀颗粒疏松紧密用量量小量大
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
