 物理化学:第10章 电解与极化作用
物理化学:第10章 电解与极化作用


《物理化学:第10章 电解与极化作用》由会员分享,可在线阅读,更多相关《物理化学:第10章 电解与极化作用(46页珍藏版)》请在装配图网上搜索。
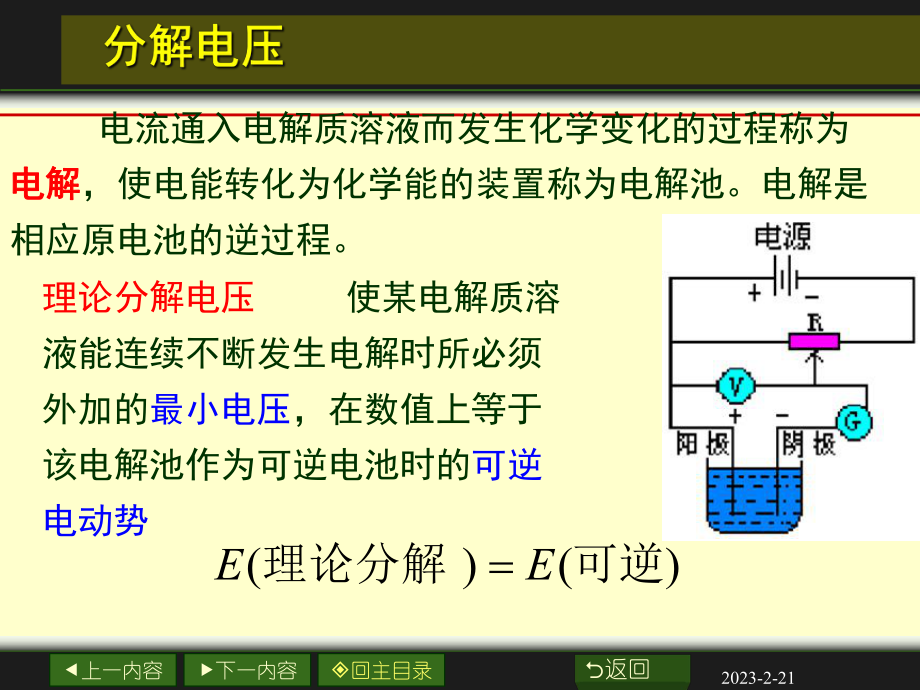
1、上一内容下一内容回主目录O返回2023-2-21理论分解电压 使某电解质溶液能连续不断发生电解时所必须外加的最小电压,在数值上等于该电解池作为可逆电池时的可逆电动势()()EE理论分解可逆 电流通入电解质溶液而发生化学变化的过程称为电解电解,使电能转化为化学能的装置称为电解池。电解是相应原电池的逆过程。上一内容下一内容回主目录O返回2023-2-21例如:用 Pt 作为电极电解 1 moldm-3的HCl溶液。电解反应为 阴极(负极)2H+2e-H2(g)阳极(正极)2Cl-Cl2(g)+2e-总反应为 2H+2Cl-H2(g)+Cl2(g)上一内容下一内容回主目录O返回2023-2-21 逐
2、渐增加外加电压,由安培计G和伏特计V分别测定线路中的电流强度I 和电压V,画出I-V曲线。测定分解电压的装置 测定分解压力的装置如图。上一内容下一内容回主目录O返回2023-2-21 外加电压很小时,几乎无电流通过,阴、阳极上无H2气和氧气放出。随着V的增大,电极表面产生少量氢气和氯气,但压力低于大气压,无法逸出。所产生的氢气和氯气构成了原电池,外加电压必须克服这反电动势,继续增加电压,I 有少许增加,如图中1-2段。PtgCldmmolHClgHPt)()()(2321 上一内容下一内容回主目录O返回2023-2-21 当外压增至2-3段,氢气和氯气的压力等于大气压力,呈气泡逸出,反电动势达
3、极大值 Eb,max。再增加电压,使I 迅速增加。将直线外延至I=0处,得E(分解)值,这是使电解池不断工作所必需外加的最小电压,称为分解电压。上一内容下一内容回主目录O返回2023-2-21析出电势析出电势 当外加电压等于分解电压时,两极的电极电势分别称为氢和氯的析出电势析出电势。从理论上讲,E(理论分解)=E(可逆),实际上分解电压常大于相应原电池的理论计算值:E(分解)=E(可逆)+E(不可逆)。这主要是由于电极上产生的极化作用使析出电极电势偏离理论计算的平衡电极电势造成的。上一内容下一内容回主目录O返回2023-2-21析出电势析出电势()()()()()EEEIRE分解可逆不阳可逆不
4、可逆阴 要使电解池顺利地进行连续反应,除了克服作为原电池时的可逆电动势外,还要克服由于极化在阴、阳极上产生的超电势 和 ,以及克服电池电阻所产生的电位降 。这三者的加和就称为实际分解电压。()阳()阴IR显然分解电压的数值会随着通入电流强度的增加而增加。上一内容下一内容回主目录O返回2023-2-21极化(polarization)当电极上无电流通过时,电极处于平衡状态,这时的电极电势分别称为阳极平衡电势 和阴极平衡电势 。()E 阳,平()E 阴,平 在有电流通过时,随着电极上电流密度的增加,电极实际分解电势值对平衡值的偏离也愈来愈大,这种对平衡电势的偏离现象称为电极的极化对平衡电势的偏离现
5、象称为电极的极化。本节讲四个问题:1 1 极化的类型;2 2 极化曲线;3 3 超电势:4 4 电解池与原电池极化的差别。上一内容下一内容回主目录O返回2023-2-21 根据极化产生的不同原因,通常把极化大致分为两类:浓差极化和电化学极化。(1)浓差极化 电解过程中由于扩散速度慢造成电极附近溶液的浓度和本体溶液的浓度的差别,其所引起的电极电势的改变称为浓差极化。例如:两个银电极在浓度为 m 的AgNO3溶液中电解。在阴极反应为 Ag+e-Ag 在阴极附近的Ag+沉积到阴极上,降低了它在阴极附近的浓度,若扩散速度慢,则在阴极附近Ag+的浓度将小于它在本体溶液中的浓度,就好象是将电极浸入一个浓度
6、较小的溶液中。上一内容下一内容回主目录O返回2023-2-21则阴极电极电势)(ln AgaFRTEE1 阴所以阴极电极电势要小于小于其平衡电极电势。同理,阳极电极电势则要大于大于其平衡电极电势。用搅拌和升温的方法可以减少浓差极化,但也可以利用滴汞电极上的浓差极化进行极谱分析。因此可看出,浓差极化是溶液扩散速度小于电极反应速度造成的。),()(平衡 AgaAga上一内容下一内容回主目录O返回2023-2-21(2)电化学极化 一个电化学反应过程包括:离子由溶液向电极的扩散迁移、电极表面吸附、得失电子反应、产物离开电极、产物扩散到溶液中。其总反应速度决定于慢因素。电化学反应速度小于外界电子输送速
7、度而引起的电极极化称为电化学极化。在阴极得电子反应速度慢,使得电子多于平衡时的电子的量,所以其电极电势更低,而在阳极失电子反应速度慢,使得电子少于平衡时的电子的量,所以其电极电势更高。总之,阴极极化的结果是使电极电势变得更负;阴极极化的结果是使电极电势变得更负;阳极极化的结果是使电极电势变得更正。阳极极化的结果是使电极电势变得更正。上一内容下一内容回主目录O返回2023-2-21)某一电流密度下的实际电极电势与其平衡电极电势之差的绝对值,称为超电势超电势,以表示。阳极上由于超电势使电极电势变大,阴极上由于超电势使电极电势变小。=f(T,j,离子浓度,溶剂性质,电极材料种类及其表离子浓度,溶剂性
8、质,电极材料种类及其表面性质面性质)只考虑电化学超电势上一内容下一内容回主目录O返回2023-2-21 实验证明,电极电势与电流密度有关。通过电极的电流密度(单位电极面积的电流强度)与电极电势之间关系的曲线,称为极化曲线极化曲线。极化曲线测定装置见书P43.参比电极鲁金毛细管工作电极辅助电极或对电极上一内容下一内容回主目录O返回2023-2-21(1)电解池中电极极化曲线电解池中电极极化曲线 随着电流密度的增大,两电极上的超电势也增大,阳极析出电势变大,阴极析出电势变小,使外加的电压增加,消耗电能增加。阳极是正极,阴极是负极,阳极电势的数值大于阴极电势的数值,所以阳极极化曲线位于阴极极化曲线的
9、上方。上一内容下一内容回主目录O返回2023-2-21原电池中电极极化曲线原电池中电极极化曲线 原电池中,负极是阳极,正极是阴极。随着电流密度的增加,阳极析出电势变大,阴极析出电势变小。由于极化,使原电池的作功能力下降。可以利用这种极化降低金属的电化腐蚀速度。上一内容下一内容回主目录O返回2023-2-21上一内容下一内容回主目录O返回2023-2-21 早在1905年,Tafel 发现,对于一些常见的电极反应,氢超电势与电流密度之间在一定范围内存在如下的定量关系j:此式称为 Tafel 公式。式中 j 是电流密度,a 是单位电流密度时的超电势值,与电极材料、表面状态、溶液组成和温度等因素有关
10、,b 的数值对于大多数金属电极来说相差不多。在常温下一般等于0.050V。(低电流密度)上一内容下一内容回主目录O返回2023-2-21 金属在电极上析出时超电势很小,通常可忽略不计。而气体,特别是氢气和氧气,超电势值较大。氢气在几种电极上的超电势如图。可见在石墨和汞等材料上,超电势很大,而在金属Pt,特别是镀了铂黑的铂电极上,超电势很小,所以标准氢电极中的铂电极要镀上铂黑。影响超电势的因素很多,如电极材料、电极表面状态、电流密度、温度、电解质的性质、浓度及溶液中的杂质等。上一内容下一内容回主目录O返回2023-2-21 电解质溶液通常用水作溶剂,在电解过程中,在阴极会与金属离子竞争还原。+H
11、 利用氢在电极上的超电势,可以使比氢活泼的金属先在阴极析出,这在电镀工业上是很重要的。例如,只有控制溶液的pH,利用氢气的析出有超电势,才使得镀Zn,Sn,Ni,Cr等工艺成为现实。上一内容下一内容回主目录O返回2023-2-211 实际分解电压2 阳极上的反应3 阴极上的反应4 金属离子的分离5 电解的应用上一内容下一内容回主目录O返回2023-2-21 在实际电解过程中存在极化现象,所在实际电解过程中存在极化现象,所以实际电解电压要比理论值高。以实际电解电压要比理论值高。原电池理论分解EE1 实际分解电压实际分解电压上一内容下一内容回主目录O返回2023-2-21阴极上的反应阴极上的反应
12、电解时阴极上发生还原反应阴极上发生还原反应。发生还原的物质通常有(1)金属离子,(2)氢离子(中性水溶液中 )。+7H10a 判断在阴极上首先析出何种物质,应把可能发生还原物质的电极电势计算出来,同时考虑它的超电势。电极电势最大最大的首先在阴极析出。对金属离子对氢离子上一内容下一内容回主目录O返回2023-2-21阳极上的反应阳极上的反应 电解时阳极上发生氧化反应。发生氧化的物质通常有:(1)阴离子,如 等,(2)阳极本身发生氧化。Cl,OH 判断在阳极上首先发生什么反应,应把可能发生氧化物质的电极电势计算出来,同时要考虑它的超电势。电极电势最小最小的首先在阳极氧化。上一内容下一内容回主目录O
13、返回2023-2-21金属离子的分离 如果溶液中含有多个析出电势不同的金属离子,可以控制外加电压的大小,使金属离子使金属离子分步析出分步析出而达到分离的目的。上一内容下一内容回主目录O返回2023-2-21多种金属离子共存多种金属离子共存M1 和和 M2a.a.若要若要M1先沉积,先沉积,必须必须 j j1 j j2222111lnlnjjazFRTazFRToo上一内容下一内容回主目录O返回2023-2-21b.要求要求M1和和M2完全分离完全分离,先沉积,先沉积M1,待其浓待其浓度降低至度降低至10-7a1时,时,2方才沉积。方才沉积。上一内容下一内容回主目录O返回2023-2-21上一内
14、容下一内容回主目录O返回2023-2-21 为了使分离效果较好,后一种离子析出时,前一种离子的活度应减少到原浓度的1/107,这样要求两种离子的析出电势相差一定的数值。710上一内容下一内容回主目录O返回2023-2-21c.若需若需M1与与M2同时共沉积同时共沉积 (形成合金形成合金)222111lnlnjjazFRTazFRToo上一内容下一内容回主目录O返回2023-2-21222111lnlnjjazFRTazFRToo上一内容下一内容回主目录O返回2023-2-21 阴极产品:电镀、金属提纯、保护、产品的美化(包括金属、塑料)和制备 及有机物的还原产物等。2H 阳极产品:铝合金的氧化
15、和着色、制备氧气、双氧水、氯气以及有机物的氧化产物等。常见的电解制备有氯碱工业、由丙烯腈制乙二腈、用硝基苯制苯胺等。电解的应用上一内容下一内容回主目录O返回2023-2-21一、填空与选择1.电解硫酸铜水溶液时,溶液的PH值将()。2.电池电池不可逆放电时,电流密度增加,阳极的电极电势变得更(),阴极的电极电势变得更(),两极的电势差();电池不可逆充电时电池不可逆充电时,电流密度增加,阳极的电极电势变得更(),阴极的电极电势变得更(),两极的电势差()。3.在电解池中,随着电流密度的增加,电解池的端电压(),消耗的能量()。上一内容下一内容回主目录O返回2023-2-214 电导池电极上镀铂
16、黑的目的是()。5 用铜电极电解CuCl2的水溶液,在阳极发生的反应是()A析出氯气,B析出氧气,C铜电极溶解,D析出金属铜6.电解时,当一定的电流通过一含有金属离子的电解质溶液时,在阴极上析出的金属正比于()A.阴极表面积;B.通过的电量;C.电解质溶液的浓度;D.溶液温度上一内容下一内容回主目录O返回2023-2-217.25时0.002mol.kg-1CaCl2水溶液中离子平均活度系数为,0.002 mol.kg-1 CuSO4水溶液中离子平均活度系数为,则()。8.溶液中KCl,、KOH和HCl的浓度均为0.001mol.dm-3,其摩尔电导率大小顺序为m(KCl)()m(KOH)()
17、m(HCl)。9 25时,在无限稀释下H+,Li+,Na+,K+离子的迁移率大小顺序为()。上一内容下一内容回主目录O返回2023-2-2110 德拜休克尔理论及其导出的关系式考虑到了诸多因素,但下列诸因素中哪点是未包括的()。A强电解质在稀溶液中完全电离;B 每一个离子都被带相反电荷的离子所包围;C每一个离子都是溶剂化的;D实际溶液与理想溶液行为的偏差主要是离子间的静电引力所致。上一内容下一内容回主目录O返回2023-2-2111 科尔劳施定律)1(CBmm适用于()A.弱电解质,B.强电解质,C.无限稀释溶液,D.强电解质稀溶液.12 K3Fe(CN)6水溶液,其质量摩尔浓度为m,离子平均
18、活度系数为,则此溶液的离子平均活度a等于()1.,2.3.4.上一内容下一内容回主目录O返回2023-2-2113 13 室温下用室温下用铂铂做两极做两极电解电解1mol.dm1mol.dm-3-3NaOH NaOH 溶液溶液,计算并回答,计算并回答问题。问题。(1)(1)写出电极反应并指出两极反应产物是什么?写出电极反应并指出两极反应产物是什么?(2)(2)电电解时的理论分解电压。解时的理论分解电压。(3)(3)电解时实际分解电压大于理论分电解时实际分解电压大于理论分解电压,为什么?解电压,为什么?(4)(4)相同条件下相同条件下电解电解1mol.dm-3NaSO1mol.dm-3NaSO4
19、 4溶液时溶液时,实际分解电压与,实际分解电压与电解电解1mol.dm-3NaOH1mol.dm-3NaOH溶液溶液时是否相同,为什时是否相同,为什么?么?已知:(H+H2)=0,(O2OH-)=0.401V。电极反应:(-)2H+(aq)+2e-H2(g)(+)2OH-(aq)1/2 O2(g)+H2O(l)+2e-21因此,阴极和阳极的产物分别是氢气和氧气。上一内容下一内容回主目录O返回2023-2-214)电解1mol.dm-3NaSO4溶液时,阴极有H+和Na+离子,EE(H+H2)=0,(Na+Na)=-2.714V 故阴极是H+离子还原为H2;在阳极OH-比SO42-容易氧化,故O
20、H-被氧化成O2,所以其分解电压与电解NaOH时相同。上一内容下一内容回主目录O返回2023-2-2114 25时电解含Ni2+(a=0.1)溶液,在Ni电极上氢的超电势为0.21V,为使Ni2+以一定速度析出,应施加比平衡电势高0.1V的电势,为防止H2析出,问溶液的pH应控制在多少合适?上一内容下一内容回主目录O返回2023-2-21当当析析(Ni2+Ni)析析(H+H),则Ni析出而H2不析出 pH2.86 上一内容下一内容回主目录O返回2023-2-21P 152,17题电解池1阳极(+)2Cl-Cl2(g)+2e阴极(-)2H2O+2e H2(g)+2OH-总反应:2NaCl+2H2
21、O 2NaOH+Cl2(g)+H2(g)电解池2阳极(+)2Cl-Cl2(g)+2e阴极(-)1/2 O2(空气)+H2O+2e 2OH-总反应:总反应:2NaCl+2H2O+1/2O2(空气空气)2NaOH+Cl2(g)上一内容下一内容回主目录O返回2023-2-21在25,用锌电极作为阴极电解a=1的ZnSO4水溶液,若在某一电流密度下氢气在锌电极上的超电势为0.7V,问在常压下电解时,阴极上析出的物质是氢气还是金属锌?上一内容下一内容回主目录O返回2023-2-21 试说明化学腐蚀和电化学腐蚀的不同特征。答:化学腐蚀就是在金属表面直接发生化学反应使金属氧化、溶解,即氧化成离子或高 价化合
22、物;电化学腐蚀的特征是:主要发生在非均匀的金属表面上,在金属表面构 成微电池(局部电池),产生的局部电流,发生电化学反应,使金属氧化、溶解,能 量以热的形式传给环境。上一内容下一内容回主目录O返回2023-2-21试分析电化学反应与一般均相氧化还源反应的区别。答:电化学反应是氧化与还原反应的产物,分别集中于两个不同的极区,因此若将极 区设法隔离就可得到电化学反应氧化产物与还原产物,而均相氧化还原反应的结 果两种产物混在同一相内,必须设法加以分离才能得到两种反应的产物。上一内容下一内容回主目录O返回2023-2-21试就影响热机效率和燃料电池的理论效率的因素进行比较。答:热机效率为(T1T2)/T2,即热源与冷源的温差越大,冷源温度越低,热机效率就越高。而燃料电池的效率为Gm/Hm1TSm/Hm,如果Sm/Hm 为正值,且电池的操作温度越低,则效率越大;如果Sm/Hm为负值,则可能大于1,其物理意义是电池在工作时,能从环境中吸热而转变为电能。上一内容下一内容回主目录O返回2023-2-21甘汞电极)标准溶液(玻璃电极spH05915.02800.0玻璃jssEpH电池:电池:于是,可测得待测溶液的于是,可测得待测溶液的pH值为值为05915.0sxsxEEpHpH
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
