 羰基化合物的烷基化和催化烷基化反应
羰基化合物的烷基化和催化烷基化反应


《羰基化合物的烷基化和催化烷基化反应》由会员分享,可在线阅读,更多相关《羰基化合物的烷基化和催化烷基化反应(71页珍藏版)》请在装配图网上搜索。
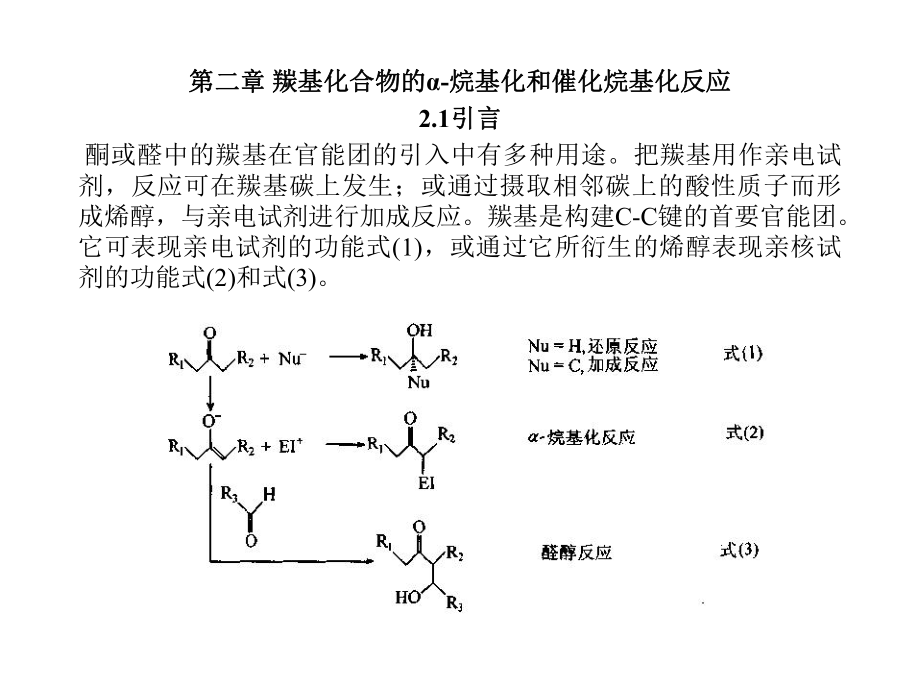
1、第二章第二章 羰基化合物的羰基化合物的-烷基化和催化烷基化反应烷基化和催化烷基化反应2.1引言引言 酮或醛中的羰基在官能团的引入中有多种用途。把羰基用作亲电试剂,反应可在羰基碳上发生;或通过摄取相邻碳上的酸性质子而形成烯醇,与亲电试剂进行加成反应。羰基是构建C-C键的首要官能团。它可表现亲电试剂的功能式(1),或通过它所衍生的烯醇表现亲核试剂的功能式(2)和式(3)。包括酮、醛和羧酸衍生物的各种羰基化合物构成了一类具酸性质子的羰基化合物,其酸性为pKa自25至35(在DMSO中)的范围。羰基化合物的代表性pKa值列于表2.1。按照羰基化合物的pKa值可以采用不同的方法产生烯醇。从羰基化合物产生
2、烯醇,选用的碱要满足两个条件:1.足够的碱性。2.碱必须有空间位阻,以便阻碍该碱对羰基中心的亲核进攻。金属胺化物满足以上条件:1.二异丙基氨基锂LDA(在有机化学中被认为是最重要的碱)2.异丙基环己基氨基锂LICA3.四甲基哌啶锂LTMP4.硅烷基胺化物2.2 手性传递手性传递手性烯醇:环内烯醇、环外烯醇和配位型环内烯醇 环内烯醇 环外烯醇OMXZYR*OMXYZROMXZYR*2.2.1 环内手性传递环内手性传递原有不对称中心通过环共价键连接到烯醇的两个点,烯醇的几何构型保持不变并与不对称中心的诱导无直接关联。2.2.2 环外手性传递环外手性传递 虽然形成的不对称中心通过共价链连接到烯醇上,
3、但手性传递和烯醇间的立体化学关系并非固定。因为就构象而言,原有的手性部分并不是通过连接到发生取代作用的三角中心的共价键固定在两个或多个接触点上的。由于构象可变性的结果,常难以预料这类反应的立体选择性。2.2.3 配位型的环内手性传递配位型的环内手性传递环内手性传递和环外手性传递相结合而产生的一个概念性思想。本章重点。2.3 环内手性传递环内手性传递2.3.1 六元环(环外型)六元环(环外型)10E10E遭受烷基的空间张力R-X(OM),亲电试剂更有利于竖键进攻10A10A,而不是平键进攻较不稳定的10E10E 图26给出一些实例。2.3.2 六元环(环内型)六元环(环内型)亲电试剂进攻发生在烯
4、醇的二个非对映面上,即,A进攻和E进攻,产生酮产物13A和13E。通过假定的椅型过渡态得到的酮13A,可以认为比酮13E优先形成,后者是由船型过渡态生成的。通过椅型过渡态形成13A的“坚键烷基化”的能垒相对铰小。2.3.3 五元环(环内型)五元环(环内型)五元环内烯醇的非对映选择性烷基化反应中,1,3和1,2不对称诱导都可能发生。在这种情况下,anti诱导的烷基化过渡态主要受空间位阻的控制方式所支配。图210所示的反应是anti 1,3不对称诱导的一个实例。2.3.4 降冰片体系降冰片体系许多烷基化反应的例子涉及降冰片环系,在此环系中烯醇可以是环内的或是环外的。由于是刚性的环系,无论是环内的或
5、环外的烯醇都显现出高度的不对称诱导(图211)。2.4 配位型的环内手性传递配位型的环内手性传递配位型的手性烯醇体系,金属离子在固定原有的手性和烯醇部分之间的立体化学关系至关重要。2.4.1-羟基酸在烯醇化过程中这些底物可以形成E烯醇或者Z烯醇,对这两种烯醇体系的任何一种而言,配位作用在确定烯醇对映面的选择中都可能是决定性的。如图212所示,由于Re面进攻Z-或E-烯酵,结果都形成了主要的组分。实例:2.4.2 脯氨醇型脯氨醇型Evans型试剂:一种基于金属离子配位作用的,由脯氨醇型手性辅剂衍生的两种形式的烯醇锂的非对映选择性烷基化,为合成取代羧酸提供了一条有效的路线。对于烯醇体系16,烷基化
6、反应优优先从Si面发生,而对于17,优先从Re面发生。这个反应的特点是从同一底物(16或17)开始,在烷基化产物酸水解以后,可以得到一对对映体。脯氨醇手性辅剂不易回收,与水混溶,引入两个甲基形成叔醇18,后处理容易回收。通过改变在酰基和烷基中的R和R先后反应顺序,同样可获得羧酸的二个对映体。C2对称性的吡咯烷21:2.4.3 酰亚胺体系酰亚胺体系酰亚胺化合物22、23(Evans试剂),不对称烷基化或醇醛缩合反应的有效手性辅剂。Evans酰亚胺制备烷基酸或相应化合物:2.4.4 手性烯胺的烷基化手性烯胺的烷基化手性环己酮亚胺26 能进行高非对映选择性的烷基化。26NORHOMeHPhCH2LD
7、A 2.RX1.RX e.e.Me2SO4 82(R)C3H7I 95(R)CH2=CHCH2Br 90(R)2.4.5 手性腙的烷基化手性腙的烷基化Enders腙试剂法:SAMP/RAMP,可分别由(S)-脯氨酸和(R)-谷氨酸大量制备。例,合成切叶蚁警戒信息素3131:2.4.6 恶唑啉体系的烷基化恶唑啉体系的烷基化容易从2-氨基乙醇衍生物和羧酸制备,原料易得,使用于宽的反应温度范围,对各种试剂稳定,用作合成羧酸的潜在前体。手性化合物如羧酸、酯、内酯和醇都可通过恶唑啉化学制备,手性中心和其它官能团的位置可由制备的方式加以控制。恶唑啉方法学在有机合成中提供了一种有用的工具。例,合成欧洲松锯蜂
8、性信息素:二取代羧酸的制备:2.4.7 酰基磺内酰胺体系酰基磺内酰胺体系Oppolzer发展的酰基磺内酰胺50。合成,-二取代羧酸衍生物:制备对映选择性纯的氨基酸:50用N-二(甲硫基)次甲基甘氨酸甲酯酰化。磺内酰胺50是优良的手性辅剂。例,氯化亚铜(I)催化的氯化烷基镁对,二取代E烯磺内酰胺57的1,4加成的不对称诱导。2.5 季碳手性中心的形成季碳手性中心的形成许多生物活性的天然产物含有季碳原子。Meyers发展了一种不对称季碳原子的立体选择性引入的新方法。该方法基于-酮酸和(S)-颉氨醇衍生的手性双环内酰胺的交替锂化和烷基化。(S)-缬氨醇-酮酸双环内酰胺NH2OHOHOOCR+ONOR
9、1.LDA2.RXONORR1.LDA2.RXONORRH2SO4,BuOHR(R=Ph)PhOCO2BuRR硝基烯胺能与多种亲核试剂反应,生成加成消除产物。立体中心的自我再生(SRS)体系:为了在手性分子的单个手性中心上置换一个取代基而不发生外消旋,首先非对映选择性地生成一个暂时的手性中心,通过脱除一个取代基使原先的四面体中心变为三角形,然后非对映选择性地引入一个新的配体。从一些易得的环氧基硅烷基醚开始,合成,二取代氨基酸衍生物:具有张力的氨基醇衍生的酮酯或酰胺与格氏试剂反应,制备对映体纯叔-羟基酸:2.6 双内酰亚胺体系双内酰亚胺体系甘氨酸和其它氨基酸经过二酮哌嗪,进行O甲基化得到六元杂环
10、产物,水解以后以高对映体过量获得了甲基氨基酸。2.7 用于羰基化合物的用于羰基化合物的-烷基化的手性辅剂一览表烷基化的手性辅剂一览表2.8 手性缩醛的亲核取代手性缩醛的亲核取代缩醛(酮)是最广泛使用的醛和酮的保护形式。中性条件下,缩醛对于亲核试剂是惰性的的,然而,在Lewis酸的存在下,缩醛官能团成为强亲电性的试剂,能与富电子的双键或亲核试剂发生反应。手性从缩醛中的二醇传递到了新形成的不对称碳中心上。以下辅剂和亲核试剂常用于这个目的:H-用作亲核试剂:TiCl4诱导的手性缩醛裂解用于制备肾上腺素能阻断剂99:2.9 手性催化剂诱导的醛的烷基化手性催化剂诱导的醛的烷基化-不对称亲核加成不对称亲核
11、加成在手性配体存在下,烷基金属对碳基化合物的亲核加成是受到最广泛研究的反应之一。具有C2对称性的各种类型的手性氨基醇和二胺己发展为优良的手性配体,用于有机锌催化的醛的对映选择性烷基化。虽然二烷基锌对于一般的碳基底物是惰性的,但其反应性可用一些添加剂来提高。质子性辅剂催化的不对称烷基化的可能历程:大部分工作是设计新的手性配体,主要是-氨基醇,最成功的是DBNE(114)和DAIB(115)。烷基锌在醛和酮同时存在时选择性地与醛加成(多数有机金屑试剂如烷基锂和格氏试剂是强亲核试剂。在醛和酮同时存在时一般难以化学选择性地只与醛加成)。93e.e.双环脯氨酸类似物衍生的光学活性-氨基128,催化二乙基
12、锌对醛的对映选择性加成,光学产率高达100。比(S)-脯氨酸衍生物(S)-129效果好。在同环桥键羟基氨基二茂铁()130存在下,11种芳族和脂族醛与Et2Zn进行烷基化反应。生成的醇具有67一97的ee值。这种二茂铁催化剂成功地用于使芳族醛和直链或支链脂族醛的烷基化,产生的仲醇ee值高达97。即使用支链的脂族醛,得到的光学产率也比用131所报道的要高。手性四齿磺酰胺配体132以优异的化学产率和对映选择性催化二乙基锌对醛的对映选择性加成。手性二醇配体催化,手性配体TADDOL133作为替代氨基醇的新型配体。氨化锌衍生物135-137催化,芳香醛效果好,脂肪醛效果不佳。BINOLTi(OPri)
13、4催化体系:139容易由BINOL与Ti(OPri)4混合制得BINOL为达到有效催化,Ti(OPri)4相对于BINOL大量过量,乙基锌对于醛过量对于反应高产率也是必要的。Nakai提出,催化剂不是139本身而是140。5,6,7,8和5,6,7,8被氢化的BINOL即(S)或(R)141催化二乙基锌对芳香醛的加成能给出更好的结果。大多定量转化,ee值超过95。三乙基铝化合物可从氢化铝和乙烯很经济地以工业规模制备,因此这类化合物成功的烷基化反应肯定会开辟一个活跃的新研究领域。一些新配体:2.10 ZnR2对酮的催化不对称加成:对酮的催化不对称加成:叔醇不对称中心的对映选择性形成叔醇不对称中心的对映选择性形成许多生物活性的天然产物含有季碳原子,通过碳亲核试剂对酮的加成来不对称合成叔醇近来越来越受到关注(也参见25节)。DAIB(142)催化二苯基锌对酮的对映选择性加成:樟脑磺酰胺-钛醇盐衍生物催化二甲基锌和二乙基锌对潜手性酮的对映选择性加成:2.11 不对称氰醇化反应不对称氰醇化反应 光学活性的磺肟145和Ti(OPri)4生成手性钛试剂催化三甲基甲硅烷基氰化物对醛的不对称加成。假定的反应机理:139(X=CN)催化三甲基甲硅烷基氰化物与醛的反应。手性的二氰基络合物在原位生成,不对称氰硅烷化给出的ee值达到75。
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 《认识角》ppt教学讲解课件
- 《从数据谈节水》数据的收集、整理与描述优秀教学ppt课件
- 人员配置-公司组织架构与人员配置计划课件
- 《认识分式》ppt课件
- 《从百草园到三味书屋》第一课时ppt课件
- 公路工程概预算三课件
- 中考物理专题突破-综合能力题教学课件
- 《创新设计》高考英语二轮复习(江苏专用)ppt课件:第二部分-基础语法巧学巧练-专题八-非谓语动词
- 中考物理专题复习课件:滑轮及滑轮组
- CIM安全标识统一规划课件
- 中考物理专题复习教学课件-质量和密度
- 《处理民族关系的原则平等团结共同繁荣》ppt课件
- 中考物理专题复习之物理实验和探究题复习指导教学课件
- 《十二人人都会有挫折》初中心理健康教育闽教版《中学生心理健康》七级课件
- Cisco无线网络-安全-Brief课件
