 烯烃炔烃的反应
烯烃炔烃的反应


《烯烃炔烃的反应》由会员分享,可在线阅读,更多相关《烯烃炔烃的反应(61页珍藏版)》请在装配图网上搜索。
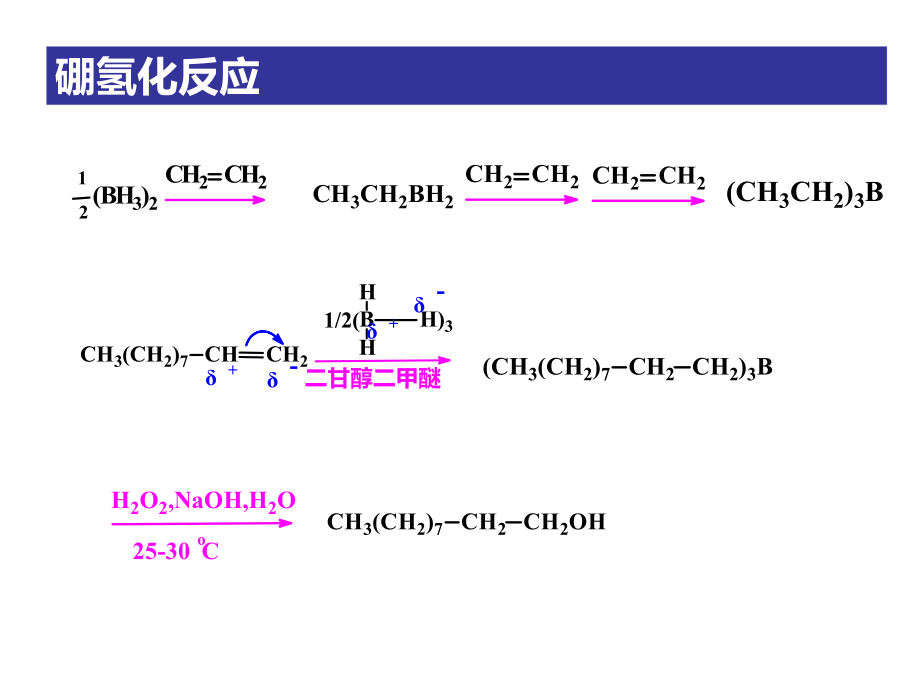
1、硼氢化反应CH2CH2 12(BH3)2CH3CH2BH2CH2CH2 CH2CH2(CH3CH2)3BH2O2,NaOH,H2O25-30oCCH3(CH2)7CH2CH2OHCH3(CH2)7CHCH21/2(BHH)3H二甘醇二甲醚+-+-(CH3(CH2)7CH2CH2)3BoCH5C2C CC2H5B2H6,0二甘醇二甲醚C CH5C2HC2H53BC CH5C2HC2H53HAcoC25H2O2HO-/H2OBC CH5C2HHC2H5CH3CH2C CH2CH3O硼氢化酸化-顺式烯烃硼氢化氧化-醛或酮CH3(CH2)5C CH(CH3)2CHCH3BH2oC0-10二甘醇二甲醚C
2、H(CH3)2CH3BCH3(CH2)5CH CH2H2O2HO-/H2OCH3(CH2)5CH CHOH重排CH3(CH2)5CH2CHO由末端炔制醛:防止同碳二硼化物 RCH(BH2)2的生成完成下列反应式羟汞化-脱汞反应羟汞化相当于OH和HgOAc与C=C加成脱汞 相当于HgOAc被H取代,具有高度选择性反应速度快,条件温和,无重排,产率高,适用于实验室制备醇脱汞时,若用其他质子溶剂(ROH,RNH2,RCO2H)代替水,即溶剂汞化可以得到醚,胺和酯(3)亲核加成-炔烃易进行亲核加成CHCHCH3OH+KOH加热,加压CH2CHOCH3甲基乙烯基醚(非常有用的聚合单体)CH3OHKOH+
3、H2OCH3O K+-CHCHOCH3-+CHCHOCH3-CH3OHCHCHOCH3-+CHCHOCH3H反应历程如下:由负离子或带有未公用电子对的中心分子的进攻而进行的加成反应,称为亲核加成反应。亲核试剂HC CH160-165 ,2-2.5MPaoCHOCH320%KOH/H2OCH2CHOCH3甲基乙烯基醚HC CHHCNCuClCH2CHCN丙烯腈HC CH160-165 oCHOOCCH3乙酸锌活性炭CH2CHOOCCH3乙酸乙烯酯从反应的结果看,是在醇或羧酸分子中引入一个乙烯基,因此统称为乙烯基化反应写出乙炔与亲核试剂(CN-,HCN)加成生成CH2=CHCN的机理CCRRRHC
4、ORROCROH+CCRRRHOHOHCORROCRH+CCRRRHOKMnO4(浓浓,热热),OHK2Cr2O7,H或或(1)O3(2)H2O,ZnKMnO4(稀稀,冷冷),OH或或(1)OsO4,(2)H2ORCOOH(过过氧氧酸酸)O用低温,中性或碱性稀KMnO4氧化,生成顺式-二醇实际上是加成反应。氧化反应,氧化产物随氧化剂和氧化条件的不同而异。3RCH CH2+2KMnO4+4H2O 3RCHOHCH2+OH2MnO2+2KOH碱性或中性介质在较强烈的条件下(如加热或在酸性条件下),碳碳键完全断裂,烯烃被氧化成酮或羧酸。H5C2C CH2CH3KMnO4,-OH,H2OH+H5C2C
5、OCH3CO2H5C2C CHCH3C2H5KMnO4,-OH,H2OH+H5C2COCH3CH3CH2COOHCRR被 氧 化 为RRCORCHOCR被 氧 化 为HOHHCOH被 氧 化 为COOHCO2+H2O 烯烃结构不同,氧化产物也不同,此反应可用于推测原烯烃的结构。CH3COOCCCH2()7CH2()7HKMnO4,H2O,常温pH7.5,92%96%CH3COOCCCH2()7CH2()7HOO在强烈条件下氧化时,非端位炔烃生成羧酸(盐),端位炔烃生成羧酸(盐)、二氧化碳和水。KMnO4H2O,OHC4H9C CHC4H9_COOH+CO2H2O+炔烃用高锰酸钾氧化,同样即可用
6、于炔烃的定性分析,也可用于推测三键的位置。炔烃也可以被高锰酸钾溶液氧化.较温和条件下氧化时,非端位炔烃生成 -二酮。完成下列反应式完成下列反应物的构造式CCO3H2OZnCCCOOOCCO_OOO+OC烯烃分子臭氧化物臭氧化物常用的还原剂:(1)Zn/H2O (2)H2,Pd将含有6%8%臭氧的氧气通入到烯烃的非水溶液中,得到臭氧化物,后者在还原剂的存在下直接用水分解,生成醛和/或酮。臭氧化烯烃臭氧化物的还原水解产物与烯烃结构的关系为:烯烃结构 臭氧化还原水解产物 CH2=HCHO(甲醛)RCH=RCHO(醛)R2C=R2C=O(酮)CH3CH2CHCH2(1)O3(2)H2,PdCH3CH2
7、CHO +HCHOCH3CCH2CH3(1)O3(2)H2,PdCH3CCH3O+HCHOCH3CCHCH3CH3(1)O3(2)H2,Pd+CH3CHOCH3CCH3O+RCHCRR(1)O3(2)LiAlH4?NaBH4RCH2OHRRCHOH故可通过臭氧化物还原水解的产物来推测原烯烃的结构。(1)O3(2)H2,PdCH3COH+CH3CHCH3COCH3CH3CHCCHCH3CH3CH3CH3CH2CCH3CH2OOCCH3H+(1)O3(2)H2,PdCH3CH2CCH3CH2CCH3HHCOCH2CH2CH2CH2COCH3(1)O3(2)H2,PdCH3炔烃与臭氧反应,亦生成臭氧
8、化物,后者用水分解则生成 -二酮和过氧化氢,随后过氧化氢将 -二酮氧化成羧酸。C+HOOCO3OO_OCCH2OCCOO+H2O2COOHC例如:CH3CH2CH2CCCH321H2OO3CH3CH2CH2COOH+CH3COOH臭氧除和碳碳三键以及双键外,其他官能团很少反应,分子的碳架也很少发生重排,故此反应可根据产物的结构测定重键的位置和原化合物的结构。臭氧化反应可以用来制备醛酮,也可以用来合成羧酸油酸 臭氧解法 制备 壬二酸(杜鹃花酸)壬二酸,用作增塑剂,并用于醇酸树脂、漆和化工合成。CCRRRHCCRRRHOORCOOHCH3CO3HPhCO3HCF3CO3HCO3HCl(MCPBA)
9、烯烃与过氧酸反应生成 1,2-环氧化物C3H7CHCH2 +F3CCOOHONa2CO3二氯甲烷C3H7CH CH2 +F3CCOOHO80%过氧酸中的氧原子与烯烃双键进行立体专一的顺式加成亲电加成反应CCCCOHOOROHORO+CCHOORO亲电试剂双键碳原子上连接给电子试剂越多越强,反应越容易进行R2C=CR2 R2C=CHR RCH=CHRR2C=CH2 RCH=CH2 CH2=CH2 烯烃进行环氧化的相对活性顺序CH3(CH2)5CHCH2 +H2O2二氯甲烷80%CH3(CH2)5CHCH2 O有时用 H2O2 代替过氧酸。反应条件温和,产物容易分离和提纯,产率较高,是制备环氧化合
10、物的一种好办法。完成下列反应式完成下列反应式催化氧化CH2CH2O2(air)oC280-300 ,1-2MPaAgCH2CH2O氯化钯氯化铜催化是工业生产乙醛和丙酮的方法,不宜类推!PdCl2CuCl2,H2OCH2CH2O2(air)oC125-130 ,0.4MPaCH3CHOCH3CH CH2PdCl2CuCl2,H2OO2(air)oC120CH3CCH3O工业生产环氧乙烷的主要方法,不能类推用于制备其它环氧化物!聚合反应适当条件下,烯烃或炔烃分子的键打开,通过自身加成结合在一起1.低聚,少数分子聚合在一起成低聚物CH2CCH3CH3H+(50%H2SO4)oC100CCH3CH3C
11、CH3CH3CH3CH2+H+CCH3CH3CCH3H3CCH3CHCCCH3CCH3CH3CH3CH2HH80%20%C+CH3CH3CH3CH2CCH3CH3C+CH3CH3CH3CH2CCH3CH3HC CHCH2CH C CH2CuCl NH4ClHC CHCuCl NH4ClCH2CH C C CH CH22.共聚:许多分子聚合在一起成大分子量的高聚物n CH2=CH2少量引发剂150250150300Mpa CH2-CH2 n乙烯(单体)聚乙烯(高分子)高压法高压聚乙烯如:乙烯的聚合又称 低密度聚乙烯,用高压法(147.17196.2MPa)生产,支链较多,强度低,多用来生产薄膜制
12、品。低密度聚乙烯通常使用高温高压下的自由基聚合生成,由于在反应过程中的链转移反应,在分子链上生出许多支链。这些支链妨碍了分子链的整齐排布,因此密度较低。在高温下容易产生致癌物质,故保鲜膜不宜进入微波炉。1898年,聚乙烯最早由德国化学家Hans von Pechmann在一次试验事故中合成的。TiCl4-Al(C2H5)3 称为齐格勒(Ziegler 德国人)-纳塔(Natta 意大利人)催化剂。1959年齐格勒纳塔利用此催化剂首次合成了立体定向高分子人造天然橡胶,为有机合成做出了具大的贡献。为此,两人共享了1963年的诺贝尔化学奖。n CH2=CH20.11Mpa CH2-CH2 n低压法低
13、压聚乙烯TiCl4 Al(C2H5)36075又称 高密度聚乙烯,因为在低压下生产,含有较多长键,因此密度高。主要用于制造各种注塑、吹塑和挤出成型制品。C H2C H2ca ta ly s tC H2C H2nP EC H3C H C H2c a ta ly stC H C H2C H3nP PC H C H2c a ta ly s tC H C H2nP SC H2C HC lc a ta ly s tC H2C HC lnP V cN C C H C H2c a ta lys tC H C H2C NnP A N(?)聚苯乙稀聚苯乙稀 是一种无色透明的塑料材料。具是一种无色透明的塑料材料。
14、具有高于有高于100摄氏度的玻璃转化温度,因此摄氏度的玻璃转化温度,因此经常被用来制作各种需要承受开水的温度经常被用来制作各种需要承受开水的温度的一次性容器,以及一次性泡沫饭盒等。的一次性容器,以及一次性泡沫饭盒等。是一种半结晶的热塑性塑料。具有较高的是一种半结晶的热塑性塑料。具有较高的耐冲击性,机械性质强韧,抗多种有机溶耐冲击性,机械性质强韧,抗多种有机溶剂和酸碱腐蚀。在工业界有广泛的应用,剂和酸碱腐蚀。在工业界有广泛的应用,是平常常见的高分子材料之一。澳大利亚是平常常见的高分子材料之一。澳大利亚的钱币也使用聚丙烯制作。的钱币也使用聚丙烯制作。聚乙烯聚乙烯 是日常生活中最常用的高分子是日常生
15、活中最常用的高分子材料之一,大量用于制造塑料袋,塑料材料之一,大量用于制造塑料袋,塑料薄膜,牛奶桶的产品。薄膜,牛奶桶的产品。聚乙烯抗多种聚乙烯抗多种有机溶剂,抗多种酸碱腐蚀,但是不抗有机溶剂,抗多种酸碱腐蚀,但是不抗氧化性酸,例如硝酸。在氧化性环境中氧化性酸,例如硝酸。在氧化性环境中聚乙烯会被氧化。聚乙烯会被氧化。聚氯乙烯聚氯乙烯 是一种使用一个氯原子取代是一种使用一个氯原子取代聚乙烯中的一个氢原子的高分子材料。聚乙烯中的一个氢原子的高分子材料。聚氯乙烯的最大特点是阻燃,因此被聚氯乙烯的最大特点是阻燃,因此被广泛用于防火应用。广泛用于防火应用。顺式聚乙炔 反式聚乙炔 乙炔的聚合物,有顺式聚乙
16、炔和反式聚乙炔两种立体异构体。聚乙炔是最简单的聚炔烃。顺式和反式聚乙炔的导电率分别为 10-9和10-5欧厘米,如用碘、溴等卤素或BF3、AsF3等路易斯酸渗杂后,其导电率可提高到金属水平(约103欧厘米),因此称为合成金属及高分子导体。-氢原子的反应(a)卤化反应烯丙位氯代的条件:高温(气相)、Cl2低浓度CHCH2H3C+500 600oC液液相相气气相相CHCH2H3CClClCHCH2H2CClCl2CCl4烯丙位CHCH2CH2ClCl2 Cl(1)(2)Cl+HCl+(3)ClCl+HCHCH2CH2CHCH2CH2ClCHCH2CH2Cl CCCHHHHHCHCH2CH2CCH2
17、CHHHCCCHHHHH等性CHCH2H3C+CHCH2H2CClCl2hv or 1414CHCH2H2C14Cl+50%50%CHCH2H2C14HClCHCH2H2C14CHCH2H2C14CHCH2CH2 14CHCH2CH2ClCl2 Cl(1)(2)Cl+HCl+(3)ClCl+HCl 14CHCH2H2C14CHCH2H2C14CHCH2CH2 14CHCH2H2CCl14CHCH2H2C14Cl+ClNBSBr(PhCOO)2NBS:NOOBrNBS 持续提持续提供低浓度供低浓度 Br2NOOBr+HBrNOOH+Br2(PhCOO)22 PhCOO2 Ph+PhBr+PhBr
18、Br+2 CO2 BrNBSH2O,NaOHOArCH2RNBSArCHRBr(PhCOO)2CH3(CH2)4CH2CHCH2NBShCH3(CH2)4CHCHCH2BrCH3(CH2)4CHCHCH2Br3-溴-1-辛烯 1-溴-2-辛烯H2CCHCH2Rhv or X2H2CCHCHRXH2CCHCHRX+例:CH2CHCH3O2(air)oC300-400,0.2-0.3MPa钼酸铋等H2OCH2CHCHOO2oC440,63-74kPa磷钼铋系列催化剂NH3CH2CHCH3CH2CHCN在不同的条件下,氧化反应能发生在-碳原子上。丙烯空气催化氧化生成丙烯醛。工业生产丙烯醛的方法。催化
19、氧化在氨的存在下进行,生成丙烯腈:即发生氧化,也发生氨化,成为氨氧化反应。工业生产丙烯腈的方法。CH2CCH3CH3O2Mo-W-TeoC300-400CH2CCH3CHOoC270-350钼系杂多酸CH2CCH3COOHO2,碳原子的杂化状态 sp sp2 sp3s成分/%50 33 25电负性 3.29 2.73 2.48碳负离子稳定性:HC=C CH2=C H CH3C H2 H2O HC=CH NH3 CH2=C H2 CH3C H3pKa 15.7 25 34 36.5 42A 炔氢的酸性B 金属炔化物的生成及其应用HC CHNa,110or NaNH2,液NH3,-33oCoCHC
20、 CNaNa,190-220or NaNH2,液NH3,-33oCoCNaC CNa 液 NH3,-33oCCH3CH2CH2BrCH3CH2CH2C C CH2CH2CH3由于炔氢的酸性,能和碱金属和强碱反应生成的金属炔化物是强亲核试剂,能和卤代烷烃发生亲核取代反应,使乙炔和端位炔烃发生烷基化。CH3CH2C CHNaNH2,液NH3-33oCCH3CH2C CNa 液NH3,-33oCCH3CH2BrCH3CH2C CCH2CH3这是制备高级炔烃的重要方法。C 炔烃的鉴定CH3CH2C CHAg(NH3)2NO3CH3CH2C CAgNH3NH4NO3乙炔银(白色)丁炔银HC CH2Cu(
21、NH3)2ClCuC CCu2NH32NH4Cl乙炔亚铜(棕红色)HC CH2Ag(NH3)2NO3AgC CAg2NH32NH4NO3CH3CH2C CHAg(NH3)2NO3CH3CH2C CAgNH3NH4NO3HC CH2Ag(NH3)2NO3AgC CAg2NH32NH4NO3反应灵敏,现象明显,可以用于乙炔和端头炔的鉴别。HC CH2HClCuC CCu2CuClCH3CH2C CHHNO3CH3CH2C CAgAgNO3炔烃纯化生成的金属炔化物容易被盐酸或硝酸分解成原来的炔烃,低级烯烃(六)烯烃和炔烃的来源和制法石油馏分或天然气高温裂解石油炼制过程中的气相成分乙炔电石法天然气高温
22、部分氧化CaO3C2200-2300oCCaC2COCaC22H2OCa(OH)2HC CHHC CH2 CH41500-1600oC0.01-0.001s3H2(3)烯烃的制法CCH3CH2H3COHCH3浓H2SO4100oCCCH3CHH3CCH370%CHCH2H3CCH3ClKOH(醇)CHCHH3CCH3CHCH2H2CCH380%20%(a)醇脱水(b)卤代烷脱卤化氢(4)炔烃的制备A 二卤代烷脱卤化氢B 炔烃的烷基化(CH3)3C CH CH2BrBr(CH3)3COK2HBr(CH3)3C CCH91%CH3(CH2)4CH2CH ClBrNaNH2H+60%CH3(CH2)4CCHHC CHNaNH2,液NH3-33oCHC CNa 液NH3,-33oCCH3CH2CH2CH2BrHC C CH2CH2CH2CH380%
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
