 能层能级构造原理
能层能级构造原理


《能层能级构造原理》由会员分享,可在线阅读,更多相关《能层能级构造原理(30页珍藏版)》请在装配图网上搜索。
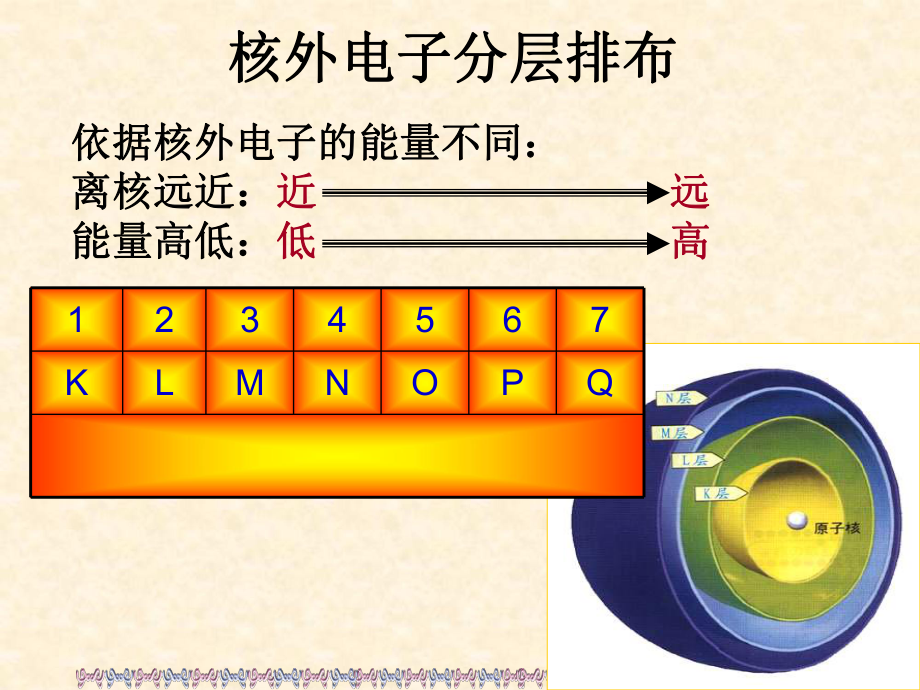
1、依据核外电子的能量不同:依据核外电子的能量不同:离核远近:离核远近:近近 远远 能量高低:能量高低:低低 高高核外电子分层排布核外电子分层排布1234567KLMNOPQ三三.能层与能级能层与能级1.1.能层能层(1 1)定义:在多电子的原子核外电子的能量是不同的,)定义:在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。按电子的能量差异,可以将核外电子分成不同的能层。(2 2)表示方法及各能层所容纳的最多电子数:)表示方法及各能层所容纳的最多电子数:(学与问(学与问1 1)每一个能层最多可容纳的电子数为)每一个能层最多可容纳的电子数为2n2n2 2个。个。
2、2.2.能级能级(1 1)定义:在多电子原子中,同一能层的电子,能量)定义:在多电子原子中,同一能层的电子,能量可以不同,还可以把它们分成能级。可以不同,还可以把它们分成能级。(2 2)表示方法及各能级所容纳的最多电子数:)表示方法及各能级所容纳的最多电子数:(学与问(学与问2)任一能层的能级数等于该能层的序数。)任一能层的能级数等于该能层的序数。(学与问(学与问3)不同能层中,符号相同的能级中所容)不同能层中,符号相同的能级中所容纳的最多电子数纳的最多电子数相同相同。以以s、p、d、f排序的各能级可容纳的最多电排序的各能级可容纳的最多电子数依次为子数依次为1、3、5、7的二倍,即的二倍,即2
3、、6、10、14。能层能层一一二二三三四四五五六六七七符号符号能级能级最多电子数最多电子数K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动域内运动,在多电子的原子核外电子的能量是不同的,在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的按电子的能量差异,可以将核外电子分成不同的能层能层。同一能层的电子,能量也可不同,可以把它们分成同一能层的电子,能量也可不同,可以把它们分成能级能级。1S2S2P3S3P3d4S4P4d4f5S5P 226261026101426注注:在
4、每一能层中在每一能层中,能级符号的顺序是能级符号的顺序是nsnpndnf.(n代表能层),代表能层),每一个能层最多可容纳的电子数为每一个能层最多可容纳的电子数为2n2n2 2个,个,任一能层的能级数等于该能层的序数。任一能层的能级数等于该能层的序数。【课堂达标测试课堂达标测试】1、以下能级符号正确的是、以下能级符号正确的是 ()A 6s B 2d C 3f D 7p2、下列各能层中不包含、下列各能层中不包含p能级的是能级的是 ()A.N B.M C.L D.K3、原子核外、原子核外P能层和能层和p能级可容纳的最多电子数分能级可容纳的最多电子数分别为别为 ()A 32和和2 B 50和和6 C
5、 72和和6 D 86和和10ADDC4.下列有关认识正确的是下列有关认识正确的是()A各能级上最多的电子按各能级上最多的电子按s、p、d、f的顺序分的顺序分别为别为2、6、10、14B各能层的能级都是从各能层的能级都是从s能级开始至能级开始至f能级结束能级结束C各能层含有的能级数为各能层含有的能级数为n1D各能层含有的电子数为各能层含有的电子数为2n25、下列各组微粒中,各能层电子数均达到、下列各组微粒中,各能层电子数均达到2n2个个的是的是 ()和和-和和Na+和和Cl-和和S2-AB构造原理构造原理与能量最低原理与能量最低原理 构造原理构造原理:随随原子核电荷数原子核电荷数递增,原子核递
6、增,原子核外电子的排布外电子的排布遵循如右图的遵循如右图的排布顺序,这排布顺序,这个排布顺序被个排布顺序被称为构造原理。称为构造原理。构造原理中排布顺序的实质构造原理中排布顺序的实质 -各能级的能量高低顺序各能级的能量高低顺序 1)相同能层的不同能级的能量高低顺序相同能层的不同能级的能量高低顺序:nsnpndnf2)英文字母相同的不同能级的能量高低顺序:英文字母相同的不同能级的能量高低顺序:1s2s3s4s;2p3p4p;3d4d3)不同层不同能级可由下面的公式得出不同层不同能级可由下面的公式得出:ns (n-2)f (n-1)d np(n为能层序数为能层序数)构造原理构造原理的应用的应用-书
7、写原子的电子排布式书写原子的电子排布式(1 1)根据构造原理,电子所排的能级顺序为:)根据构造原理,电子所排的能级顺序为:_ _ 1s 2s 2p 3s 3p 1s 2s 2p 3s 3p 4s 3d4s 3d 4p 4p 5s 4d5s 4d 5p 5p 6s 4f 6s 4f(2 2)原子的电子排布式:原子的电子排布式:用数字在能级符号用数字在能级符号右上角表明该能级上的排布的电子数。右上角表明该能级上的排布的电子数。氢氢 H H钠钠 Na Na 钾钾 K K1s1s2 22s2s2 22p2p6 63s3s1 11s1s2 22s2s2 22p2p6 63s3s2 23p3p6 64s4
8、s1 11s1s1 1【练习练习】(3 3)原子的简化电子排布:)原子的简化电子排布:Ne3sNe3s1 1请仿照钠的简化电子排布式写出第请仿照钠的简化电子排布式写出第8 8号元素氧、第号元素氧、第1414号元号元素硅和第素硅和第2626号元素铁的简化电子排布式吗?号元素铁的简化电子排布式吗?上式方括号里的符号的意义是:上式方括号里的符号的意义是:该元素前一个周期的惰性气体电子排布结构该元素前一个周期的惰性气体电子排布结构O O:He2sHe2s2 22p2p4 4 SiSi:Ne3sNe3s2 23p3p2 2FeFe:Ar3dAr3d6 64s4s2 2钠钠 NaNa的简化电子排布:的简化
9、电子排布:短周期短周期核外核外电子的排布电子的排布电子填充顺序:电子填充顺序:1S2S 2P 3S 3PH1S1He1S2Li1S2 2S1Be1S2 2S2B1S2 2S22P1C1S2 2S22P2N1S2 2S22P3O1S2 S2 2 2P4F1S2 2S22P5Ne1S2 2S22P6Na1S2 2S22P63S1Mg1S2 2S22P63S2Al1S2 2S22P63S23P1Si1S2 2S22P63S23P2P1S2 2S22P63S23P3S1S2 2S22P63S23P4Cl1S2 2S22P63S23P5Ar1S2 2S22P63S23P63.能量最低原理能量最低原理:现
10、代物质结构理论证实,原子的现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。最低状态,简称能量最低原理。处于最低能量的原子叫做基态原子。处于最低能量的原子叫做基态原子。这样的电子排布是基态原子的电子排布。这样的电子排布是基态原子的电子排布。从元素周期表中查出铜、银、金的外围电子从元素周期表中查出铜、银、金的外围电子层排布。它们是否符合构造原理?层排布。它们是否符合构造原理?【知识拓展知识拓展】元素元素电子层排布电子层排布CuAgAu元素周期表元素周期表构造原理构造原理结论结论 3d104s14d105s1
11、5d106s1 3d94s24d95s25d96s21.构构造原理揭示的电子排布能级顺序,实质是各能级能造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以量高低,若以E表示某能级的能量,下列能量大小顺序表示某能级的能量,下列能量大小顺序中正确的是中正确的是 ()AE(3s)E(2s)E(1s)BE(3s)E(3p)E(3d)CE(4f)E(4s)E(3d)DE(5s)E(4s)E(4f)【课堂达标测试课堂达标测试】2下列能级的能量大小比较,正确的是(下列能级的能量大小比较,正确的是()AE(4s)E(3d)BE(6p)E(5f)CE(6s)E(5p)DE(4d)E(5p)AA3 3下列各
12、原子或离子的电子排布式错误的是(下列各原子或离子的电子排布式错误的是()A Al 1sA Al 1s2 22s2s2 22p2p6 63s3s2 23p3p1 1 B O B O2-2-1s 1s2 22s2s2 22p2p6 6C NaC Na+1s 1s2 22s2s2 22p2p6 6 D Si 1s D Si 1s2 22s2s2 22p2p2 2D4由下列微粒的最外层电子排布,能确定形由下列微粒的最外层电子排布,能确定形成该微粒的元素在周期表中的位置的是(成该微粒的元素在周期表中的位置的是()A A1s1s2 2 B B3s23p1 C2s22p6 Dns2np3 B基态、激发态、光
13、谱与能量最低原理基态、激发态、光谱与能量最低原理 概概 念念 1、能量最低原理:原子的电子排布遵循构造原理能、能量最低原理:原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。使整个原子的能量处于最低状态,简称能量最低原理。2、基态原子:处于最低能量的原子叫做基态原子。、基态原子:处于最低能量的原子叫做基态原子。3、激发态原子:当基态原子的电子吸收能量后,电、激发态原子:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。子会跃迁到较高能级,变成激发态原子。4、原子光谱:不同元素的原子发生跃迁时会吸收或、原子光谱:不同元素的原子发生跃迁时会吸收或释放不同的
14、光,可以用光谱仪摄取各种元素的电子的吸释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。收光谱或发射光谱,总称原子光谱。1下列说法正确的是(下列说法正确的是()A自然界中的所有原子都处于基态自然界中的所有原子都处于基态B同一原子处于激发态时的能量一定高于基态同一原子处于激发态时的能量一定高于基态时的能量时的能量C无论原子种类是否相同,基态原子的能量总无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量是低于激发态原子的能量D激发态原子的能量较高,极易失去电子,表激发态原子的能量较高,极易失去电子,表现出较强的还原性现出较强的还原性2对充有氖气的霓虹灯管通电
15、,灯管发出红色光。产生这对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因(一现象的主要原因()A电子由激发态向基态跃迁时以光的形式释放能量电子由激发态向基态跃迁时以光的形式释放能量B电子由基态向激发态跃迁时吸收除红光以外的光线电子由基态向激发态跃迁时吸收除红光以外的光线C氖原子获得电子后转变成发出红光的物质氖原子获得电子后转变成发出红光的物质D在电流的作用下,氖原子与构成灯管的物质发生反应在电流的作用下,氖原子与构成灯管的物质发生反应3科学研究证明:核外电子的能量不仅与电子所处的能层、科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷的数目有
16、关。氩原能级有关,还与核外电子的数目及核电荷的数目有关。氩原子与硫离子的核外电子排布相同,都是子与硫离子的核外电子排布相同,都是1s22s22p63s23p6。下列说法正确的是(下列说法正确的是()A两粒子的两粒子的1s能级上电子的能量相同能级上电子的能量相同B两粒子的两粒子的3p能级上的电子离核的距离相同能级上的电子离核的距离相同C两粒子的电子发生跃迁时,产生的光谱不同两粒子的电子发生跃迁时,产生的光谱不同D两粒子都达两粒子都达8电子稳定结构,化学性质相同电子稳定结构,化学性质相同4以下现象与核外电子的跃迁有关的是(以下现象与核外电子的跃迁有关的是()霓虹灯发出有色光霓虹灯发出有色光 棱镜分
17、光棱镜分光 激光器产生激光激光器产生激光 石油蒸馏石油蒸馏 凸透镜聚光凸透镜聚光 燃放的焰火,在夜空中燃放的焰火,在夜空中 呈现五彩缤纷的礼花呈现五彩缤纷的礼花 日光灯通电发光日光灯通电发光 冷却结晶冷却结晶A BC D5电子由电子由3d能级跃迁至能级跃迁至4p能级时,可通过光谱仪直接摄取(能级时,可通过光谱仪直接摄取()A电子的运动轨迹图像电子的运动轨迹图像 B原子的吸收光谱原子的吸收光谱 C电子体积大小的图像电子体积大小的图像 D原子的发射光谱原子的发射光谱6以下电子排布式表示基态原子电子排布的是(以下电子排布式表示基态原子电子排布的是()A1s22s22p63s13p3 B1s22s22
18、p63s23p63d104s1 4p1 C1s22s22p63s23p63d24s1 D1s22s22p63s23p63d104s2 4p1 7下图是锂、氦、汞的吸收光谱和发射光谱。其中下图是锂、氦、汞的吸收光谱和发射光谱。其中图图_是原子由基态转化为激发态时的光是原子由基态转化为激发态时的光谱,图谱,图_-是原子由激发态转化为基态时是原子由激发态转化为基态时的光谱。不同元素的原子光谱上的特征谱线不同,请的光谱。不同元素的原子光谱上的特征谱线不同,请在下图中用线段将同种元素的吸收光谱和发射光谱连接。在下图中用线段将同种元素的吸收光谱和发射光谱连接。S能级的原子轨道电子云轮廓图电子云轮廓图-原子
19、轨道原子轨道S能级的原子轨道是球形对称的.电子云与原子轨道电子云与原子轨道S能级的原子轨道图*S S能级的能级的原子原子轨道是球形对称的轨道是球形对称的.*能层序数能层序数n n越大越大,原子轨道半径越大原子轨道半径越大P P能级的原子轨道是纺锤形的能级的原子轨道是纺锤形的,每个每个P P能级有能级有3 3个个原子轨道原子轨道,它们相互垂直它们相互垂直,分别以分别以P P x x,P,Py y,P,PZ Z表示表示.xyzxyzxyzP能级的原子轨道P P能能级级的的原原子子轨轨道道P P能级的能级的3 3个原子轨道个原子轨道P P x x,P,Py y,P,PZ Z合合在一起的情形在一起的情
20、形.d d能级的原子轨道有能级的原子轨道有5 5个个.d d能能级级的的原原子子轨轨道道1、每个原子轨道上最多能容纳、每个原子轨道上最多能容纳_个电子,个电子,且自旋方向且自旋方向_。研究原子结构研究原子结构CNO2、当电子排在同一能级时有什么规律?、当电子排在同一能级时有什么规律?当电子排布在同一能级的不同轨道时,当电子排布在同一能级的不同轨道时,总是总是_,而且自旋,而且自旋方向方向_。洪特规则洪特规则2不同不同泡利原理泡利原理首先单独占一个轨道首先单独占一个轨道相同相同1 1、S S、P P、d d能级分别有多少个轨道,每个轨道能级分别有多少个轨道,每个轨道上最多能容纳几个电子?其自旋方
21、向怎样?上最多能容纳几个电子?其自旋方向怎样?2 2、举例说明洪特规则:、举例说明洪特规则:讨论下列问题讨论下列问题s p d fs p d f能级分别有能级分别有1 1、3 3、5 5、7 7个轨道,个轨道,每个轨道最多能容纳的电子数为每个轨道最多能容纳的电子数为2 2个,且个,且自旋方向相反。这就是泡利原理自旋方向相反。这就是泡利原理当电子排布在同一能级的不同轨道时,当电子排布在同一能级的不同轨道时,总是首先单独占一个轨道(即分占不同总是首先单独占一个轨道(即分占不同的轨道),而且自旋方向相同。的轨道),而且自旋方向相同。原子的电子排布图铁原子的轨道表示式铁原子的轨道表示式洪特规则洪特规则
22、泡利原理泡利原理能量最低原理能量最低原理 从元素周期表中查出铜的外围电从元素周期表中查出铜的外围电子排布,它是否符合构造原理。子排布,它是否符合构造原理。当一个能级上的电子填充达到全当一个能级上的电子填充达到全充满,半充满或全空时是一种稳定充满,半充满或全空时是一种稳定状态,使得体系的能量较低。这就状态,使得体系的能量较低。这就是洪特规则的第二条。是洪特规则的第二条。思考与交流以下是表示铁原子的以下是表示铁原子的3 3种不同化学用语。种不同化学用语。结构示意图结构示意图电子排布式电子排布式电子排布图(轨道表电子排布图(轨道表示式)示式)铁原铁原子子1s22s22p63s23p63d64s2请你通过比较、归纳,分别说出请你通过比较、归纳,分别说出3种不同化学用语所能反种不同化学用语所能反映的粒子结构信息。映的粒子结构信息。结构示意图:能直观地反映核内的质子数和核外的电子层数结构示意图:能直观地反映核内的质子数和核外的电子层数 及各能层上的电子数。及各能层上的电子数。电子排布式:能直观地反映核外电子的能层、能级和各能级电子排布式:能直观地反映核外电子的能层、能级和各能级 上的电子数。上的电子数。轨道表示式:能反映各轨道的能量的高低及各轨道上的电子轨道表示式:能反映各轨道的能量的高低及各轨道上的电子 分布情况,自旋方向。分布情况,自旋方向。
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
