 第六节滴定分析法的应用ppt课件
第六节滴定分析法的应用ppt课件


《第六节滴定分析法的应用ppt课件》由会员分享,可在线阅读,更多相关《第六节滴定分析法的应用ppt课件(67页珍藏版)》请在装配图网上搜索。
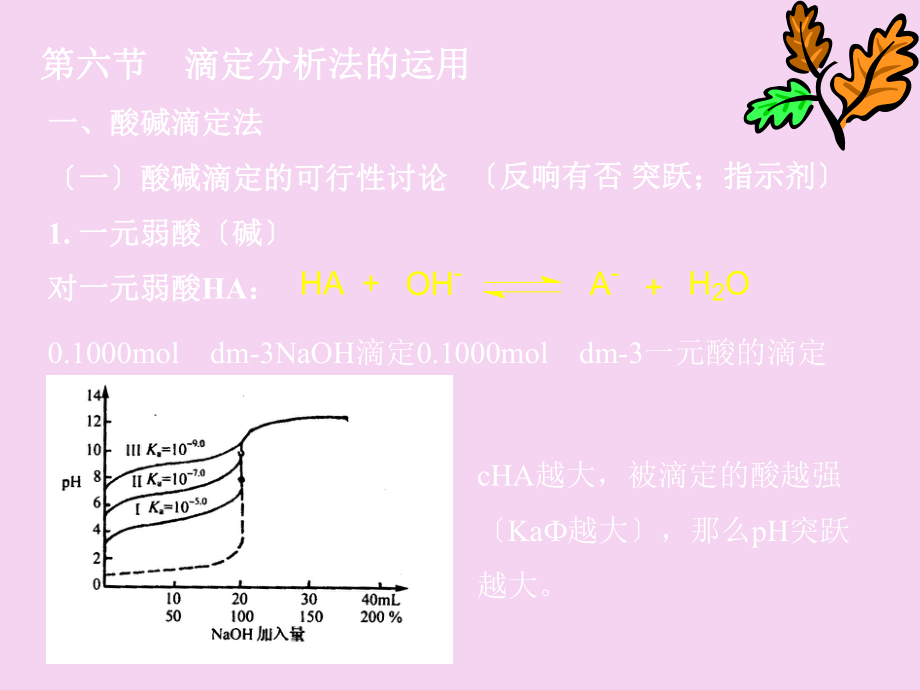
1、第六节第六节 滴定分析法的运用滴定分析法的运用一、酸碱滴定法一、酸碱滴定法一酸碱滴定的可行性讨论一酸碱滴定的可行性讨论1.一元弱酸碱一元弱酸碱对一元弱酸对一元弱酸HA:HA+OH-A-+H2O0.1000moldm-3NaOH滴定0.1000moldm-3一元酸的滴定曲线cHA越大,被滴定的酸越强Ka越大,那么pH突跃越大。反响有否反响有否 突跃;指示剂突跃;指示剂ca Ka 10-8 (T.E.0.1%pH 0.2)同理,一元弱碱的准确滴定条件为:cb Kb 10-8 (T.E.0.1%pH 0.2)普通,当被滴物HA:ca Ka 10-8时;酸碱滴定的突跃范围:pH 0.2。假设运用的指示
2、剂能在突跃范围内变色,此时滴定终点误差将不大于0.1%。直接 滴定可行性突跃范围大小:ka指示剂指示终点颜色变化:pH 0.2大,计量点pH突跃大 一元弱酸的准确滴定条件一元弱酸的准确滴定条件阐明:根据共轭酸碱之间的关系可知:阐明:根据共轭酸碱之间的关系可知:1较强的一元弱酸碱,可用强碱酸直接滴定,但较强的一元弱酸碱,可用强碱酸直接滴定,但其对应的共轭碱酸由于不能满足其对应的共轭碱酸由于不能满足ciKi 10-8将不能用直将不能用直接滴定法测定。接滴定法测定。如:NH3:Kb=4.74,可以直接滴定;NH4+:Pka=9.26,很难满足ca Ka 10-8,不能直接用碱规范溶液滴定。2不能直接
3、滴定的极弱酸碱所对应的共轭碱酸是较强的碱酸,可用直接地滴定法测定。如硼砂 Na2B4O7.10H2O溶于水发生:33322272BOH2BOH2OH5OB水解生成的)76.424.914PK(BOHb32可用盐酸直接滴定。因此硼砂可作为标定盐酸溶液的基准物。2.多元酸碱的分步滴定多元酸碱的分步滴定多元酸在水中的解离反响是分步进展的,用强碱滴定时中和反多元酸在水中的解离反响是分步进展的,用强碱滴定时中和反响也是分步进展的。响也是分步进展的。多元弱酸滴定1.能否直接滴定2.各级离解在滴定中是否有相互影响(可否分步滴定)如二元弱酸H2A,由于Ka1 Ka2,故滴定时先发生以下反响:H2A+OH-HA
4、-+H2O反响生成HA-的也与NaOH反响:HA-+OH-A2-+H2O实践上能否待H2A完全反响后,HA-生成的才开场反响呢?这就是多元酸的分步滴定问题。顺丁烯二酸(a)和丙二酸(b)用NaOH溶液滴定的滴定曲线顺丁烯二酸:顺丁烯二酸:pKa1=1.75,pKa2=5.83,Ka1/Ka2=104.08;丙二酸:丙二酸:pKa1=2.65,pKa2=5.28,Ka1/Ka2=102.63;从图中看:以从图中看:以NaOH滴至第一计量点附近时,顺丁烯二酸有明滴至第一计量点附近时,顺丁烯二酸有明显突跃而丙二酸那么几乎没有。显突跃而丙二酸那么几乎没有。丙二酸丙二酸Ka1/Ka2 比顺丁烯二酸的比顺
5、丁烯二酸的 Ka1/Ka2小小得多。得多。分析留意到:分析留意到:顺丁烯二酸:顺丁烯二酸:Ka1/Ka2=104.08;丙二酸:;丙二酸:Ka1/Ka2=102.63可见,分步滴定计量点附近的突跃取决于Ka1/Ka2的比值。比值越大,突跃越大;比值越小,突跃越小。假设同时满足ca Ka 10-8,用强碱滴定时,在第i个化学计量点附近可产生pH突跃 pH 0.2,此时滴定分析的误差不大于0.1%。多元酸的分步滴定条件多元酸的分步滴定条件Ki/Ki+1 104(T.E.0.1%pH 0.2)普通,Ki/Ki+1104,相邻的两级H+在滴定时相互间根本上无影响即能分步滴定。选择滴定多元酸某一级选择滴
6、定多元酸某一级 如如 i 的的H+时,需同时满足:时,需同时满足:ciKi 10-8;Ki/Ki+1104由于相邻两级 H+的相互影响,化学计量点附近的pH突跃普通都比较小,通常宜选用混合酸碱指示剂来指示滴定终点。多元弱碱的滴定原理同多元弱酸类似。3.混合酸碱的分别滴定条件混合酸碱的分别滴定条件(1)HA+HBHA的酸性较强:的酸性较强:HBHBHAHAKcKc 104(T.E.1%pH 0.2)(2)HCl+HA强酸与弱酸:强酸与弱酸:HAHA2HClKcc 104(T.E.1%pH 0.2)混合碱的滴定同混合酸类似。混合碱的滴定同混合酸类似。二酸碱滴定法的运用二酸碱滴定法的运用可行性判别可
7、行性判别 可-pHsp-指示剂 否能否采用其它措施,发明可以滴定的条件。例例9.10 经过计算判别能否分别滴定磷酸的各级经过计算判别能否分别滴定磷酸的各级H+?pKa1=2.12,pKa2=7.20,pKa3=12.36)解:ca Ka1 10-8;Ka1/Ka2 104 第一计量点附近有突跃。滴定产物为 H2PO4-。1.可用直接滴定法滴定的酸碱可用直接滴定法滴定的酸碱66.4)pKpK(2/1pH2a1a1sp查:查:P645,表,表8-3 选混合指示剂溴甲酚绿选混合指示剂溴甲酚绿+甲基橙。甲基橙。ca Ka2接近于10-8;Ka2/Ka3 104第二计量点附近有突跃。滴定产物为第二计量点
8、附近有突跃。滴定产物为HPO42-。78.9)pKpK(2/1pH3a2a2sp选混合指示剂酚酞+百里酚酞。ca Ka3 10-8;Kb1/Kb2=103.87;Na2CO3只能勉强滴定至HCO3-终点,突跃较小,终点颜色较难掌握。滴定误差较大。32.8)pKpK(2/1pH2b1b1sp选混合指示剂甲酚红+百里酚蓝。cKb2 约等于10-8;第二计量点附近有突跃较小。滴定产物为H2CO3。89.3)pKpc(2/1pH1a2sp选甲基橙或溴甲酚绿为指示剂。例例9.12 9.12 草酸草酸 pKa1=1.23,pKa2=4.19,pKa1=1.23,pKa2=4.19,能否分步滴能否分步滴定?
9、定?解:c Ka1 10-8;c Ka2 10-8;Ka1/Ka2 0.85 P230 291 E(Ni2+/Ni)=-0.23V;E(Cu2+/Cu)=0.34V阴极上,电极电位高的电对的氧化态先析出,因此,先析出Cu。(2)E(Ni2+/Ni)=E(Ni2+/Ni)+(0.05917/2)lgNi2+=-0.23+(0.05917/2)lg0.01=-0.289V 只需当E(Cu2+/Cu)的电极电势小于 E(Ni2+/Ni)时,Ni才会析出。析出时,Cu2+为:-0.289=0.34+(0.05917/2)lgCu2+;Cu2+=5.4810-22mol.dm-3复复 习习 指示剂指示剂
10、指示剂酸碱指示剂(酸碱滴定中pH检测)金属指示剂(配位滴定中pM的检测)氧化还原指示剂(氧化还原滴定中电极电势的检测)1.留意防止金属指示剂的封锁和僵化留意防止金属指示剂的封锁和僵化2.留意选用金属指示剂适用留意选用金属指示剂适用pH范围。范围。3.留意指示剂变色范围应窄。留意指示剂变色范围应窄。留意:留意:选择指示剂的原那么:指示剂的变色点尽量与计算计量点接近。选择指示剂的原那么:指示剂的变色点尽量与计算计量点接近。因此:计算计量点的溶液性质,查找变色点与之相近的指示剂。酸碱滴定法的运用酸碱滴定法的运用酸碱滴定可行性判断直接滴定可行标准不可行:能否采用其它措施,创造可滴定条件。一员弱酸:ca
11、Ka10-8;T.E.0.1%pH0.2104多元弱酸1.直接滴定条件:2.分步滴定条件:caKai10-8 KaiKai+1混合酸:KHAKHB104cHAcHB选指示剂计算计量点pH 选指示剂计算计量点pH(混合指示剂)pH0.2T.E.1%极弱酸碱和混和酸碱的滴定极弱酸碱和混和酸碱的滴定极弱酸(碱)滴定非水滴定法增大浓度法:如,NaAc的测定强化法:如,硼酸的测定电位滴定法:仪器分析间接法:例例9.14 9.14 铵盐铵盐NH4+NH4+的测定的测定:NH4+NH4+的的pKa=9.26,ca Ka1 10-8;pKa=9.26,ca Ka1 10-8;不能用规范碱溶液直不能用规范碱溶液
12、直接滴定。接滴定。间接测定法:蒸馏法和甲醛法。间接测定法:蒸馏法和甲醛法。蒸馏法:蒸馏法比较准确,但较费时。蒸馏法:蒸馏法比较准确,但较费时。甲醛法甲醛法:甲醛与甲醛与NH4+NH4+作用,按化学计量关系生成酸,包括作用,按化学计量关系生成酸,包括 H+H+和和质子化的六次甲基四胺:质子化的六次甲基四胺:试样NaOHboilingNH3过量HCl 吸收NH4Cl +HCl NaOH回滴甲基红指示剂(4.66.2)终点过量H3BO3 吸收 H2BO3-酸标准溶液滴定甲基红指示剂终点生成的酸可以酚酞作指示剂用规范碱溶液滴定。4NH4+6HCHO(CH2)6N4H+3H+6H2O例例9.15 克氏克
13、氏Kjeldahl定氮法定氮法含氮的有机物质常采用克氏法测定其氮含量。含氮的有机物质常采用克氏法测定其氮含量。将试样与浓将试样与浓H2SO4共煮,参与共煮,参与K2SO4,提高沸点,使有机物转化,提高沸点,使有机物转化成成 CO2和和H2O,试样中氮在,试样中氮在 CuSO4或汞盐催化下成为或汞盐催化下成为 NH4+:CmHnNH2SO4,K2SO4,CuSO4CO2 +H2O +NH4+溶液以过量的NaOH碱化后用蒸馏法测定NH4+。M+Y=MYYMMYKMY)H(YMy/MYKYMMYK)H(YMY/MYlgKlgKlg普通,当溶液酸度高于金属离子的水解酸度无M(OH),混合配合效应MY大
14、多可忽略,且无辅助配合效应无M(L)时,可只思索酸效应:条件稳定常数KMY:表示在在配位反响到达平衡时,以总浓度表示的配合物的稳定常数。当T.E.0.1%,pM0.2 时,lg(cMKMY)6 一配位滴定的可行性讨论一配位滴定的可行性讨论意义:以意义:以EDTAEDTA滴定金属离子滴定金属离子M M,设终点误差的低限是,设终点误差的低限是0.2pM0.2pM,假,假设要满足滴定分析准确度的要求相对误差在设要满足滴定分析准确度的要求相对误差在0.1%0.1%以内,那以内,那么被滴定的金属离子浓度和条件稳定常数的乘积至少应等于么被滴定的金属离子浓度和条件稳定常数的乘积至少应等于 106 106。配
15、位滴定的准确滴定条件:配位滴定的准确滴定条件:二配位滴定条件的选择二配位滴定条件的选择1.单一金属离子的滴定单一金属离子的滴定(1)最低最低pH值值:当cM=10-2mol.dm-3且只思索EDTA的酸效应:KMY=KMYaY(H)将lg KMY=lg KMY-lg aY(H)代入 lg(cMKMY)6 得:lg KMY-lg aY(H)8;lg KMY 8 lg aY(H)。将各种金属离lg KMY值代入即可求出对应的最大值lg aY(H)。再从表7.4可查得与它对应的最低pH值。如Zn2+离子:8lglg)(ZnHYK5.885.16查表p 182 表7-4:pH4.0将金属离子的 lg
16、KMY值或对应lg aY(H)值与最低pH值绘成曲线,称为EDTA的酸效应曲线或林旁Ringbom曲线。2 2最低酸度最低酸度最高最高pHpH在没有辅助配位剂存在下,直接滴定的最高pH值通常可以为是金属离子开场生成氢氧化物沉淀时的pH值,它可由氢氧化物的溶度积常数求得。如Zn2+离子:假设要滴定时不产生Zn(OH)2沉淀,那么要22)(ZnOHZnSPOHcKc8217104.310102.1molL-1pH 6.54配位滴定中往往用缓冲溶液控制溶液的配位滴定中往往用缓冲溶液控制溶液的pHpH。选择滴定条件时髦须留意指示剂的封锁、反响速度等问题。选择滴定条件时髦须留意指示剂的封锁、反响速度等问
17、题。例:练习例:练习13.设设Mg2+与与EDTA的浓度皆为的浓度皆为10-2mol.dm-3,1在在pH=6时,镁与时,镁与EDTA的条件稳定常数的条件稳定常数KMY不思索羟基不思索羟基配位效应配位效应?在此条件下能否用?在此条件下能否用EDTA规范溶液滴定规范溶液滴定Mg2+?2求其允许滴定的最小求其允许滴定的最小pH。解:1查P181表7.3 lgKMgY=8.69 P182表7.4:pH=6时,lg aY(H)=4.65。lg KMY=lg KMY-lg aY(H)=8.69 4.65=4.04;KMY=1.1104lg(cMKMY)=lg(10-2 1.1104)=2.04 lg K
18、NY;欲选择滴定欲选择滴定M,即需,即需(1)用控制溶液酸度的方法进展分别滴定用控制溶液酸度的方法进展分别滴定5NYNMYM10KcKc存在干扰离子时,选择滴定存在干扰离子时,选择滴定M的可行性判据。的可行性判据。阐明:阐明:1当干扰离子当干扰离子(N)共存时,选择性滴定共存时,选择性滴定M的条件,既与常数比的条件,既与常数比lg KMY/lg KNY有关,也与浓度比有关,也与浓度比 cM/cN 有关。有关。2滴定了滴定了M后,假设后,假设NY满足满足lg(cMKMY)6,那么有能够,那么有能够延续滴定延续滴定N,不受溶液中存在的,不受溶液中存在的MY螯合物的影响。螯合物的影响。3当当cM=c
19、N,当,当 KMY/KNY 105,或或lgK=lgKMY-lgKNY 5时,可选择滴定时,可选择滴定M,共存,共存N不干扰。控不干扰。控制滴定制滴定PH.例例:Bi3+,Pb2+共存:共存:lgKBiY-=27.94,lgKPbY2+=18.04。因:因:lgK 5,滴定,滴定 Bi3+时,时,Pb2+不干扰。不干扰。由图由图9.5P254查:查:滴定滴定 Bi3+的最高酸度为的最高酸度为pH0.7;又;又pH2时会水解,时会水解,因此选择因此选择pH1,以,以XO指示滴定终点。指示滴定终点。滴定滴定Bi3+后,再用六次甲基四胺溶液将溶液后,再用六次甲基四胺溶液将溶液pH调至调至56,那么可
20、延续滴定,那么可延续滴定 Pb2+,仍以,仍以XO指示终点。指示终点。(2)用掩蔽和解蔽的方法分别滴定用掩蔽和解蔽的方法分别滴定假设假设KMY/和和KNY 相差不大,那么不能用控制相差不大,那么不能用控制酸度的方法分别滴定,此时该当尽量降低酸度的方法分别滴定,此时该当尽量降低cN 以减少以减少N的干扰程度。的干扰程度。(i)参与掩蔽剂:掩蔽剂与参与掩蔽剂:掩蔽剂与N生成稳定化合物,使生成稳定化合物,使N尽量降低尽量降低,N对对M的干扰也就减小以致消除。的干扰也就减小以致消除。常用的掩蔽法:配位掩蔽法常用、氧化复原掩蔽法和沉淀常用的掩蔽法:配位掩蔽法常用、氧化复原掩蔽法和沉淀 掩蔽法。掩蔽法。留
21、意:运用掩蔽的方法,要求留意:运用掩蔽的方法,要求N存在的量不能太大。存在的量不能太大。处理方法:加掩蔽剂或解蔽剂。处理方法:加掩蔽剂或解蔽剂。例例1:在:在 Zn2+,Al3+共存:共存:Al3+将封锁指示剂,可用将封锁指示剂,可用 NH4F掩蔽掩蔽Al3+,使其生成,使其生成稳定性较好的稳定性较好的AlF63-配离子;调理配离子;调理pH56可用可用EDTA滴定滴定Zn2+。例例2:在:在 Ca2+,Mg2+共存:共存:参与参与NaOH溶液,使溶液,使pH12,那么,那么 Mg2+生成生成Mg(OH)2沉淀,用钙指示剂可以用沉淀,用钙指示剂可以用EDTA滴定钙。滴定钙。例例3:Fe3+存在
22、干扰存在干扰EDTA对对Bi3+,Zr4+,Th4+等离子等离子的滴定:的滴定:参与抗坏血酸或羟胺等,将复原成参与抗坏血酸或羟胺等,将复原成 Fe2+。由于。由于FeY2-的稳定常数比的稳定常数比FeY-小得多,因此能防止干扰。小得多,因此能防止干扰。例:练习例:练习18 用用0.01060 mol.dm-3EDTA规范溶液滴定水中钙、镁含规范溶液滴定水中钙、镁含量。取量。取100.0ml水样,以铬黑水样,以铬黑T为指示剂,在为指示剂,在pH=10时滴定,耗费时滴定,耗费了了EDTA 31.30ml。另取一份。另取一份100.0mL水样,加水样,加NaOH使呈强碱性,使呈强碱性,用钙指示剂指示
23、终点,继续用用钙指示剂指示终点,继续用EDTA滴定,耗费滴定,耗费19.20mL。计算水。计算水中钙和镁的含量以中钙和镁的含量以CaCO3和和MgCO3表示,单位:表示,单位:mg.dm-3。解:lgKcaY=10.69;lgKMgY=8.69;lgK=2 5,不能分别滴定。以铬黑T为指示剂,在pH=10时可滴定钙、镁总量;参与NaOH溶液,Mg2+生成Mg(OH)2沉淀,用钙指示剂可以用EDTA滴定钙。CaCO3的含量的含量=19.20 0.01060 100.09 10-2 103=203.7mg.dm-3MgCO3的含量的含量=(31.30 19.20)0.01060 84.32 10-
24、2 103 =108.1 mg.dm-3(ii)解蔽:是掩蔽的逆过程。将一些离子掩蔽,对某解蔽:是掩蔽的逆过程。将一些离子掩蔽,对某种离子进展滴定以后,运用一种试剂来破坏这些配合种离子进展滴定以后,运用一种试剂来破坏这些配合物,使离子从配合物中释放出来的作用称为解蔽,所物,使离子从配合物中释放出来的作用称为解蔽,所用试剂称为解蔽剂。用试剂称为解蔽剂。例例4:铜合金中:铜合金中Cu2+、Zn2+和和Pb2+三种离子共存,需测三种离子共存,需测定 其 中定 其 中 Z n 2+和和 P b 2+。(l g K C u Y =1 8.8 0;lgKZnY=16.50;lgKPbY=18.04)用氨水
25、中和试液,加用氨水中和试液,加KCN以掩蔽以掩蔽Cu2+和和Zn2+两种离两种离子。子。Pb2+不被掩蔽,可在不被掩蔽,可在pH=10时,用时,用EBT作指示剂,作指示剂,用用EDTA滴定滴定 Pb2+。在滴定后的溶液中参与甲醛或三氯乙醛作解蔽剂,以在滴定后的溶液中参与甲醛或三氯乙醛作解蔽剂,以破坏破坏 Zn(CN)42-配离子:配离子:Zn(CN)4+4HCHO+4H2O2-Zn2+4OH-+4 H2COHCN释放出的 Zn2+,再用EDTA继续滴定。Cu(CN)42-比较稳定,不易被醛类解蔽。(3)预先分别预先分别控制酸度分别滴定或掩蔽干扰离子都有困难时,需进展控制酸度分别滴定或掩蔽干扰离
26、子都有困难时,需进展分别。分别。例例1:钴、镍混合液中测定:钴、镍混合液中测定Co2+,Ni2+,须先进展离子,须先进展离子交换分别。交换分别。例例2:磷矿石中含:磷矿石中含Fe3+,Al3+,Ca2+,Mg2+,PO43-及及F-等离子,其中等离子,其中 F-的干扰最严重,它能与的干扰最严重,它能与Ca2+生成生成稳定的配合物,在酸度小时又能与稳定的配合物,在酸度小时又能与Ca2+生成生成CaF2沉沉淀,配合物滴定中,需先加酸,加热使淀,配合物滴定中,需先加酸,加热使HF挥发除去。挥发除去。(4)用其他配位剂滴定用其他配位剂滴定除除EDTA外,可以选择其他配位剂构成配合物,提高选外,可以选择
27、其他配位剂构成配合物,提高选择性。择性。如:EDTA与 Ca2+,Mg2+构成的配合物的稳定性相差不多;但EGTA乙二醇二乙醚二胺四乙酸与 Ca2+,Mg2+配合物的稳定性相差较大,故可以在Mg2+共存时,用于直接滴定Ca2+。EDTP 乙二胺四丙酸 Cu2+的配合物较稳定,与 Zn2+,Cd2+,Mn2+,Mg2+等离子的配合物稳定性就差得多。可在这些离子存在下用EDTP直接滴定。三、氧化复原滴定三、氧化复原滴定氧化复原反响的特点氧化复原反响的特点(1)反响机理复杂;反响机理复杂;(2)反响完全程度高,但反响速度常很慢;反响完全程度高,但反响速度常很慢;(3)副反响的发生能够使反响物间无确定
28、的计量关系。副反响的发生能够使反响物间无确定的计量关系。为了提高反响速度,可以添加反响物的浓度对于有为了提高反响速度,可以添加反响物的浓度对于有H+参与的反响,可提高酸度、升高温度、运用催化参与的反响,可提高酸度、升高温度、运用催化剂等。如反响:剂等。如反响:2 MnO42-+5C2O42-+16H+2Mn2+10CO2+8H2O室温下缓慢,常将溶液加热至7585。但假设高于90,会使H2C2O4 部分分解:OHCOCOOCH22422(一一)氧化复原滴定法的可行性氧化复原滴定法的可行性 氧化复原反响:氧化复原反响:3OxdRe101.09.99cc1132dRe2Ox101.09.99cc所
29、以:K 10 3(z1+z2)由于普通允许的误差不超越0.1%,即反响的完全程度应到达99.9%以上,那么在化学计量点时:Z1Ox1 +Z2Red2Z1Red1 +Z2Ox2=KcOx2cRed2z2z1cOx1cRed1假设 z1=z2=1,那么:E(氧)-E(还)0.05923 2 0.35V故假设两个电对的条件电极电势相差大于0.4V,反响就能定量进展,能用于滴定分析。E(氧)-E(还)3(z1+z2)0.0592/(z1z2)那么 lgK=(z1z2)E(氧)-E(还)/0.0592 3(z1+z2)留意:留意:i虽然某些氧化复原反响两个电对的虽然某些氧化复原反响两个电对的E相差很大,
30、但由于相差很大,但由于副反响发生,该反响不能定量进展;如:副反响发生,该反响不能定量进展;如:Na2S2O3与与 K2Cr2O7等等(ii)有些氧化复原反响的速率很慢。有些氧化复原反响的速率很慢。4KMnO4 +2H2O4MnO2+4KOH +3O2b.易与多种复原性物质发生反响,干扰较严重,选择易与多种复原性物质发生反响,干扰较严重,选择性差。性差。1.1.高锰酸钾法高锰酸钾法(1)(1)高锰酸钾规范溶液的配制与标定高锰酸钾规范溶液的配制与标定高锰酸钾法的特点:高锰酸钾法的特点:优点:优点:a.a.氧化才干强,可采用直接、间接、返滴定等方法测氧化才干强,可采用直接、间接、返滴定等方法测定多种
31、无机物和有机物;定多种无机物和有机物;b.MnO4-b.MnO4-本身为紫红色,无需另加指示剂。本身为紫红色,无需另加指示剂。缺陷:缺陷:a.a.不稳定,还能自行分解:不稳定,还能自行分解:二常用的氧化复原滴定法二常用的氧化复原滴定法 高锰酸钾溶液的配制:高锰酸钾溶液的配制:将固体溶于蒸馏水,加热煮沸,冷却后在棕色瓶中,将固体溶于蒸馏水,加热煮沸,冷却后在棕色瓶中,并置于暗处数天;过滤除去沉淀,标定之。久置的溶并置于暗处数天;过滤除去沉淀,标定之。久置的溶液应重新标定。液应重新标定。高锰酸钾的标定:高锰酸钾的标定:基准物:基准物:H2C2O4 2H2O,Na2C2O4,FeSO4,纯铁,纯铁丝
32、。丝。Na2C2O4最常用。在最常用。在H2SO4 介质中,介质中,MnO4-与与 C2O42-的反响为:的反响为:OH8CO10Mn2H16OC5MnO22222424留意:留意:1 温 度:室 温 下 反 响 速 率 缓 慢,应 加 热 至 温 度:室 温 下 反 响 速 率 缓 慢,应 加 热 至7585,但温度过高,在酸性溶液中会使,但温度过高,在酸性溶液中会使 H2C2O4 部分分解。部分分解。2酸度:控制在酸度:控制在0.51.0mol.dm-3。酸度不够,易。酸度不够,易生成生成MnO2 沉淀,过高会促使沉淀,过高会促使 H2C2O4 分解。分解。3滴定速率:滴定速率:MnO4-
33、与与C2O42-的反响是自动催的反响是自动催化反响,开场滴定的速率要慢,几滴后,滴定速率可稍化反响,开场滴定的速率要慢,几滴后,滴定速率可稍快,但不可过快,否那么参与的快,但不可过快,否那么参与的 KMnO4 来不及与来不及与C2O42-反响,就在热的酸性溶液中分解:反响,就在热的酸性溶液中分解:OH6O5Mn4H12MnO42224经半分钟不褪色即可以为到达终点。(2)滴定方式与运用例如滴定方式与运用例如(i)直接滴定法直接滴定法 可直接滴定的复原物:可直接滴定的复原物:H2O2、Fe(II)、草酸盐、草酸盐、As(III)、Sb(III)、W(V)、U(IV)等。等。如如 H2O2 的测定
34、,在酸性溶液中,的测定,在酸性溶液中,H2O2 定量地被定量地被KMnO4 氧化:氧化:OH8O5Mn2H6OH5MnO2222224反响在室温下即可顺利进展。反响开场时速率较慢,但因H2O2 不稳定,不能加热,随着反响的进展,由于生成的Mn2+的催化作用,使反响速率加快。H2O2 中假设含有有机物质,也会耗费这时 KMnO4 溶液而影响测定结果,此时最好采用碘量法测定。ii间接滴定法:间接滴定法:某些物质如某些物质如Ca2+不具有氧化复原不具有氧化复原性,但能与另一复原剂或氧化剂定量反响,可用间接法性,但能与另一复原剂或氧化剂定量反响,可用间接法测定:测定:iii返滴定法返滴定法 有些氧化性
35、物质,不能用有些氧化性物质,不能用 KMnO4 溶液直接滴定,可用间接法测定。如溶液直接滴定,可用间接法测定。如MnO2、PbO2 等。等。凡能与C2O42-定量地沉淀为草酸盐的金属离子Sr2+,Ba2+,Ni2+,Cd2+,Zn2+,Pb2+,Hg2+,Ag2+,Bi3+,Ce3+,La3+都能用此法测定。Ca2+Na2C2O4CaC2O4H2SO4H2C2O4KMnO4标准液滴定间接计算Ca2+OH2CO2MnH4OCMnO2222422OH8CO10Mn2H16OC5MnO22222424根据参与C2O42-量及耗费KMnO4规范溶液的量计算物质的含量。某些具有复原性的有机物如甘油、甲酸
36、、甲醇、甲醛、苯酚、酒石酸、柠檬酸和葡萄糖等也可采用高锰酸钾法进展测定。含MnO2试样C2O42-(过量)剩余C2O42-KMnO4 滴定2 重铬酸钾法重铬酸钾法 1.方法简介方法简介 作用原理:作用原理:K2Cr2O7在酸性溶液中与复原剂被复原为在酸性溶液中与复原剂被复原为Cr3+:优点:优点:(1)K2Cr2O7 易提纯,可作为基准物直接配制规范溶液,易提纯,可作为基准物直接配制规范溶液,不需标定。不需标定。(2)K2Cr2O7 规范溶液稳定,长期妥善保管和运用不需重规范溶液稳定,长期妥善保管和运用不需重新标定。新标定。(3)K2Cr2O7 氧化性较氧化性较KMnO4 弱,因此选择性较高。
37、弱,因此选择性较高。e6H14OCr272OH7Cr223在HCl溶液浓度低于1mol.dm-3 时,Cr2O72-不氧化 Cl-,因此用K2Cr2O7 滴定可在HCl介质中进展。留意:留意:K2Cr2O7 复原产物复原产物Cr3+呈绿色,常需外加指呈绿色,常需外加指示剂,常用指示剂为二苯胺磺酸钠。示剂,常用指示剂为二苯胺磺酸钠。2.运用例如运用例如(1)铁的测定铁的测定 测定铁矿石中的全铁含量。测定铁矿石中的全铁含量。方法:方法:含Fe样浓HClFe3+SnCl2还原Fe2+TiCl3,Na2WO4K2Cr2O7 兰色液无色硫-磷混酸,二苯胺磺酸钠K2Cr2O7紫色+Fe3+2Fe3+SnC
38、l42-+2 Cl-2Fe2+SnCl62-Fe3+Ti3+H2OFe2+TiO2+2H+参与参与H3PO4 目的:目的:降低降低 Fe3+/Fe2+电对的电极电势,使二苯胺磺电对的电极电势,使二苯胺磺酸钠变色点的电极电势位于滴定的电势突跃范围内酸钠变色点的电极电势位于滴定的电势突跃范围内;使使 Fe3+生成无色的生成无色的 Fe(HPO4)2-,消除,消除Fe3+的黄色,利于滴定终点的察看。的黄色,利于滴定终点的察看。此法简单快速准确,广泛运用于消费。此法简单快速准确,广泛运用于消费。(2)利用利用Cr2O72-和和Fe2+反响测定其它物质反响测定其它物质 测定其它氧化型或复原型物质测定其它
39、氧化型或复原型物质 例:例:NO3-的测的测定:定:NO3-被复原的反响速率较慢,可参与过量的被复原的反响速率较慢,可参与过量的Fe2+规范溶液:规范溶液:OH2NOFe3H4Fe3NO2323 测定非氧化复原性物质测定非氧化复原性物质 例:例:Pb2+和和Ba2+的测定:的测定:反响完全后,用K2Cr2O7 规范溶液返滴剩余的Fe2+,可计算出NO3-的含量。Pb2+或 Ba2+CrO42-PbCrO4BaCrO4或洗涤沉淀后溶解Cr2O72-Fe2+标液滴定CrO42-+22H+Cr2O72-+H2O 3.3.碘量法碘量法 (1)(1)方法简介方法简介 原理:利用原理:利用 I2 I2 的
40、氧化性和的氧化性和I-I-的复原性进展滴定分析法。的复原性进展滴定分析法。类型:类型:直接碘量法:以直接碘量法:以I2 I2 为滴定剂,滴定较强的复原剂,如为滴定剂,滴定较强的复原剂,如 S2-,SO22-,S2O32-S2-,SO22-,S2O32-或抗坏血酸。或抗坏血酸。反响条件:酸性或中性。能被反响条件:酸性或中性。能被I2 I2 氧化的物质不多,直接碘量法氧化的物质不多,直接碘量法的运用有限制。的运用有限制。间接碘量法:利用间接碘量法:利用I-的复原性测定具有氧化性的物质。的复原性测定具有氧化性的物质。样品具有氧化性的过量I-I2S2O32-标液滴定 误差来源:碘量法误差来源有二。误差
41、来源:碘量法误差来源有二。一是一是I2 有挥发性,容易挥发损失;有挥发性,容易挥发损失;二是二是I-在酸性溶液中易为空气中的氧气氧化。在酸性溶液中易为空气中的氧气氧化。在中性或弱酸性溶液中及低温在中性或弱酸性溶液中及低温25下滴定。下滴定。I2 溶液应保管在棕色密闭的试剂瓶中。在间接碘量法中,溶液应保管在棕色密闭的试剂瓶中。在间接碘量法中,氧化所析出的氧化所析出的 I2 必需在反响终了后立刻滴定,滴定最必需在反响终了后立刻滴定,滴定最好在碘量瓶中进展。为减少好在碘量瓶中进展。为减少 I-与空气的接触,滴定时与空气的接触,滴定时不应过度摇荡。不应过度摇荡。留意:间接碘量法的反响条件为中性或弱酸性
42、。留意:间接碘量法的反响条件为中性或弱酸性。缘由:在强酸性介质中,缘由:在强酸性介质中,S2O32-会分解析出单质硫;在会分解析出单质硫;在碱性条件下,碱性条件下,I2 与与 S2O32-反响除了生成反响除了生成 S4O62-外,还外,还会生成会生成SO42-,同时,同时I2 也会发生歧化反响。也会发生歧化反响。指示剂:淀粉指示剂指示剂:淀粉指示剂原理:在少量原理:在少量 I-的存在下,的存在下,I2 与淀粉反响构成蓝与淀粉反响构成蓝色吸附配合物,根据蓝色的出现或消逝来指示终点。色吸附配合物,根据蓝色的出现或消逝来指示终点。要求:淀粉溶液应新颖配制。假设放置过久,那么要求:淀粉溶液应新颖配制。
43、假设放置过久,那么与与I2 构成的配合物不呈蓝色而呈紫红色。这种配合物在构成的配合物不呈蓝色而呈紫红色。这种配合物在用用 Na2S2O3滴定时褪色慢,终点不敏锐。滴定时褪色慢,终点不敏锐。Na2S2O3的标定:的标定:基准物:基准物:KIO3,KBrO3,K2Cr2O7,K3Fe(CN)6 纯碘、纯铜等。这些物质除纯碘和纯铜外,都能与纯碘、纯铜等。这些物质除纯碘和纯铜外,都能与KI反反响析出响析出I2,析出的,析出的 I2 用规范用规范Na2S2O3 溶液滴定。溶液滴定。本卷须知:1基准物如 K2Cr2O7与KI反响时,酸度愈大,反响愈快,但酸度太大时 I-容易被空气中氧氧化,所以开场滴定时,
44、酸度普通以在0.8mol.dm-3 1.0 mol.dm-3 之间为宜。2 K2Cr2O7 与KI的反响速率较慢,应将溶液在暗处放置一定时间5分钟,待反响完全后再以 Na2S2O3 溶液滴定。KIO3与KI 的反响较快,不需求放置。3在以淀粉作指示剂时,应先以Na2S2O3 溶液滴定至溶液呈浅黄色大部分I2 已作用,然后参与淀粉溶液,用Na2S2O3 溶液继续滴定至蓝色恰好消逝,即为终点。淀粉指示剂参与假设太早,那么大量的I2 与淀粉结合成蓝色物质,这一部分碘不易与Na2S2O3反响,滴定发生误差。(2)运用例如运用例如(i)钢铁中硫的测定钢铁中硫的测定直接碘量法直接碘量法 将钢铁置于瓷舟中放
45、入将钢铁置于瓷舟中放入1300的管式炉中,通入空气时的管式炉中,通入空气时硫氧化成硫氧化成SO2,SO2 用水吸收,以淀粉为指示剂,用碘规范溶液用水吸收,以淀粉为指示剂,用碘规范溶液滴定:滴定:I2H4SOOHISOH242232IOSOSIICuIICu22242264232222(ii)硫酸铜中铜的测定硫酸铜中铜的测定间接碘量法间接碘量法 原理:碘量法测原理:碘量法测Cu2+是先将是先将Cu2+与过量的与过量的KI反响反响,析出的,析出的I2 用规范用规范Na2S2O3 溶液滴定:溶液滴定:留意:留意:(1)为使反响完全,测定时必需参与过量KI。(2)在滴定接近终点时参与KSCN。CuI沉
46、淀外表剧烈吸附 I2,会导致测定结果偏低。参与KSCN,使CuI沉淀转化为溶解度更小的CuSCN沉淀:ICuSCNSCNCuI3为防止Cu2 水解,反响必需在酸性介质中进展,普通控制溶液pH值在34之间。酸度过低,反响速率慢,终点拖长;酸度过高,那么 I-易被空气氧化为I2,使测定结果偏高。该法还可用于铜矿、含铜电镀液、合金等样品中铜的测定,但应留意防止其他共存离子的干扰。(3)葡萄糖含量的测定葡萄糖含量的测定返滴定法返滴定法 葡萄糖分子中的醛基能在碱性条件下被过量葡萄糖分子中的醛基能在碱性条件下被过量 I2 氧化氧化成羧基:成羧基:OHIIOOH2I22OHICOO)CHOH(OHCHIOC
47、HO)CHOH(OHCH24242剩余的IO-在碱性溶液中歧化成IO3-和I-:I2IOIO33溶液酸化后又析出 I2:最后以 Na2S2O3 规范溶液滴定析出的 I2OH3I3H6I5IO223很多具有氧化性的物质可以用碘量法测定,如过氧化氢、臭氧、漂白粉中的有效氯等。第七节第七节 分量分析法分量分析法(weight analysis)(weight analysis)定义:经过称量物质的质量进展分析测定的方法。定义:经过称量物质的质量进展分析测定的方法。根本方法:根本方法:分别:先用适当的方法使被测组分与其他组分分别。分别:先用适当的方法使被测组分与其他组分分别。根据分别方法的不同,分量分
48、析法可分为沉淀分量分析法、根据分别方法的不同,分量分析法可分为沉淀分量分析法、气化法挥发法、电解法和提取法等。气化法挥发法、电解法和提取法等。称重:由称得的质量计算该组分的含量。称重:由称得的质量计算该组分的含量。沉淀分量法:利用沉淀反响,使待测组分以难溶化合物沉淀分量法:利用沉淀反响,使待测组分以难溶化合物的方式沉淀,经过滤、洗涤、枯燥、灼烧和称量,求得待的方式沉淀,经过滤、洗涤、枯燥、灼烧和称量,求得待测组分的含量。测组分的含量。评价:分量分析法的测定准确度高,但是操作烦琐,评价:分量分析法的测定准确度高,但是操作烦琐,已逐渐被滴定分析法所取代。目前仅有硅、硫、磷、镍已逐渐被滴定分析法所取
49、代。目前仅有硅、硫、磷、镍以及几种稀有元素的准确测定采用分量分析法。以及几种稀有元素的准确测定采用分量分析法。一、沉淀分量法的测定步骤一、沉淀分量法的测定步骤沉淀形和称量形:沉淀形和称量形:试样经处置制成试液后,参与适当沉淀剂,使被测试样经处置制成试液后,参与适当沉淀剂,使被测组分沉淀析出,得到的沉淀称为沉淀形。组分沉淀析出,得到的沉淀称为沉淀形。沉淀经过滤、洗涤,在适当温度下烘干或灼烧,转沉淀经过滤、洗涤,在适当温度下烘干或灼烧,转化为称量形。经称量后,根据称量形的化学式计算被测组化为称量形。经称量后,根据称量形的化学式计算被测组分的百分含量。分的百分含量。二者关系:能够一样,也能够不同。如
50、用BaSO4 分量法测定SO42-时,二者均为BaSO4。用CaC2O4分量法测定C2O42-时:沉淀形为CaC2O4.H2O,沉淀经灼烧后转化为CaO,沉淀形与称量形就不一样。留意:留意:1沉淀形应满足溶解度小、便于过滤、洗涤、纯度高和易沉淀形应满足溶解度小、便于过滤、洗涤、纯度高和易于转化为称量形等要求。于转化为称量形等要求。2称量形应满足有确定的化学组成、摩尔质量要大、稳定称量形应满足有确定的化学组成、摩尔质量要大、稳定等要求。等要求。2.沉淀的构成过程沉淀的构成过程沉淀构成的过程:包括晶核构成和晶核长大两个沉淀构成的过程:包括晶核构成和晶核长大两个过程。过程。构晶离子成核作用晶核成长过
51、程沉淀微粒聚集定向排列无定型沉淀晶形沉淀晶核的构成:溶液呈过饱和态时,构晶离子在一定条件晶核的构成:溶液呈过饱和态时,构晶离子在一定条件下可自发缔和成包含一定数目的构晶离子的晶核。下可自发缔和成包含一定数目的构晶离子的晶核。晶核的长大:晶核构成后,构晶离子向晶核分散,晶核晶核的长大:晶核构成后,构晶离子向晶核分散,晶核逐渐长大最终成为沉淀微粒。这种沉淀微粒相互聚集在逐渐长大最终成为沉淀微粒。这种沉淀微粒相互聚集在一同便构成无定形沉淀;假设构晶离子按一定规那么在一同便构成无定形沉淀;假设构晶离子按一定规那么在沉淀微粒外表堆积,便会构成晶形沉淀。在不同的沉淀沉淀微粒外表堆积,便会构成晶形沉淀。在不
52、同的沉淀条件下,同种物质可以构成无定形沉淀,也可以构成晶条件下,同种物质可以构成无定形沉淀,也可以构成晶形沉淀。形沉淀。3.3.影响沉淀纯度的要素影响沉淀纯度的要素沉淀析出时,溶液中其他组分可经过吸附、生成混晶、沉淀析出时,溶液中其他组分可经过吸附、生成混晶、被沉淀物包夹和后沉淀等方式混入沉淀中而影响沉淀的被沉淀物包夹和后沉淀等方式混入沉淀中而影响沉淀的纯度。可采取以下措施提高沉淀的纯度:纯度。可采取以下措施提高沉淀的纯度:1 1选择适当分析程序选择适当分析程序 先测低含量组分。先测低含量组分。(2)(2)选择适当的沉淀剂选择适当的沉淀剂 应有选择性、溶解度小、晶形应有选择性、溶解度小、晶形好
53、。好。(3)(3)降低易被吸附离子的浓度降低易被吸附离子的浓度 如如 BaSO4 BaSO4 沉淀易吸附沉淀易吸附Fe3+Fe3+,应先将,应先将Fe3+Fe3+复原为不易被吸附的复原为不易被吸附的 Fe2+Fe2+,或用酒石,或用酒石酸掩蔽。酸掩蔽。(4)(4)选择适当沉淀条件选择适当沉淀条件 包括浓度、温度、试剂参与顺包括浓度、温度、试剂参与顺序和速度、陈化情况等。序和速度、陈化情况等。(5)(5)选择适宜洗涤剂选择适宜洗涤剂 洗涤剂在沉淀烘干或灼烧时应易洗涤剂在沉淀烘干或灼烧时应易挥发除去。挥发除去。(6)(6)再沉淀再沉淀 将沉淀过滤洗涤后重新溶解,使杂质进入将沉淀过滤洗涤后重新溶解,
54、使杂质进入溶液后再进展沉淀。该法对除去吸留和包藏的杂质非常有溶液后再进展沉淀。该法对除去吸留和包藏的杂质非常有效。效。4.4.沉淀条件的选择沉淀条件的选择适当的沉淀条件,可使沉淀完全、纯真,易于过滤和洗适当的沉淀条件,可使沉淀完全、纯真,易于过滤和洗涤。涤。1 1晶形沉淀的沉淀条件晶形沉淀的沉淀条件 目的:获得易于过滤洗涤的纯真大颗粒晶形沉淀。目的:获得易于过滤洗涤的纯真大颗粒晶形沉淀。方法:控制较小的过饱和度;选择稀、热、搅、慢、方法:控制较小的过饱和度;选择稀、热、搅、慢、陈化的沉淀条件。陈化的沉淀条件。2 2非晶形沉淀的沉淀条件非晶形沉淀的沉淀条件 特点:含水多,构造疏松,吸附和包藏的杂
55、质较多。特点:含水多,构造疏松,吸附和包藏的杂质较多。方法:浓、快、搅、热、加电解质,不用陈化。方法:浓、快、搅、热、加电解质,不用陈化。3 3均相沉淀法均相沉淀法 原理:参与试剂先构成均匀的溶液,经过缓慢的化学原理:参与试剂先构成均匀的溶液,经过缓慢的化学反响得到沉淀:加热、改动反响得到沉淀:加热、改动pHpH值、参与其它试剂。值、参与其它试剂。目的:获得颗粒较大、构造严密、纯真、易于过滤的目的:获得颗粒较大、构造严密、纯真、易于过滤的晶形沉淀。晶形沉淀。例如:沉淀例如:沉淀Ca2+Ca2+时,在含时,在含Ca2+Ca2+的酸性溶液中参与草酸,的酸性溶液中参与草酸,由于溶液的酸度较高,由于溶
56、液的酸度较高,C2O42-C2O42-浓度较低,不能析出浓度较低,不能析出CaC2O4 CaC2O4 沉淀。假设在溶液中参与尿素,并加热至沉淀。假设在溶液中参与尿素,并加热至9090左左右,尿素水解:右,尿素水解:水解产生的NH3中和溶液中的H+,溶液的pH值逐渐升高,C2O42-浓度不断增大,使CaC2O4 均匀缓慢地生成,由此得到的CaC2O4沉淀颗粒大且纯真。运用:均相沉淀法并不限于改动溶液的酸度,还可以利用脂类和其他有机化合物的水解,配合物的水解,氧化复原反响,或缓慢地合成所需的沉淀剂等方式来进展。CO(NH3)2+H2OCO2 +NH35.5.沉淀分量法分析结果的计算沉淀分量法分析结
57、果的计算换算因数换算因数(conversion factor)(conversion factor)或化学因数或化学因数F F:沉淀分量分析中,需将称得的称量形的质量换算成待测沉淀分量分析中,需将称得的称量形的质量换算成待测组分的质量。二者的摩尔质量之比是一常数,即为换算因组分的质量。二者的摩尔质量之比是一常数,即为换算因数数F F称量形摩尔质量待测组分摩尔质量baF例:例:待测组分待测组分 称量形称量形 F F S S BaSO4 S/BaSO4=0.4BaSO4 S/BaSO4=0.4 Cr2O3 Cr2O3 BaCrO4 Cr2O3/2 BaCrO4=0.3000BaCrO4 Cr2O3
58、/2 BaCrO4=0.3000a,b为系数,作用:使分子、分母中待测元素的原子数目相等。由称得的称量形质量w、换算因数F以及试样质量G,即可求出待测组分A的百分含量:100GwFA%例例9.26 9.26 称取含铝试样称取含铝试样0.5000g0.5000g,溶解后用,溶解后用8-8-羟基喹啉沉羟基喹啉沉淀。烘干后称得淀。烘干后称得 Al(C9H6NO)3 Al(C9H6NO)3 重重0.3280g0.3280g。计算样品中铝。计算样品中铝的百分含量。假设将所得沉淀灼烧成的百分含量。假设将所得沉淀灼烧成 Al2O3 Al2O3,其称重形,其称重形为多少克?为多少克?解:称量形为解:称量形为A
59、l(C9H6NO)3Al(C9H6NO)385.3100g5000.005873.0g3280.0100G)NOHC(AlAlwAl%369形式称重时:若以同量的32OAlAl85.3100g5000.05293.0w100GOAlAl2wAl%32那么 W=0.0364g 可见:称量形摩尔质量大的所呵斥的称量误差较小,有利于少量组分的测定。习题习题9.有一纯的有机酸有一纯的有机酸400mg,用,用0.099996mol.dm-3 NaOH溶液滴定,滴定曲线阐明该酸为一元酸,参与溶液滴定,滴定曲线阐明该酸为一元酸,参与32.80mLNaOH溶液时达终点。当参与溶液时达终点。当参与16.40mLNaOH溶液溶液时,时,pH为为4.20。根据上述数据求:。根据上述数据求:1酸的酸的pKa;2酸的相对分子量;酸的相对分子量;3如酸只含如酸只含C、H、O,写出符合逻,写出符合逻辑的阅历式此题中辑的阅历式此题中C=12、H=1、O=16 解:解:(1)H+=Kaca/cb 2 n(酸酸)=n(碱碱)=0.0 9 9 9 9 6 32.80=3.280mmolM/M(C)=400/3.280=122.03CHOOH为为46122-46=76CH2为为14,故推断为苯甲酸,故推断为苯甲酸C6H5COOH。
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
