 含硫化合物的性质和应用苏教版必修1ppt课件
含硫化合物的性质和应用苏教版必修1ppt课件


《含硫化合物的性质和应用苏教版必修1ppt课件》由会员分享,可在线阅读,更多相关《含硫化合物的性质和应用苏教版必修1ppt课件(33页珍藏版)》请在装配图网上搜索。
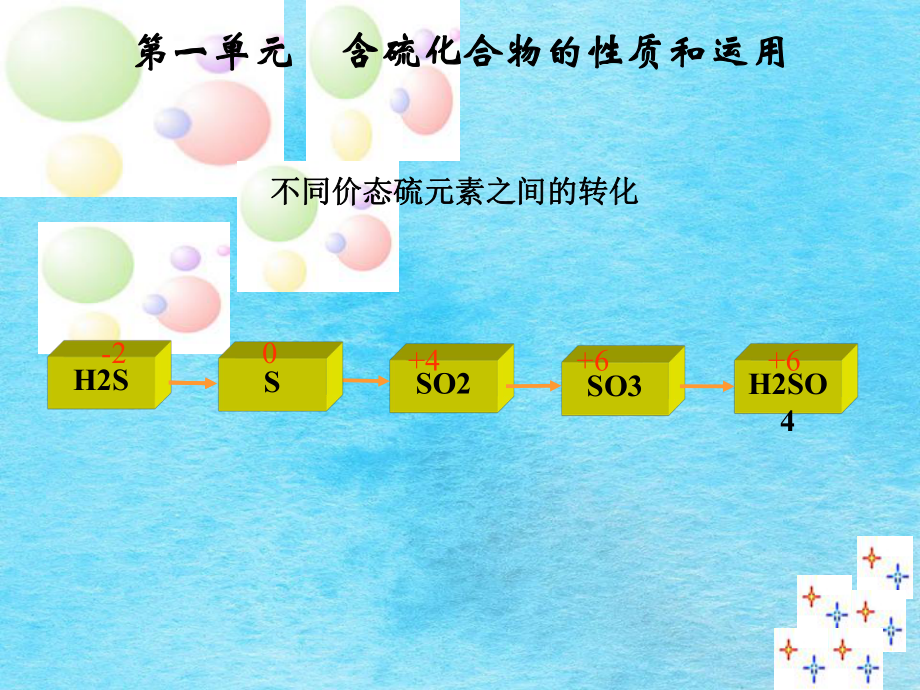
1、第一单元第一单元 含硫化合物的性质和运用含硫化合物的性质和运用H2SSO2SO3H2SO4不同价态硫元素之间的转化不同价态硫元素之间的转化S-20+4+6+61.1.物理性质物理性质扇闻法扇闻法HCl(1:500)SO2(1:40)Cl2(1:2)HCl(1:500)SO2(1:40)Cl2(1:2)SO2+H2OSO2+H2O H2SO3H2SO3SO2SO2是酸性氧化物是酸性氧化物SO2+4SH2SO40+6复原性复原性氧化性氧化性加氧化剂加氧化剂加复原剂加复原剂如如O2、Cl2、Na2O2、KMnO4、HNO3等等作为作为S的中间价态的物质的中间价态的物质 化合价既可升高又可降低,化合价
2、既可升高又可降低,升高时作复原剂,降低时作氧化剂升高时作复原剂,降低时作氧化剂SO2+2H2S =3S+2H2O H2SO4+BaCl2=BaSO4+2HCl H2SO4+BaCl2=BaSO4+2HCl 向向SO2SO2溶液中加溶液中加BaCl2BaCl2溶液溶液,再加过氧化氢与稀盐酸再加过氧化氢与稀盐酸生成不溶于酸白色沉淀生成不溶于酸白色沉淀景象景象:结论结论:SO2:SO2具有复原性具有复原性 H2SO3+H2O2=H2SO4+H2O H2SO3+H2O2=H2SO4+H2O H2SOH2SO3 3H2OH2O2 2H2SOH2SO4 4BaClBaCl2 2BaSOBaSO4 42 2
3、、加热后加、加热后加SO2SO2的试管红色的试管红色,加氯气的无变化加氯气的无变化探求探求3 3:SO2SO2的漂白性的漂白性SO2SO2有漂白性使有色物质褪色,加热有色物恢复原色有漂白性使有色物质褪色,加热有色物恢复原色两支装品红试管各加两支装品红试管各加SO2SO2和氯水景象和氯水景象?加热两支试管景象?加热两支试管景象?能否使紫色石蕊试液褪色?能否使紫色石蕊试液褪色?加加SO2SO21 1加氯水加氯水2 21 12 2不能漂白指示剂不能漂白指示剂1 1、品红溶液都褪色、品红溶液都褪色无色的物质无色的物质SO2+SO2+有色物质有色物质分解分解SO2也具有的特殊化学性质也具有的特殊化学性质
4、:漂白性漂白性 它能与某些有色物质结合成不稳定的无色物质而具有漂白性.用途:它可以用来漂白纸浆、毛、丝、草编制品等。北方市场上,经常见有外面非常白而里面却是黄的馒头和粉丝,里外不一样,它的做法是在一个封锁的容器中先放入馒头或粉丝,再放入熄灭着的硫后熏一下而得到的,您能否马上就食用或用来做菜?为什么长时间放置的报纸和草帽会变黄?为什么长时间放置的报纸和草帽会变黄?P78资料卡片:资料卡片:SO2的漂白作用的漂白作用氧化氧化作用作用化合化合作用作用吸附吸附作用作用HClO、O3Na2O2、H2O2Ca(ClO)2SO2活性炭活性炭化学变化化学变化化学变化化学变化物理变化物理变化永久漂白永久漂白暂时
5、漂白暂时漂白永久漂白永久漂白漂白性物质小结漂白性物质小结二氧化硫物理性质物理性质化学性质化学性质(1)、SO2与水反响与水反响SO2 +H2O正反响正反响逆反响逆反响H2SO3、SO2和碱反响和碱反响 SO2+Ca(OH)2 CaSO3 +H2O 、SO2和碱性氧化物反响和碱性氧化物反响2 2复原性:复原性:2SO2 +O2 2SO3催化催化剂剂加热加热2H2S+SO2 3S+2H2O3 3氧化性:氧化性:(4)、漂白性、漂白性 某些有机色素某些有机色素无色的物质无色的物质SO2SO2+CaO CaSO3CaSO3+SO2+H2O=Ca(HSO3)2暂时性暂时性无色、有刺激性气味、有毒、易无色
6、、有刺激性气味、有毒、易 液化、比空气重、易溶于水液化、比空气重、易溶于水硫酸型酸雨的构成硫酸型酸雨的构成SO2 SO2 SO3 SO3 H2SO4H2SO4O2+2H2SO3=2H2SO4SO3+H2O=H2SO42SO2+O2 2SO3催化剂催化剂SO2+H2OH2SO31.1.对人体安康呵斥直接危害对人体安康呵斥直接危害4.4.破坏建筑物破坏建筑物3.3.使土壤酸性加强、湖泊酸化,生态环境受损使土壤酸性加强、湖泊酸化,生态环境受损2.2.破坏森林、草原和农作物破坏森林、草原和农作物酸雨的危害酸雨的危害酸雨的防治酸雨的防治二氧化硫二氧化硫对环境的污染对环境的污染硫酸型酸硫酸型酸雨的构成雨的
7、构成酸雨的危害酸雨的危害酸雨的酸雨的防治防治酸雨酸雨2H2SO3+O22H2SO3+O22H2SO42H2SO4SO2SO2H2O H2O H2SO3H2SO3污染水源、酸化土壤腐蚀建筑设备污染水源、酸化土壤腐蚀建筑设备开发清洁能源开发清洁能源 2CaSO3+O22CaSO4SO2+2NH3+H2O(NH4)2SO3脱硫脱硫 SO2+Ca(OH)2 CaSO3 +H2O SO2+NH3+H2O NH4HSO32(NH4)2SO3+O2 2(NH4)2SO4石灰石石灰石-石膏法石膏法氨水法氨水法 设计实验,如何鉴别设计实验,如何鉴别SO2SO2和和CO2CO2?简述实验的简要步骤。简述实验的简要
8、步骤。假设将假设将SO2SO2和和Cl2Cl2混合溶液于水其漂白才混合溶液于水其漂白才干如何变化?干如何变化?分分析析!二氧化硫和氯水发生化学反响生成新物质二氧化硫和氯水发生化学反响生成新物质而而HCl 和和H2 SO4是没有漂白性的,因此漂白性能够消是没有漂白性的,因此漂白性能够消逝逝 SO2 +Cl2+2H2O 2HCl +H2 SO4 SO2 SO2、HClOHClO都具有漂白作用,那么这都具有漂白作用,那么这两者物质的漂白作用有何不同?两者物质的漂白作用有何不同?1“酸雨的构成主要是由于酸雨的构成主要是由于 A.滥伐森林,破坏生态平衡滥伐森林,破坏生态平衡 B.工业上大量熄灭含硫的燃料
9、工业上大量熄灭含硫的燃料C.大气中大气中CO2含量增多含量增多 D.汽车排出大量的尾气汽车排出大量的尾气2他以为减少酸雨产生的途径可采取的措施是他以为减少酸雨产生的途径可采取的措施是 少用煤作燃料少用煤作燃料 把工厂烟囱造高把工厂烟囱造高 燃料脱硫燃料脱硫 在已酸在已酸化的土壤中加石灰化的土壤中加石灰开发新能源开发新能源A.B.C.D.BC一个城市的环保部门采集了一份雨水样品一个城市的环保部门采集了一份雨水样品,每隔每隔一段时间测定一次一段时间测定一次pHpH值值,其结果如下其结果如下:1.1.请他写出酸雨开场呈酸性的化学方程式请他写出酸雨开场呈酸性的化学方程式.2.2.这种雨水的这种雨水的p
10、HpH值逐渐减小值逐渐减小,其缘由何在其缘由何在?(提示提示:从硫元素的化合价和酸性强弱方面思索从硫元素的化合价和酸性强弱方面思索)测试时间0小时后1小时后2小时后4小时后5小时后雨水的pH值4.744.63 4.57 4.534.53SO2+H2O=H2SO3 2SO2+O2=2SO3O2+2H2SO3=2 H2SO4 SO3+H2O=H2SO4空气中的氧气在灰尘等存在下可以逐渐将空气中的氧气在灰尘等存在下可以逐渐将水中的水中的H2SO3H2SO3氧化成强酸硫酸氧化成强酸硫酸.景象:景象:固体由蓝色变为灰白色,固体由蓝色变为灰白色,溶液仍为无色。溶液仍为无色。反响:反响:CuSO45H2O+
11、H2SO4(浓浓)=CuSO4+H2SO45H2O结论:结论:浓硫酸有吸水性浓硫酸有吸水性实验实验在点滴板中放入在点滴板中放入少量胆矾,再加少量胆矾,再加入少量浓硫酸入少量浓硫酸景象:景象:滴有浓硫酸的滤纸炭化滴有浓硫酸的滤纸炭化变黑。变黑。解释:解释:滤纸的主要成份是纤维素,滤纸的主要成份是纤维素,由碳、氢、氧三种元素组成,由碳、氢、氧三种元素组成,浓硫酸能把滤纸中的氢、氧元浓硫酸能把滤纸中的氢、氧元素按水的比例脱去。素按水的比例脱去。结论:结论:浓硫酸有脱水性浓硫酸有脱水性实验实验把少量浓硫酸把少量浓硫酸滴在纸片、火滴在纸片、火柴梗上柴梗上比较学习 浓硫酸的吸水性和脱水性有什么区别?吸水性
12、是指浓硫酸直接与水分子结合。吸水性是指浓硫酸直接与水分子结合。脱水性是指浓硫酸将许多有机物中的氢、脱水性是指浓硫酸将许多有机物中的氢、氧元素按水的比例脱去。氧元素按水的比例脱去。吸收现成的水吸收现成的水反响生成水反响生成水 在试管中在试管中放入一块铜片,放入一块铜片,加热。用潮湿加热。用潮湿的品红试纸检的品红试纸检验放出的气体,验放出的气体,把反响后的溶把反响后的溶液倒在水中稀液倒在水中稀释。释。实验实验4-8景象:景象:加热能反响,产生的气加热能反响,产生的气体能使潮湿的品红试纸褪色,体能使潮湿的品红试纸褪色,溶液稀释后呈蓝色。溶液稀释后呈蓝色。反响:反响:Cu+2H2SO4(浓浓)=CuS
13、O4+SO2 +2H2O结论:结论:浓硫酸有氧化性浓硫酸有氧化性 在烧杯中在烧杯中放入少量蔗糖,放入少量蔗糖,用少量水调成用少量水调成糊状,注入浓糊状,注入浓硫酸,用玻棒硫酸,用玻棒搅拌。搅拌。实实 验验景象:景象:蔗糖变黑,体积膨胀,放出大蔗糖变黑,体积膨胀,放出大量热,放出有刺激性气味的气体。量热,放出有刺激性气味的气体。反响:反响:结论:结论:表达出浓硫酸的吸水性、脱表达出浓硫酸的吸水性、脱水性和氧化性水性和氧化性C12H22O11 12C+11H2O浓硫酸浓硫酸2H2SO4(浓浓)+C =CO2 +2H2O+2SO2总结浓硫酸的特性浓硫酸的特性 吸水性吸水性 强氧化性强氧化性 加热时浓
14、硫酸能与大多数金属反响,加热时浓硫酸能与大多数金属反响,但不生成氢气。但不生成氢气。常温下使铁铝钝化常温下使铁铝钝化 脱水性脱水性Cu+2H2SO4 浓浓=CuSO4+SO2 +2H2O 与某些非金属反响与某些非金属反响C+2H2SO4 浓浓=CO2 +SO2 +2H2O 与硫化氢、碘化氢等复原剂反响与硫化氢、碘化氢等复原剂反响H2S+H2SO4 浓浓=S +SO2 +2H2O分析分析 稀硫酸的氧化性和浓硫酸稀硫酸的氧化性和浓硫酸的氧化性有何不同?的氧化性有何不同?稀硫酸的氧化性是由电离出的稀硫酸的氧化性是由电离出的H+引起的,引起的,氢离子只能氧化金属活动顺序表中氢前的金属,氢离子只能氧化金
15、属活动顺序表中氢前的金属,所以稀硫酸具有弱的氧化性。所以稀硫酸具有弱的氧化性。浓硫酸的氧化性是由硫酸分子中浓硫酸的氧化性是由硫酸分子中+6价硫元素引起的,它可以氧化金属活动价硫元素引起的,它可以氧化金属活动顺序表氢后的金属;顺序表氢后的金属;所以浓硫酸具有强的氧化性。所以浓硫酸具有强的氧化性。硫酸硫酸稀硫酸:酸的通性稀硫酸:酸的通性浓硫酸浓硫酸的特性的特性吸水性吸水性脱水性脱水性强氧化性强氧化性工业制硫酸的原理工业制硫酸的原理硫酸的性质及运用硫酸的性质及运用原来有水原来有水原来没水,但含原来没水,但含H、O元素元素C+2H2SO4浓浓=CO2+2SO2+H2OCu+H2SO4浓浓=CuSO4+
16、H2O+SO2 H2、O2、N2、CO、CO2、SO2、HCl、Cl2等等碱性气体碱性气体NH3复原性气体复原性气体H2S、HI、HBr可枯燥可枯燥不可枯燥不可枯燥硫酸用途硫酸用途制过磷酸钙制过磷酸钙电镀前去锈电镀前去锈制硫酸铵制硫酸铵制硫酸盐制硫酸盐制挥发性酸制挥发性酸精炼石油,制炸精炼石油,制炸药、农药、染料药、农药、染料Ca3(PO4)2+2H2SO4=Ca(H2PO4)2+2CaSO4 如何鉴别失去标签的稀硫酸和浓硫酸?如何鉴别失去标签的稀硫酸和浓硫酸?请同窗们提出尽能够多的方案请同窗们提出尽能够多的方案。吸水性 脱水性 所含微粒浓硫酸稀硫酸 有有 有有 H2SO4 分子分子 无无 无
17、无 H+、SO42-1用废铜屑与硫酸反响用废铜屑与硫酸反响 制制CuSO4,以下两种方法,以下两种方法哪个好?为什么哪个好?为什么?浓硫酸与铜共热浓硫酸与铜共热铜先在空气中加热制取氧化铜,再与稀硫酸反响铜先在空气中加热制取氧化铜,再与稀硫酸反响2、向、向50mL18mol/L的硫酸中参与足量的铜片并加热,的硫酸中参与足量的铜片并加热,被复原的硫酸的物质的量被复原的硫酸的物质的量()A、等于、等于0.9molB、大于、大于0.45mol 小于小于0.9molC、等于、等于0.45mol D、小于、小于0.45molD步骤步骤反应反应设备设备造气造气催化氧化催化氧化吸收吸收 煅烧煅烧4FeS2+11O2=2Fe2O3+8SO2沸腾炉沸腾炉催化剂催化剂2SO2+O22SO3接触室接触室SO3+H2OH2SO4 吸收塔吸收塔
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
