 影响化学平衡移动的因素【课堂教育】
影响化学平衡移动的因素【课堂教育】


《影响化学平衡移动的因素【课堂教育】》由会员分享,可在线阅读,更多相关《影响化学平衡移动的因素【课堂教育】(53页珍藏版)》请在装配图网上搜索。
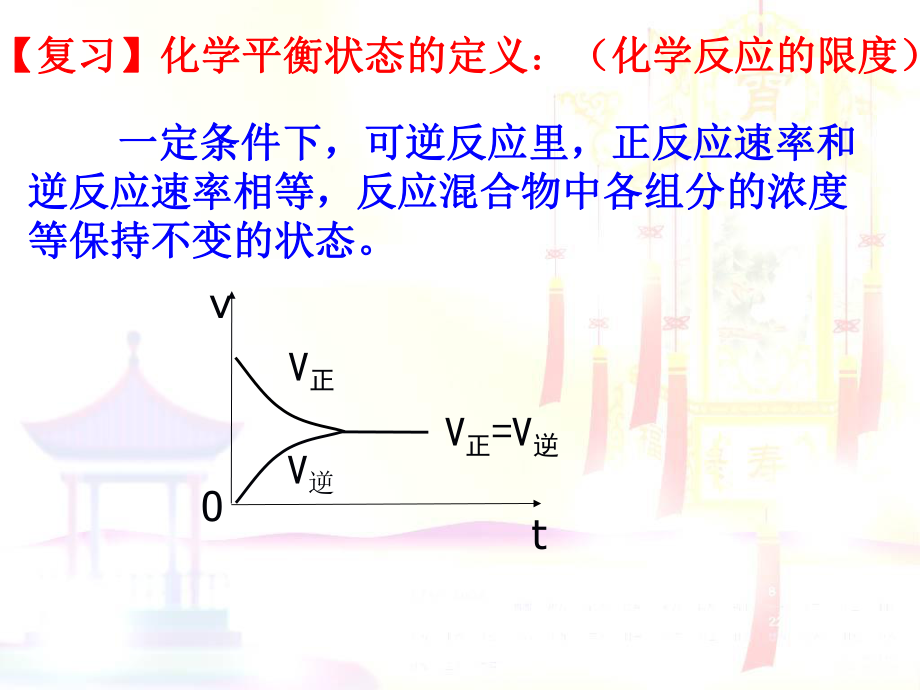
1、【复习】化学平衡状态的定义【复习】化学平衡状态的定义:(化学反应的限度)(化学反应的限度)一定条件下,可逆反应里,正反应速率和一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度逆反应速率相等,反应混合物中各组分的浓度等保持不变的状态。等保持不变的状态。V正V逆V正=V逆vt0 化学平衡的研究对象是化学平衡的研究对象是,化学平,化学平衡是有条件限制的衡是有条件限制的平衡,只有在平衡,只有在时才能保持平衡,当外界条件改时才能保持平衡,当外界条件改变时,化学平衡会被变时,化学平衡会被,反应混合物里,反应混合物里各组分的含量不断各组分的含量不断,由于条件变化,由于条件变化对正
2、逆反应速率的影响不同,致使对正逆反应速率的影响不同,致使v正正 v逆逆,然后在新条件下建立然后在新条件下建立。可逆反应可逆反应暂时性暂时性条件一定条件一定破坏破坏发生变化发生变化新的平衡新的平衡1,定义:,定义:可逆反应中,可逆反应中,旧化学平衡的破坏旧化学平衡的破坏,新化学平衡建立新化学平衡建立过程叫做化学平衡的移动。过程叫做化学平衡的移动。V正正V逆逆V正正=V逆逆0条件改变条件改变建立新平衡建立新平衡破坏旧平衡破坏旧平衡V正正=V逆逆0一定时间后一定时间后一,化学平衡的移动一,化学平衡的移动平衡平衡1 1 不平衡不平衡 平衡平衡2 2若外界条件改变,引起若外界条件改变,引起V V正正VV
3、逆逆,此时正反应此时正反应占优势,占优势,化学平衡向化学平衡向正反应正反应方向移动。方向移动。若外界条件改变,引起若外界条件改变,引起V V正正V V逆逆,此时逆反此时逆反应占优势,应占优势,化学平衡向化学平衡向逆反应逆反应方向移动方向移动。若外界条件改变,引起若外界条件改变,引起V V正正、V V逆同倍数改变逆同倍数改变或不变,则或不变,则V V正正=V V逆逆,化学平衡化学平衡不发生移动。不发生移动。2,规律,规律浓浓 度度思考思考2:影响化学反应速率的外界条件主要有哪些?影响化学反应速率的外界条件主要有哪些?化学反应速率化学反应速率温温 度度压压 强强催化剂催化剂思考思考1:综上所述,若
4、想让平衡发生移动,本质上综上所述,若想让平衡发生移动,本质上应该怎么办?应该怎么办?改变反应速率使改变反应速率使V正正V逆逆1、浓度对化学平衡的影响(、浓度对化学平衡的影响(P26实验实验2-5)二,影响化学平衡的条件二,影响化学平衡的条件视频视频播放播放现象分析现象分析:Cr2O72-+H2O 2CrO42-+2H+橙色橙色 黄色黄色滴加溶液滴加溶液 滴加滴加H2SO4 滴加滴加NaOH 现象现象滴加滴加H2SO4增大增大c(H+)橙色加深橙色加深C(Cr2O72-)增大增大平衡逆向移动平衡逆向移动平衡破坏平衡破坏滴加滴加NaOH,减小减小c(H+)黄色加深黄色加深C(CrO42-)增大增大
5、平衡破坏平衡破坏平衡正向移动平衡正向移动结论结论:增大生成物的浓度增大生成物的浓度,平衡向逆反应方向移动平衡向逆反应方向移动 结论结论:减小生成物的浓度减小生成物的浓度,平衡向正反应方向移动平衡向正反应方向移动 橙黄色变为黄色橙黄色变为黄色 橙黄色变为橙色橙黄色变为橙色P27实验实验2-6 结论结论:增大反应物浓度,平衡正反应方向移动;减小反应增大反应物浓度,平衡正反应方向移动;减小反应物的浓度物的浓度,平衡向逆反应方向移动平衡向逆反应方向移动 视频播放视频播放小结:浓度对化学平衡的影响及应用小结:浓度对化学平衡的影响及应用(书书27页页)规律规律:增大反应物的浓度增大反应物的浓度或或减小生成
6、物的浓度平衡向正减小生成物的浓度平衡向正反应方向移动反应方向移动增大生成物的浓度增大生成物的浓度或或减小反应物的浓度平衡向逆减小反应物的浓度平衡向逆反应方向移动反应方向移动工业上常利用此规律增大廉价反应物的浓工业上常利用此规律增大廉价反应物的浓度以提高价格较高的原料的转化率以降低度以提高价格较高的原料的转化率以降低成本成本应用:应用:增大生成物浓度增大生成物浓度vtV正V逆平衡平衡逆向逆向移动移动V V逆逆VV正正浓度对化学平衡的影响的速率浓度对化学平衡的影响的速率-时间图时间图(例)(例)V V逆逆V V正正V正=V逆减小生成物浓度减小生成物浓度V正vtV逆V逆V正=V逆平衡平衡正向正向移动
7、移动V V正正VV逆逆V正浓度对化学平衡的影响的速率浓度对化学平衡的影响的速率-时间图时间图(练习)(练习)增大反应物浓度增大反应物浓度vtV正V逆V逆V V正正VV逆逆V正正平衡平衡正向正向移动移动V正=V逆浓度对化学平衡的影响的速率浓度对化学平衡的影响的速率-时间图时间图(练习)(练习)减小反应物浓度减小反应物浓度V逆vtV逆V正V正=V逆平衡平衡逆向逆向移动移动V V逆逆VV正正V正浓度对化学平衡的影响的速率浓度对化学平衡的影响的速率-时间图时间图浓度改浓度改变速率变速率-时间关时间关系图:系图:思考思考3:由以上四图还可以得出什么结论:由以上四图还可以得出什么结论:1)改变反应物浓度)
8、改变反应物浓度瞬间瞬间,只能改变正反应速率,只能改变正反应速率 改变生成物浓度改变生成物浓度瞬间瞬间,只能改变逆反应速率,只能改变逆反应速率2)改变浓度)改变浓度瞬间瞬间,若若v(正正)v(逆逆),平衡向正反应方向移动,平衡向正反应方向移动 若若v(逆逆)v(正正),平衡向逆反应方向移动,平衡向逆反应方向移动3)新旧平衡速率比较:)新旧平衡速率比较:增大浓度,增大浓度,新平衡速率新平衡速率大于大于旧平衡速率旧平衡速率 减小浓度,减小浓度,新平衡速率新平衡速率小于小于旧平衡速率旧平衡速率练习:练习:可逆反应可逆反应H2O(g)+C(s)CO(g)+H2(g)在一定条件下达到平衡状态,改变下在一定
9、条件下达到平衡状态,改变下列条件,能否引起平衡移动?列条件,能否引起平衡移动?CO的浓度有何的浓度有何变化?变化?增大水蒸气浓度增大水蒸气浓度 加入更多的碳加入更多的碳 增加增加H2浓度浓度平衡正向移动,平衡正向移动,CO浓度增大浓度增大平衡不移动,平衡不移动,CO浓度不变浓度不变平衡逆向移动,平衡逆向移动,CO浓度减小浓度减小14特选课堂小结:小结:增加固体或纯液体的量不能改变其浓度,增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以也不能改变速率,所以V V(正正)仍等于仍等于V V(逆逆),平衡不,平衡不移动。移动。作为离子反应,只有改变实际参加反应的离子作为离子反应,只有改变实际
10、参加反应的离子浓度对平衡有影响,如:浓度对平衡有影响,如:FeCl3+3KSCN Fe(SCN)3+3KCl增加增加KClKCl固体的量平衡不移动,因为固体的量平衡不移动,因为KClKCl不参不参与反应。与反应。总的来说:总的来说:化学平衡的化学平衡的移动移动能能削弱削弱浓度改变给可浓度改变给可逆反应所带来的逆反应所带来的影响影响,但并,但并不能完全抵消不能完全抵消。15特选课堂压强压强/MPa15103060100NH3/%2.09.216.435.5 53.669.41N2 +3H2 2NH3 101.00.50.14.610.514.226.32、压强对化学平衡的影响、压强对化学平衡的影
11、响思考思考4:由上面两组实验数据可以得出什么由上面两组实验数据可以得出什么规律?规律?压强对化学平衡的影响压强对化学平衡的影响规律:规律:对于反应前后气体体积有变化的对于反应前后气体体积有变化的可逆反应:在可逆反应:在其它条件不变的情况下:其它条件不变的情况下:增大压强增大压强,会使化学平衡向,会使化学平衡向着气体着气体分子数减小分子数减小的方向移动;的方向移动;减小压强减小压强,会使化学,会使化学平衡向着气体气体平衡向着气体气体分子数增大分子数增大的方向移动。的方向移动。回忆回忆:改变压强时对正、逆反应速率有怎么样影响改变压强时对正、逆反应速率有怎么样影响?增大压强,增大压强,V正、正、V逆
12、都增大;减小压强,逆都增大;减小压强,V正、正、V逆都减小。逆都减小。思考思考5:若某可逆反应反应前后气体体积没有变化,压若某可逆反应反应前后气体体积没有变化,压强改变后速率变不变?怎么变?平衡移不移动?强改变后速率变不变?怎么变?平衡移不移动?规律:规律:对于反应前后气体总体积相等的可逆反应,改对于反应前后气体总体积相等的可逆反应,改变压强只改变化学反应速率,而对平衡无影响;变压强只改变化学反应速率,而对平衡无影响;mA(g)+nB(g)pC(g)+qD(g);V对于反应前后对于反应前后气体分子数目不相等气体分子数目不相等的可逆反应的可逆反应(1)当)当 m+n p+q 时:时:(例)(例)
13、增大压强增大压强(缩小体积缩小体积):改变条件时:改变条件时:V正正,V逆逆 平衡移动的方向:平衡移动的方向:。V正正V逆逆的关系:的关系:V正正V逆逆增大增大增大增大 正向正向 即平衡向着气体体积减即平衡向着气体体积减小的方向移动小的方向移动增大压强增大压强(1)当)当 m+n p+q 时:时:(练习)(练习)减小压强V(逆逆)V(正正)当当 m+n p+q 时:时:(练习)(练习)tVt00t1t2t3V正V逆V正V逆0t1t2t3(3)当)当m+n=p+q时:时:(练习)(练习)V正 V逆增大压强增大压强减小压强减小压强V正 V逆=压强改变速率速率-时时间关系图间关系图aA(g)+bB(
14、g)cC(g)思考思考6:由以上四图还可以得出什么结论:由以上四图还可以得出什么结论:a+bc1)新旧平衡速率比较:)新旧平衡速率比较:增大压强,增大压强,新平衡速率新平衡速率大于大于旧平衡速率旧平衡速率 减小压强,减小压强,新平衡速率新平衡速率小于小于旧平衡速率旧平衡速率2)改变压强)改变压强瞬间瞬间:大的大增、小的小增;大的大减、小的小减大的大增、小的小增;大的大减、小的小减思考思考7:若某平衡混合物都是固体或液体,改变压强若某平衡混合物都是固体或液体,改变压强速率变不变?平衡移不移动?速率变不变?平衡移不移动?不变不变不移动不移动思考思考8:在一定温度下的密闭容器中存在在一定温度下的密闭
15、容器中存在2NO2NO2 2(气气)N N2 2O O4 4(气气)平衡,先保持平衡,先保持容器容积不变容器容积不变,充入,充入ArAr气以增气以增大压强后,正逆反应速率将如何变化?平衡将如何大压强后,正逆反应速率将如何变化?平衡将如何移动?若保持压强不变,充入移动?若保持压强不变,充入ArAr气,正逆反应速率气,正逆反应速率如何变化?平衡如何移动?如何变化?平衡如何移动?正逆反应速率均不变;平衡不移动。正逆反应速率均不变;平衡不移动。正逆反应速率均减小;平衡逆向移动。正逆反应速率均减小;平衡逆向移动。总的来说:总的来说:化学平衡的化学平衡的移动移动能能削弱削弱压强改变给可压强改变给可逆反应所
16、带来的逆反应所带来的影响影响,但并,但并不能完全抵消不能完全抵消。练习:练习:下列反应达到化学平衡时,增大压强,下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?平衡是否移动?向哪个方向移动?2NO(g)+O2(g)2NO2(g)H2O(g)+CO(g)CO2(g)+H2(g)H2O(g)+C(s)CO(g)+H2(g)CaCO3(s)CaO(s)+CO2(g)H2S(g)H2(g)+S(s)正向移动正向移动不移动不移动逆向移动逆向移动逆向移动逆向移动不移动不移动2NO2(气气)N2O4(气气)H=-56.9kJ/mol(红棕色红棕色)(无色无色)NO2浓度增大浓度增大 NO2浓
17、度减小浓度减小 混合物混合物受热受热时颜色时颜色()混合物混合物遇冷遇冷时颜色时颜色()现象分析:现象分析:加深加深变浅变浅平衡向平衡向逆逆 反应方向移动反应方向移动平衡向平衡向正正 反应方向移动反应方向移动(吸热)(吸热)(放热)(放热)3、温度对化学平衡的影响(温度对化学平衡的影响(视频视频)25特选课堂温度对化学平衡的影响温度对化学平衡的影响规律规律:在其它条件不变的情况下:在其它条件不变的情况下:温度升高,会使化学平衡向着吸热反应的方向移动;温度升高,会使化学平衡向着吸热反应的方向移动;温度降低,会使化学平衡向着放热反应的方向移动。温度降低,会使化学平衡向着放热反应的方向移动。26特选
18、课堂mA(g)+nB(g)pC(g)+qD(g);H0升温升温27特选课堂VmA(g)+nB(g)pC(g)+qD(g);H0mA(g)+nB(g)pC(g)+qD(g);H0降温降温练习:练习:28特选课堂V(正正)降温降温mA(g)+nB(g)pC(g)+qD(g);H0(练习)(练习)升温升温29特选课堂温度改变速率速率-时时间关系图间关系图思考思考9:由以上四图还可以得出什么结论:由以上四图还可以得出什么结论:1)新旧平衡速率比较:)新旧平衡速率比较:升高温度,升高温度,新平衡速率新平衡速率大于大于旧平衡速率旧平衡速率 降低温度,降低温度,新平衡速率新平衡速率小于小于旧平衡速率旧平衡速
19、率2)改变温度)改变温度瞬间瞬间:升温升温,V正正,V逆逆都增大都增大;降降温温,V正正,V逆逆都减小都减小总的来说:总的来说:化学平衡的化学平衡的移动移动能能削弱削弱温度改变给可温度改变给可逆反应所带来的逆反应所带来的影响影响,但并,但并不能完全抵消不能完全抵消。30特选课堂4、催化剂对于化学平衡的影响催化剂对于化学平衡的影响请用请用v-t图图来表示催化剂对化学平衡的影响来表示催化剂对化学平衡的影响加入正加入正催化剂催化剂vtV V正正V V逆逆加入负加入负催化剂催化剂vtV正V逆V V正正 V V逆逆=V正 V逆=31特选课堂加入加入(正)催化剂(正)催化剂能能同等程度同等程度的的加快加快
20、反应反应速率速率,所以,所以平衡不移动平衡不移动,但能,但能缩缩短短达到平衡的达到平衡的时间时间。规律:规律:32特选课堂v平衡移动原理平衡移动原理勒夏特列原理勒夏特列原理 如果改变如果改变影响影响平衡的平衡的一个条件一个条件(如浓度、温度、(如浓度、温度、或压强等),平衡就向能够或压强等),平衡就向能够减弱这种改变减弱这种改变的方向移的方向移动。动。注意:注意:是是“减弱减弱”这种改变,不是这种改变,不是“消除消除”这种改变这种改变只有只有单个条件改变单个条件改变,才能应用,才能应用勒沙特列原理适用于任何勒沙特列原理适用于任何动态动态平衡平衡体系体系(如:溶解(如:溶解平衡、电离平衡等),平
21、衡、电离平衡等),未平衡状态未平衡状态不能用此来分析。不能用此来分析。5,勒夏特列原理,勒夏特列原理(P28第第2段段)33特选课堂改变影响平衡的一个条件改变影响平衡的一个条件化学平衡移动方向化学平衡移动方向化学平衡移动结果化学平衡移动结果浓度浓度增大增大反应物浓度反应物浓度向向正反应方向正反应方向移动移动反应物浓度反应物浓度减小减小减小减小反应物浓度反应物浓度向向逆反应方向逆反应方向移动移动反应物浓度反应物浓度增大增大增大增大生成物浓度生成物浓度向向逆反应方向逆反应方向移动移动生成物浓度生成物浓度减小减小减小减小生成物浓度生成物浓度向向正反应方向正反应方向移动移动生成物浓度生成物浓度增大增大
22、压强压强增大增大体系压强体系压强向向气体体积减小气体体积减小的反的反应方向移动应方向移动体系压强体系压强减小减小减小减小体系压强体系压强向向气体体积增大气体体积增大的反的反应方向移动应方向移动体系压强体系压强增大增大温度温度升高升高温度温度向向吸热反应方向吸热反应方向移动移动体系温度体系温度降低降低降低降低温度温度向向放热反应方向放热反应方向移动移动体系温度体系温度升高升高催化剂催化剂 由于使用催化剂对正反应速率与逆反应速率影响的幅度是等由于使用催化剂对正反应速率与逆反应速率影响的幅度是等同的,所以平衡不移动。但应注意,虽然同的,所以平衡不移动。但应注意,虽然催化剂不使化学平催化剂不使化学平衡
23、移动,但使用催化剂可影响可逆反应达平衡的时间衡移动,但使用催化剂可影响可逆反应达平衡的时间。影响化学平衡的条件小结影响化学平衡的条件小结 34特选课堂巩固练习:巩固练习:1在高温下,反应在高温下,反应要使混合气体颜色加深,可采取的方法是要使混合气体颜色加深,可采取的方法是()A、保持容积不变、保持容积不变,加入加入HBr(g)B、降低温度、降低温度C、升高温度、升高温度D、保持容积不变、保持容积不变,加入加入H2(g)A C 2HBr(g)H2(g)+Br2(g)H0035特选课堂2在一定温度下的密闭容器中发生反应在一定温度下的密闭容器中发生反应:H2(g)+I2(g)2HI(g)H0 pB、
24、A 的转化率降低的转化率降低C、平衡向正反应方向移动、平衡向正反应方向移动D、C的体积分数增加的体积分数增加B V正vtV正V逆V逆V正=V逆4、有反应、有反应 aA+bB cC +dD 其中反应其中反应物与生成物均为气体,达到平衡后其他条件不物与生成物均为气体,达到平衡后其他条件不变,改变压强,则下图适合哪种情况(变,改变压强,则下图适合哪种情况()A、a+bc+d,加压加压C、a+bc+d,减压减压B练习练习5、下列不能用勒夏特列原理解释的是、下列不能用勒夏特列原理解释的是()棕红色棕红色NO2加压后颜色先变深后变浅加压后颜色先变深后变浅 Fe(SCN)3溶液中加入固体溶液中加入固体KSC
25、N后颜色变深后颜色变深 氯水宜保存在低温、避光条件下氯水宜保存在低温、避光条件下 SO2催化氧化成催化氧化成SO3的反应,往往加入过量的空气的反应,往往加入过量的空气 打开易拉罐有大量气泡冒出打开易拉罐有大量气泡冒出 加催化剂加催化剂,使氮气和氢气在一定条件下转化为氨气使氮气和氢气在一定条件下转化为氨气作业作业:优化方案和课后达标检测优化方案和课后达标检测1 1、某一温度下,在一带有活塞的体积可变的密、某一温度下,在一带有活塞的体积可变的密闭容器中,可逆反应:闭容器中,可逆反应:N N2 2+3H+3H2 2=2NH=2NH3 3达到平衡,达到平衡,若向活塞施加一定的压力,使容器体积减小,则若
26、向活塞施加一定的压力,使容器体积减小,则下列叙述正确的是下列叙述正确的是()();若保持该容器的体;若保持该容器的体积不变,向该平衡体系中充入氩气,则下列叙述积不变,向该平衡体系中充入氩气,则下列叙述正确的是正确的是()()DEBCA.A.正正增大、增大、逆逆减少减少B.B.正正、逆逆均不变均不变D.D.平衡向右移动平衡向右移动E.E.正正、逆逆均增大均增大C.C.平衡不发生移动平衡不发生移动 【综合练习】【综合练习】43特选课堂2NO2 N2O4 +Q1、已知、已知NO2能形成二聚分子能形成二聚分子现在要测定现在要测定NO2的相对分子质量,应采用的适的相对分子质量,应采用的适宜条件为(宜条件
27、为()A、高温低压、高温低压 B、低温高压、低温高压C、低温低压、低温低压 D、高温高压、高温高压A44特选课堂3、反应、反应 2A 2B +E-Q达到平衡时,达到平衡时,要使正反应速率下降,要使正反应速率下降,A的浓度增大,应采用的的浓度增大,应采用的措施是(措施是()A、加压、加压 B、减压、减压C、减小、减小E的浓度的浓度 D、降温、降温D45特选课堂5、某一温度下,在一带有活塞的体积可变的、某一温度下,在一带有活塞的体积可变的密闭容器中,可逆反应:密闭容器中,可逆反应:N2+3H2 2NH3达到达到平衡,若向活塞施加一定的压力,使容器体积平衡,若向活塞施加一定的压力,使容器体积减小,则
28、下列叙述正确的是减小,则下列叙述正确的是();若保持该;若保持该容器的体积不变,向该平衡体系中充入氩气,容器的体积不变,向该平衡体系中充入氩气,则下列叙述正确的是则下列叙述正确的是()DEBCA.正正增大、增大、逆逆减少减少B.正正、逆逆均不变均不变D.平衡向右移动平衡向右移动E.正正、逆逆均增大均增大C.平衡不发生移动平衡不发生移动 46特选课堂6 6、对某一可逆反应来说,使用催化剂的、对某一可逆反应来说,使用催化剂的作用是作用是()()A.A.提高反应物的平衡转化率提高反应物的平衡转化率B.B.以同样程度改变正逆反应的速率以同样程度改变正逆反应的速率C.C.增大正反应速率,降低逆反应速率增
29、大正反应速率,降低逆反应速率D.D.改变平衡混合物的组成改变平衡混合物的组成B47特选课堂7.已建立化学平衡的某可逆反应,当改变条件已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关使化学平衡向正反应方向移动时,下列有关叙述正确的是叙述正确的是 生成物的百分含量一定增加生成物的百分含量一定增加 生成物的产生成物的产量一定增加量一定增加 反应物的转化率一定增大反应物的转化率一定增大 反反应物浓度一定降低应物浓度一定降低 正反应速率一定大于逆正反应速率一定大于逆反应速率反应速率 使用了合适的催化剂使用了合适的催化剂 A、B、C、D、B48特选课堂8.恒温下恒温下,反应反应
30、aX(g)bY(g)+cZ(g)达到达到平衡后平衡后,把容器体积压缩到原来的一半且达把容器体积压缩到原来的一半且达到新平衡时到新平衡时,X的物质的量浓度由的物质的量浓度由0.1mol/L增大到增大到0.19mol/L,下列判断正确的是下列判断正确的是:A.ab+c B.ab+c C.ab+c D.ab=c A49特选课堂9、容积固定的密闭容器中存在已达平衡的、容积固定的密闭容器中存在已达平衡的可逆反应可逆反应2A(g)2B+C(H0),若,若随着温度升高,气体平均相对分子质量减小,随着温度升高,气体平均相对分子质量减小,则下列判断正确的是(则下列判断正确的是()A、B和和C可能都是液体可能都是
31、液体B、B和和C肯定都是气体肯定都是气体C、B和和C可能都是固体可能都是固体D、若、若C为固体,则为固体,则B一定是气体一定是气体D50特选课堂51特选课堂思考:化学平衡的移动能完全抵消浓度改变化学平衡的移动能完全抵消浓度改变给可逆反应所带来的影响吗?给可逆反应所带来的影响吗?总的来说:化学平衡的移动能削弱浓度改总的来说:化学平衡的移动能削弱浓度改变给可逆反应所带来的影响,但并不能完变给可逆反应所带来的影响,但并不能完全抵消。全抵消。随堂练习随堂练习已知在氨水中存在下列平衡:已知在氨水中存在下列平衡:NH3 +H2O NH3 H2O NH4+OH-(1)、向氨水中加入、向氨水中加入MgCl2固体,平衡向固体,平衡向 移动,移动,OH-浓度浓度 ,NH4+浓度浓度 。(2)、向氨水中加入浓盐酸,平衡向、向氨水中加入浓盐酸,平衡向 移动,移动,此时溶液中浓度减小的粒子有此时溶液中浓度减小的粒子有 。(3)、向氨水中加入少量、向氨水中加入少量NaOH固体,固体,平衡向平衡向 移动,移动,此时发生的现象是此时发生的现象是 。正反应方向正反应方向减小减小增大增大正反应方向正反应方向OH-、NH3H2O、NH3逆反应方向逆反应方向有气体放出有气体放出
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 高中物理-第3章-专题-弹力摩擦力综合问题及物体的受力分析ppt课件-新人教版必修1
- 高中英语外研版选修六ppt课件:Module+2+Section+Ⅰ+Introduction+&+Reading+—+Pre-reading
- 高中英语外研版必修三ppt课件:Module+4+Section+Ⅴ+Writing—+环保类作文
- 高中英语必修4-Unit-2-Working-the-landppt课件
- 《高等石油地质》复习资料--课件
- 高中英语人教选修6ppt课件:Unit-3-Section-Ⅱ
- 高中信息技术基础《初识冒泡排序》优质课教学ppt课件
- 高中议论文语段训练修改ppt课件
- 高中英语必修五人教版ppt课件:Unit-3-Period-Three
- 党课ppt课件信仰的力量精编版
- 蔬果变变变课件
- 中央空调系统构成和设备配置课件
- 促进身心健康课件-人教课标版
- 传出神经系统药理---课件
- 一年级数学10的分与合课件
