 基础化学:第4章缓冲溶液
基础化学:第4章缓冲溶液


《基础化学:第4章缓冲溶液》由会员分享,可在线阅读,更多相关《基础化学:第4章缓冲溶液(42页珍藏版)》请在装配图网上搜索。
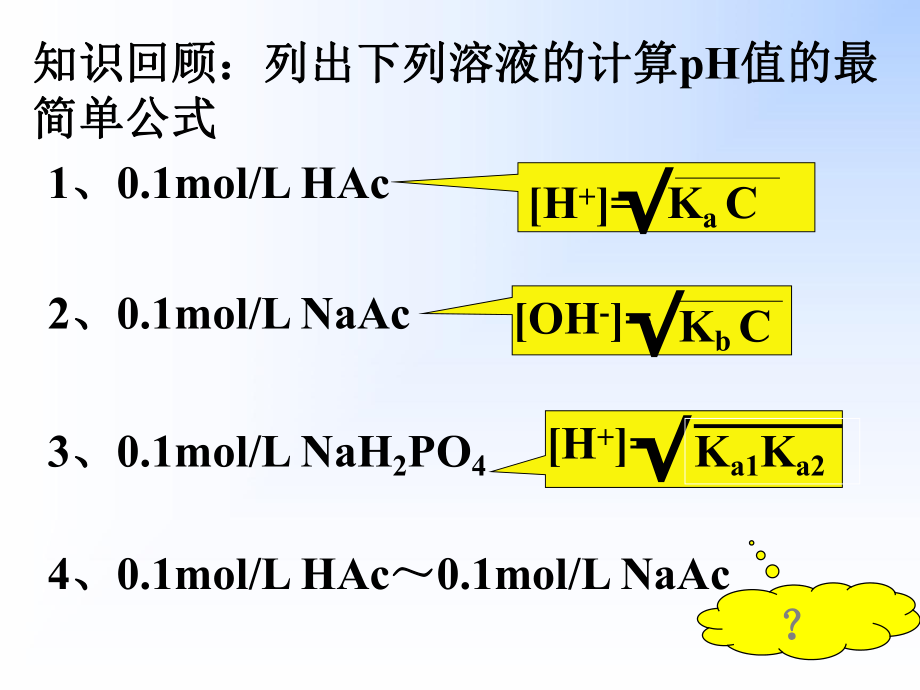
1、1知识回顾:列出下列溶液的计算知识回顾:列出下列溶液的计算pH值的最值的最简单公式简单公式1、0.1mol/L HAc2、0.1mol/L NaAc3、0.1mol/L NaH2PO44、0.1mol/L HAc0.1mol/L NaAcH+=Ka COH-=Kb CH+=Ka1Ka2?2第四章第四章 缓冲溶液缓冲溶液 Chapter4 Buffer Solution本章主要内容:本章主要内容:计划课时:计划课时:33重点:重点:缓冲溶液的组成及有关计算,缓冲溶液的组成及有关计算,缓冲溶液的配制原则和方法。缓冲溶液的配制原则和方法。难点:难点:缓冲溶液缓冲溶液pH计算,缓冲溶液的配制。计算,缓
2、冲溶液的配制。教材习题教材习题p61-63:3.4.5.6.7.12.4第一节第一节 缓冲溶液及其缓冲机制缓冲溶液及其缓冲机制一、缓冲溶液的缓冲作用少量少量NaOH1LNaCl1LNaCl溶液溶液 酚酞酚酞少量少量NaOH1LHAc-NaAc1LHAc-NaAc溶液溶液酚酞酚酞(一一)缓冲溶液的概念缓冲溶液的概念5缓冲作用缓冲作用buffer action-缓冲溶液缓冲溶液对强酸、对强酸、强碱或稀释的抵抗作用。强碱或稀释的抵抗作用。缓冲溶液缓冲溶液buffer solution-当加入当加入少量少量的的强酸、强碱强酸、强碱或或稍加稀释稍加稀释时,时,能保持其能保持其pH值基本不变值基本不变的溶
3、液。的溶液。较浓的强酸、强碱也具有缓冲作用较浓的强酸、强碱也具有缓冲作用*,但实际上很少作为缓冲溶液使用。但实际上很少作为缓冲溶液使用。61、加入少量HClHAc+H2OH3O+Ac-NaAc Na+Ac-少量少量H+平衡向左移动平衡向左移动共轭碱是抗酸成分共轭碱是抗酸成分较多较多H3O+浓度没有明显升高浓度没有明显升高(二二)缓冲机制72、加入少量、加入少量NaOHHAc+H2OH3O+Ac-NaAc Na+Ac-少量少量OH-平衡向右移动平衡向右移动共轭酸是抗碱成分共轭酸是抗碱成分较多较多H3O+浓度没有明显降低浓度没有明显降低思考:思考:1L 0.11L 0.1mol/LHAcHAc溶液
4、是否具有缓冲作用?溶液是否具有缓冲作用?8缓冲作用的实质:缓冲作用的实质:由于缓冲溶液中同时含有较由于缓冲溶液中同时含有较大量大量的弱的弱酸酸(抗碱成分抗碱成分)和共轭碱和共轭碱(抗酸成分抗酸成分),通过,通过共轭酸碱对之间质子转移平衡的移动以达共轭酸碱对之间质子转移平衡的移动以达到消耗掉外来的到消耗掉外来的少量少量强酸强酸、强碱强碱,或对抗,或对抗稍加稍加稀释稀释的作用,使溶液的的作用,使溶液的H+离子或离子或OH-离子浓度没有明显的变化。离子浓度没有明显的变化。但缓冲溶液的缓冲作用不是无限的。但缓冲溶液的缓冲作用不是无限的。9共轭酸共轭酸共轭碱共轭碱HAcNH4ClH2PO4-NaAcNH
5、3HPO42-2-抗酸成分抗酸成分缓冲对缓冲对(缓冲系)(缓冲系)抗碱成分抗碱成分二、缓冲溶液的组成缓冲溶液的组成缓冲溶液一般由缓冲溶液一般由足够浓度足够浓度的共轭酸碱对组成。的共轭酸碱对组成。一些常见的缓冲系列在一些常见的缓冲系列在P52P52表表4-1中中10HAc+H2OAc-+H3O+第二节:缓冲溶液的第二节:缓冲溶液的pH值计算值计算一、缓冲溶液pH值的计算公式亨亨-哈哈 H+C HAc-H+C HAc C Ac-+H+C Ac-平衡平衡H+=KaAc-HAcKa=H+HAcAc-C HAcC Ac-初始初始0已解离已解离C解离解离CAc-H+=H+=H+11pH=pKa+lgAc-
6、HAc(1)AcAcAcAcAcAc12共轭酸共轭碱lgppH+=aKpH=pKa+lgc(Ac-)c(HAc)(2)pH=pKa+lgn(Ac-)n(HAc)(3)混合后混合后混合后混合后13例 1:0.300mol/L氨水和0.300mol/LHCl等体积混合,计算溶液pH值。(pKb=4.75)解:解:NH3+HClNH4Cl反应前物反应前物质的量质的量0.300 V0 0.300 V0 反应后反应后0.300 V0 00一元酸一元酸NH4Cl的浓度的浓度:0.300 V0/2 V0=0.150 二、计算实例H+=Ka C14例 2:0.300mol/L氨水和0.100mol/LHCl等
7、体积混合,计算溶液pH值。(pKb=4.75)解:解:设设 NH3、HCl原体积为原体积为V0 mlNH3+HClNH4Cl反应前反应前反应后反应后0.300 V0 0.100 V0 0.100 V0 00.200 V0缓冲对:缓冲对:NH4Cl NH3不过量不过量15pKa=14.00-pKbpH=pKa+lgn(B-)n(HB)=14.00-4.75+lg0.200 V00.100 V0=9.55计算缓冲溶液计算缓冲溶液pH值的步骤:值的步骤:1、找出、找出HB-B-,Ka 2、计算、计算n(HB)n(B-)或或c(HB)c(B-)16例4-2 柠檬酸citric acid(H3Cit)及
8、其盐是一种供细菌培养的常用缓冲体系。用0.100mol/L NaH2Cit溶液与0.050mol/L NaOH溶液等体积混合,求缓冲溶液pH值。pKa1=3.13,pKa2=4.76,pKa3=6.40.解:解:NaH2Cit+NaOH反应前反应前 0.100 V 0.050 V 反应后反应后0.050 V 00.050 VNa2HCitpH=pKa+lgn(B-)n(HB)=4.7617缓冲体系缓冲体系 HAc-NaAcHCl缓冲体系缓冲体系 HAc-NaAcNaAc减少减少NaAc近于耗尽近于耗尽缓冲体系缓冲体系 HAc-NaAcHAc-NaAcNaAc更更少少第三节:缓冲容量第三节:缓冲
9、容量18使单位体积(1L或1ml)缓冲溶液的pH值改变一个单位时,所能加一元强酸或一元强碱的物质的量(mol或mmol)。一、缓冲容量(buffer capacity)思考题:思考题:0.001mol/LHAc0.001mol/L NaAc是否还具有缓冲作用?是否还具有缓冲作用?19物质的量物质的量dndndpHdpHVdef愈大,缓冲能力愈大。愈大,缓冲能力愈大。2 mmolNaOH4 mmolNaOHpH:34pH:34A AB B缓冲能力:缓冲能力:缓冲容量:缓冲容量:ABBA20二、影响缓冲容量的因素缓冲比缓冲比总浓度总浓度c(B-)c(HB)n(B-)n(HB)或C总总=HB+B-1
10、、缓冲比的影响(C总一定)c(B-)c(HB)=1,pH=pKa,极大极大=0.576=0.576C总总2.303(B-/c总总)()(HB/c总总)c总总210.1110pKa-1pKapKa+1c(B-)c(HB)pH极大极大0.1mol/LHAc+NaOH22 0.1c(B-)c(HB)10,pKa-1 较大,具有缓冲作用较大,具有缓冲作用.缓冲范围具有缓冲作用的缓冲范围具有缓冲作用的pH值范围。值范围。缓冲范围缓冲范围(buffer effective range):pH=pKa1,2个个pH单位单位pH pKa+1,23缓冲系不同,各弱酸的缓冲系不同,各弱酸的pKa不同,则不同,则缓
11、冲范围不同。缓冲范围不同。例:计算例:计算H2PO4-HPO42-的缓冲范围的缓冲范围(H3PO4:pKa1=2.12,pKa2=7.21,pKa3=12.67)解:缓冲范围:解:缓冲范围:6.218.21例:计算例:计算NH4ClNH3的缓冲范围的缓冲范围 pK(NH3)=4.75解:缓冲范围:解:缓冲范围:8.2510.25242、C总总的影响的影响(c(B-)c(HB)一定一定)C总总=HB+B-c(B-)c(HB)当当一定,一定,C总总愈大,愈大,愈大。愈大。混合后25pH0.1mol/LHAc+NaOH0.2mol/LHAc+NaOH113缓冲比相同缓冲比相同强酸、强酸、强碱亦强碱亦
12、具有缓具有缓冲作用冲作用HClNaOHC总总:0.05mol/L0.05mol/LKH2PO4+NaOH26问:胃液问:胃液pH=1.2,人喝少量人喝少量HAc后胃液后胃液pH会否改变?会否改变?小结:判断是否缓冲溶液的条件小结:判断是否缓冲溶液的条件:0.1c(B-)c(HB)10,0.05mol/LC总总:27第四节:缓冲溶液的配制第四节:缓冲溶液的配制 一、缓冲溶液的配制方法1.选择适当的缓冲系,选择适当的缓冲系,pH值尽量接近值尽量接近pKa。2.C总总较大较大(0.05-0.20mol/L)。3.计算所需缓冲系的量计算所需缓冲系的量4.校正校正 弱酸弱酸+强碱:强碱:HAc(过量)过
13、量)+NaOH H3PO4 +NaOH弱碱弱碱+强酸:强酸:NH3 H2O(过量)过量)+HCl等等 28例例4-4:配制配制pH 值为值为4.50的缓冲溶液的缓冲溶液1000ml?解解:1.选择缓冲系,选择缓冲系,HAc-NaAc2.C总,总,0.1mol/LHAc-0.1mol/LNaAcpH=pKa+lgn(B-)n(HB)0.1V0.1(1000-V)4.504.75=+lgVAc-=V=360mlVHAc=1000-V=640ml29 适用于生理学要求的缓冲溶液pH在69之间,基本符合生理、生化要基本符合生理、生化要求的缓冲系是三(羟甲求的缓冲系是三(羟甲基)甲胺及其盐酸盐。基)甲胺
14、及其盐酸盐。TrisTrisHCl在医学上广泛使用的缓冲溶液的配方列在医学上广泛使用的缓冲溶液的配方列于于p58表表4-2和表和表4-3,以便参考使用。,以便参考使用。二、标准缓冲溶液-常用于pH计校正(自学)(自学)30血浆中:H2CO3HCO3-、H2PO4-HPO42-、HnPHn-1P-(HnP代表蛋白质)第五节第五节 血液中的缓冲系血液中的缓冲系红细胞中:H2bHb-(血红蛋白)、H2bO2HbO2-(氧合血红蛋白)、H2CO3HCO3-、H2PO4-HPO42-311.缓冲对:缓冲对:CO2(溶解溶解)NaHCO33.pKa1=6.10 pH=pKa +lgHCO3-CO2(溶解溶
15、解)=6.10+lg20=7.40H2CO3HCO3-碳酸缓冲体系2.HCO3-CO2(溶解溶解)24mmol*L-1=201.2mmol*L-1=32+OH-+H+H2CO3HCO3-+H+CO2+H2O肺肺肾肾在体内(在体内(敞开系统敞开系统),HCO3-是血浆中含量是血浆中含量最多的抗酸成分最多的抗酸成分,将血浆中的将血浆中的HCO3-称称为为碱储碱储。思考:碳酸缓冲体系缓冲比思考:碳酸缓冲体系缓冲比20,超出有效缓超出有效缓冲范围,为什么还能起缓冲作用?冲范围,为什么还能起缓冲作用?33本章小结:本章小结:1、缓冲溶液组成:共轭共轭酸酸抗抗碱碱成分成分共轭共轭碱碱抗抗酸酸成分成分2、p
16、H=pKa+lgn(B-)n(HB)找出找出计算计算3、缓冲容量、缓冲容量:C总总与缓冲比与缓冲比缓冲对缓冲对,Ka;n(B-),n(HB)34在在100ml 0.100mol/LNaH2PO4和和50.0ml0.100 mol/L NaOH混合溶液中,抗酸混合溶液中,抗酸成分是成分是,抗碱成分是,抗碱成分是解:解:H2PO4+OH0.100 x100=10mmol0.100 x50=5mmol50过量过量HPO42-+H2O5反应前反应前反应后反应后HPO42-H2PO4 补充练习:(一)填空题35在在100ml 0.25mol/LNaH2PO4 0.20mol/LNa2HPO4缓冲溶液中加
17、入缓冲溶液中加入0.4gNaOH,计算溶液的,计算溶液的pH值。值。解:解:c(OH-)=0.4/40.00.100=0.10(mol/L)(二)计算题36HPO4 2+OH-过量过量H2PO4-0.25反应前反应前0.200.100.20+0.10=0.300反应后反应后0.25-0.10=0.15pH=pKa2+lgc(B-)c(HB)=7.21+lg0.300.15=7.5137问:若使某溶液的问:若使某溶液的pH值保持在值保持在7.0,能否用能否用HAcNaAc作为缓冲溶液?作为缓冲溶液?(pKa=4.75),为什么为什么?缓冲范围:缓冲范围:3.755.75,不能用,不能用HAcNa
18、Ac作为缓冲溶液。作为缓冲溶液。(三)简答题381、下列各组等体积混合液中,无缓冲、下列各组等体积混合液中,无缓冲作用的是作用的是A 0.2mol/L HCl和和0.2mol/L KClD 0.2mol/L HCl和和0.2mol/L NH3C 0.2mol/L NaH2PO4和和0.1mol/L HClB 0.2mol/L NaOH和和0.2mol/L HAc0.1mol/L HCl0.1mol/LNaAc0.05mol/L H3PO4 0.05mol/L NaH2PO40.1mol/L NH4Cl(四)选择题392、下列各缓冲溶液中缓冲容量最大的是、下列各缓冲溶液中缓冲容量最大的是A 80
19、0ml中含有中含有0.1mol HAc和和0.1mol NaAcB 1000ml中含有中含有0.1mol HAc和和0.1mol NaAcC 500ml中含有中含有0.04mol HAc和和0.06mol NaAcD 600ml中含有中含有0.04mol HAc和和0.06mol NaAc403、欲配制、欲配制pH=9.0的缓冲溶液,最好选的缓冲溶液,最好选用下列缓冲系中的用下列缓冲系中的A、邻苯二甲酸(、邻苯二甲酸(pKa1=2.89,pKa2=5.51)B、甲胺盐酸盐(、甲胺盐酸盐(pKa=10.63)C、甲酸(、甲酸(pKa=3.75)D、氨水(、氨水(pKb=4.75)pKa=9.25414、某缓冲溶液共轭碱的、某缓冲溶液共轭碱的Kb=1.0 x10-6,从从理论推算该缓冲溶液的缓冲范围的理论推算该缓冲溶液的缓冲范围的pH是是A、68B、57C、79D、4642第十二章第十二章 酸酸 碱碱 滴滴 定定 法法-预习提预习提纲纲1、强碱滴定强酸的原理是什么?如何、强碱滴定强酸的原理是什么?如何 选择指示剂?选择指示剂?2、分析过程中一般存在什么误差?、分析过程中一般存在什么误差?如何衡量分析结果的准确度和精密度?如何衡量分析结果的准确度和精密度?
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
