 北京航空航天大学物理化学第六章电化学.ppt
北京航空航天大学物理化学第六章电化学.ppt


《北京航空航天大学物理化学第六章电化学.ppt》由会员分享,可在线阅读,更多相关《北京航空航天大学物理化学第六章电化学.ppt(70页珍藏版)》请在装配图网上搜索。
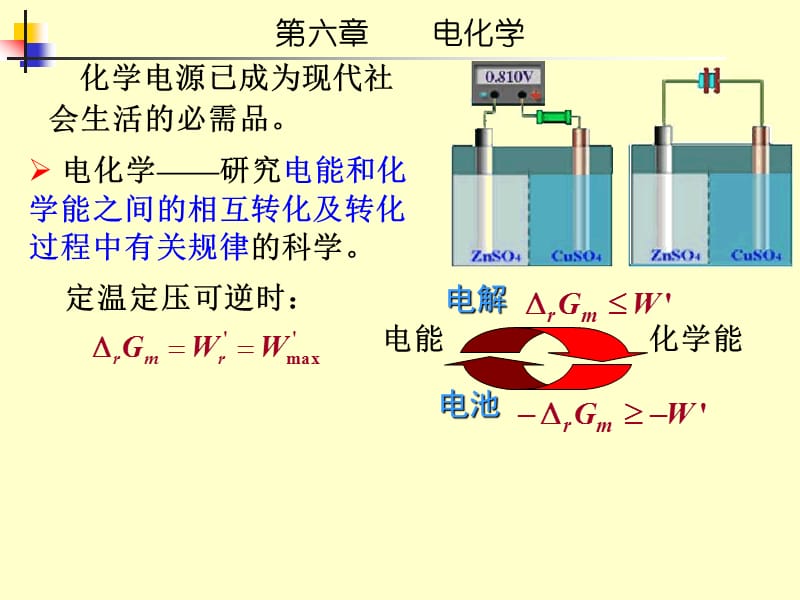
1、第六章 电化学,化学电源已成为现代社会生活的必需品。,电池,电解,电化学研究电能和化学能之间的相互转化及转化过程中有关规律的科学。,定温定压可逆时:,电化学的研究意义,1、电解:精炼和冶炼有色金属和稀有金属; 电解法制备化工原料; 电镀法保护和美化金属; 还有氧化着色等。 2、电池: 汽车、宇宙飞船、照明、通讯、生物化学、 和医学等方面都要用不同类型的化学电源。 3、电分析,第六章 电化学,第六章 电化学,本章学习要求:,了解电解质溶液的导电机理;理解电解质溶液活度、离子平均活度及活度系数的概念; 理解可逆电池电动势与热力学函数的关系;掌握Nernst方程及其计算;掌握各种类型电极的特征和电动
2、势测定的主要应用。 理解产生电极极化的原因和超电势的概念;了解极化曲线及意义。,习题(下册P46-51):7-1,7-17, 7-19,7-20,7-21, 7-28,7-30,7-34,7-38,7-39,7-40,第六章 电化学,本章内容 6-1 化学电池导电机理和法拉第定律 6-2 强电解质溶液的活度及活度系数 6-3 可逆电池热力学 6-4 电极电势 6-5 液体接界电势和浓差电池 6-6 电池电动势和电极电势的应用 6-7 不可逆电极过程和电极的极化,6-1 化学电池导电机理和法拉第定律,原电池 烧杯中的氧化还原反应:化学能转换为热能。 Zn (s) 2H (aq) Zn2 (aq)
3、 H2 (g) 将该反应的氧化和还原两个半反应,分别于两容器控制进行的电池装置,化学能转换为电能,如示意图。,产生于回路的电流: 电极及导线中的电子迁移; 溶液中的离子迁移; 电极溶液界面的氧化还原反应。,第一类导体,又称电子导体,如金属、石墨等。 自由电子作定向移动而导电,导电总量全部由电子承担 导电过程中导体本身不发生变化 温度升高,电阻也升高,两类导体,6-1 化学电池导电机理和法拉第定律,第二类导体,又称离子导体,如电解质溶液、熔融电解质等。 正、负离子移动而导电,导电总量分别由正、负离子分担 导电过程中界面发生化学反应 温度升高,电阻下降,*固体电解质,如 等,也属于离子导体,但它导
4、电的机理比较复杂,导电能力不高,本章以讨论电解质水溶液为主。,两类导体,6-1 化学电池导电机理和法拉第定律,返回5,电极和电池反应 锌电极:Zn(s)Zn2(aq)2e 为氧化反应,是阳极、负极; 氢电极: 2H(aq)2eH2(g) 为还原反应,是阴极、正极; 电池反应: Zn(s) 2H(aq) Zn2(aq) H2(g),将正极用Cu 板及CuSO4溶液替代,得到铜锌原电池(丹尼尔电池):,电池反应: Zn(s)Cu2(aq) Zn2(aq) Cu (s),6-1 化学电池导电机理和法拉第定律,法拉第定律:在电极界面上发生化学变化物质的质量与通入的电量成正比。,6-1 化学电池导电机理
5、和法拉第定律,(6-1-1),F法拉第常数 m电极上发生反应的物质的质量,z为得失电子数 。若通入的电量为 Q,电极上发生反应的进度为,则有:,法拉第常数在数值上等于1 mol电子的电量。已知电子电量为1.602210-19 C,法拉第定律,6-1 化学电池导电机理和法拉第定律,例6-1-1、通电于Au(NO3)3溶液,电流强度I=0.025A,析出Au的质量为1.20 g,已知M(Au)=197.0 gmol-1。 求: 通入电量Q; 通电时间t; 阳极上放出氧气的物质的量。,法拉第定律,6-1 化学电池导电机理和法拉第定律,6-1 化学电池导电机理和法拉第定律,例6-1-1、 通入电量Q,
6、 通电时间t:, 阳极上放出氧气的物质的量,6-2 强电解质溶液的活度及活度系数,一、离子的平均活度和平均活度系数,对任意价型电解质,bB + bB -bB,定义: 离子平均活度,离子平均活度系数,离子平均质量摩尔浓度,一、离子的平均活度和平均活度系数,(6-2-1),一、离子的平均活度和平均活度系数,例8-1-1:z-z价型电解质 NaCl,ZnSO4,1-2(2-1)价型电解质 Na2SO4,CaCl2,3-2价型电解质 Al2(SO4)3,?,二、离子强度及强电解质溶液的离子互吸理论,离子氛,这是德拜-休克尔理论中的一个重要概念。认为在溶液中,每一个离子都被反号离子所包围,由于正、负离子
7、相互作用,使离子的分布不均匀。,二、离子强度及强电解质溶液的离子互吸理论,式中bB是离子B的真实浓度(若是弱电解质,应乘电离度)。I 的单位:molkg-1,大量实验事实表明,影响离子平均活度系数的主要因素是离子的浓度和价数。1921年,Lewis提出了离子强度的概念,表示离子相互作用的强度。当浓度用质量摩尔浓度表示时,离子强度 I 等于:,(6-2-2),二、离子强度及强电解质溶液的离子互吸理论,德拜-休克尔极限定律,根据离子氛的概念,推导出强电解质稀溶液中离子平均活度系数的计算公式,称为德拜-休克尔极限定律:,A是与温度、溶剂有关的常数,水溶液的A值可查表。如常温下:A=0.509 mol
8、-1/2kg1/2,该式只适用于强电解质的稀溶液(理论值)。可由实验值(P16表7.4.1)对比得到浓度范围。,(6-2-3),z愈高,b愈大,则偏离1愈多,二、离子强度及强电解质溶液的离子互吸理论,解:,6-3 可逆电池热力学,一、组成可逆电池的必要条件,原电池反应: Zn+CuSO4(a1)ZnSO4(a2)+Cu,电解池反应: ZnSO4 (a2) + Cu Zn + CuSO4(a1),充放电过程:E外=E dE,I 0,丹尼尔电池,二、可逆电池电动势的测定对消法,可否用伏特计测量?,应用电位差计测量,目的:使Es.c及Ex与外接反向EW对消,I0; Es.c为标准电池电动势(P22)
9、,标准电池,标准电池总反应: Hg2SO4(s)+Cd(Hg)(a)+8/3H2O CdSO48/3H2O(s)+Hg(l),三、可逆电池热力学,1、,(6-3-1),(6-3-2),(6-3-3),2、E与K及电池电动势的Nernst方程,自发 平衡,三、可逆电池热力学,25时:,(6-3-4),(6-3-5),电池反应:H2(p1)+Cl2(p2)2H+(aH+)+ 2Cl-(aCl-) (1),例:Pt|H2(p1)|HCl(0.1molkg-1)|Cl2(p2)|Pt,2、E与K及电池电动势的Nernst方程,三、可逆电池热力学,?,6-4 电极电势,一、可逆电极的类型,金属与其阳离子
10、组成的电极 气体电极 汞齐电极(金属汞合金金属阳离子),金属-难溶盐及其阴离子组成的电极 金属-氧化物电极及其H+(OH-)组成的电极,氧化-还原电极,第一类电极,第二类电极,第三类电极,Na+(a+)|Na(Hg)(a) Na+(a+)+nHg+e- Na(Hg)n(a),电极 电极反应,Mz+(a+)|M(s)Mz+(a+)+ze- M(s),H+ (a+)|H2(p),Pt2H+(a+)+2e- H2(p),OH-(a-)|H2(p),Pt,H+(a+)|O2(p),Pt,Cl- (a-)|Cl2(p),Pt Cl2(p)+2e- 2Cl-(a-),OH-(a-)|O2(p),Pt O2
11、(p)+2H2O+4e- 4OH-(a-),一、可逆电极的类型第一类电极,2H2O+2e- H2(p)+2OH-(a-),O2(p)+4H+(a+)+4e- 2H2O,电极 电极反应,一、可逆电极的类型第二类电极,Cl-(a-)|AgCl(s)|Ag(s),OH-(a-)|Ag2O|Ag(s),H+(a+)|Ag2O(s)|Ag(s),Cl-(a-)|Hg2Cl2(s)|Hg(s),AgCl(s)+e- Ag(s)+Cl-(a-),Hg2Cl2(s)+2e- 2Hg(s)+2Cl-(a-),Ag2O(s)+H2O+2 e- 2Ag(s)+2OH-(a-),Ag2O+2H+(a+)+2e- 2A
12、g(s)+H2O,电极反应: (-) Cd(Hg)Cd2+Hg(l)+2e- (+)Hg2SO4(s)+2e-2Hg(l)+SO42-,电池反应: Hg2SO4(s)+Cd(Hg)(a)+8/3H2O CdSO48/3H2O(s)+Hg(l),标准电池,一、可逆电极的类型,返回26,电极 电极反应,一、可逆电极的类型第三类电极,Fe3+(a1), Fe2+(a2)|Pt Fe3+(a1)+e- Fe2+(a2),MnO4-(a1), Mn2+(a2)|Pt,醌氢醌电极 Q|H2Q C6H4O2+2H+(a1)+2e- C6H4(OH)2,Sn4+(a1), Sn2+(a2)|Pt Sn4+(a
13、1)+2e- Sn2+(a2),MnO4-(a1)+5e- +8H+ Mn2+(a2)+4H2O,MnO4-(a1), Mn2+(a2),H+|Pt,二、电极电势产生的机理,界面电势差,溶液中的反离子一部分紧密地排在固体表面附近,相距约一、二个离子厚度称为紧密层;,另一部分离子按一定的浓度梯度扩散到本体溶液中,称为扩散层。紧密层和扩散层构成了双电层。 金属表面与溶液本体之间的电势差即为界面电势差。,三、电极电势,1、标准氢电极及氢标还原电极电势,标准氢电极,规定:,电极电势E() 的测量,氢标还原电极电势:,下册,P29表7.7.1,参比电极:氢电极使用不方便,用有确定电极电势的甘汞电极作二级
14、标准电极。如甘汞电极:,三、电极电势,2、电极电势的Nernst方程,三、电极电势,对电极反应有:,如甘汞电极:Hg2Cl2(s)+2e- 2Hg(s)+2Cl-(a-),2、电极电势的Nernst方程,三、电极电势,例:H,MnO4,Mn2 | Pt,MnO4-(a1)+5e- +8H+ Mn2+(a2)+4H2O,注意溶液酸碱性的影响,3、电极电势值的分析(P29表7.7.1),三、电极电势,标准氢电极|给定电极(阴极还原反应),自发 平衡,表中上下:负正,易被氧化易被还原 还原态发生氧化反应(失e)趋势 氧化态发生还原反应(得e)趋势,4,6-5 液体接界电势和浓差电池,一、液体接界电势
15、及其消除,液体接界电势为不可逆电势,盐桥的作用减小液体接界电势,饱和KCl溶液或NH4NO3溶液,二、浓差电池,电极浓差电池(单液),1.,2.,3.,浓差电池的特点:,二、浓差电池,电池净反应不是化学反应,仅仅是某物质从高压到低压或从高浓度向低浓度的迁移。,电池标准电动势,阴离子转移,电解质浓差电池(双液),阳离子转移,1.,2.,6-6 电池电动势和电极电势的应用,一、求反应的,二、判断反应方向 三、求溶液的 pH 四、求难溶盐的溶度积 Ksp 五、求电解质溶液的 a 、 六、求合金中某组分的 a、 七、电势滴定*,测定:,一、 求反应的,测定:,二、判断反应方向,自发 平衡,例6-1:试
16、判断下述反应标态下向哪方进行?并求Fe离子为标态时反应转向的,设计成电池:,正向自发,查表:,三、求溶液的 pH(25),醌氢醌电极,摩尔甘汞电极|醌氢醌|Pt,pH7.1时,E为负值。 pH8.5时,氢醌酸式解离,并易发生氧化。 醌-氢醌为等分子复合物,溶解度很小,用量不可太多。,也可将醌氢醌电极换成玻璃电极,三、求溶液的 pH,玻璃电极:属离子选择电极。 一个特种玻璃制成的玻璃薄膜球,球内装0.1molL-1的HCl溶液,溶液中插入一根Ag-AgCl电极(内参比电极)。,用pH计测量时,E可通过一个已知pH值的溶液加以标定。再将玻璃电极插入待测溶液,即可直接读出pH值。,四、求难溶盐的溶度
17、积 Ksp,例6-2:求25AgCl的Ksp,非氧化还原反应,E?,设计电池:阳极,阴极反应=电池反应阳极反应,得:,AgCl+e-= Ag+Cl-,阴极为 Cl- |AgCl | Ag,电池为 Ag | Ag+ | Cl- |AgCl | Ag,饱和NH4NO3溶液,Ag | Ag+ ; Ag-e-= Ag+,四、求难溶盐的溶度积 Ksp,例6-2:求25AgCl的Ksp,电池为: Ag | Ag+ | Cl- |AgCl | Ag,反应平衡时:G=0;,25,五、求电解质溶液的 a、 ,例6-3:求25b=0.01molkg-1 ZnSO4溶液的a、 ,设计电池: Zn|ZnSO4(, b
18、) |PbSO4(s) | Pb(s),六、求合金中某组分的 a、,例6-4:求335Sn-Bi(xSn=0.80)液态合金中Sn的a、,设计电池: Sn(l)|Sn2+(纯SnCl2熔盐) |Sn-Bi (xSn=0.80),浓差电池,实验测得335时电池的E5.40 mV,则,4,七、电池简介,锌-锰干电池:Zn | ZnCl2,NH4Cl(糊)| MnO2|C 电池反应:,特点:Zn皮不断消耗,MnO2不断被还原,电压降低; 电压约为1.5V; 价廉,一次性消费 应用:日常生活(17号);,镉(或铁)-镍电池(碱性) Cd | KOH(1.191.21gcm-3)| NiO(OH)|C,
19、特点:电压约为1.3V;重量轻、体积小、抗震性好、耐用; 比铅酸电池昂贵; 应用:工业、剃须刀、收录机、计算器等,七、电池简介,电池反应:,锌-锰电池(碱性):Zn | KOH(aq)| MnO2|C,为减少自放电,常加少量汞(Zn表面汞齐化),污染环境,特点:电压约为2.0V(汽车3个串连为6V,1.8V时充电) ; 电压高而稳定、温度范围宽、价廉、耐用; 笨重、抗震性差、易出酸雾; 应用:工业应用广泛(交通、船舶、矿山),约占90;,铅蓄电池: Pb, PbSO4 | H2SO4(1.251.30g/cm-3)| PbSO4,PbO2,电池反应:,七、电池简介,电池反应: 2Zn Ag2O
20、2 2Ag 2ZnO,锌-银电池(钮扣) Zn| KOH(糊,含饱和ZnO)| Ag2O2 |Ag,七、电池简介,锌-汞电池(钮扣) Zn,ZnO| KOH(糊,含饱和ZnO)| HgO|Hg | C,电池反应: Zn HgO Hg ZnO,特点:工作电压稳定,1.34V; 应用:电子表、计算器、助听器、小型医疗仪器等; 缺点:因含汞,废弃电池处理不当会危害环境,七、电池简介,镍氢(MH 贮氢合金,稀土类、钛系类) 电池 Ni-TiH | KOH(c) | NiO(OH)|C,锂铬酸银电池(高氯酸锂的碳酸丙稀脂为电解质) 电池反应:2LiAg2CrO4 Li2CrO4 +2Ag,电池反应:,优
21、点:能量密度高,电压1.2-1.3V;快速充放电; 记忆效应小;环保、无毒;,钮式或圆筒式锂锰电池(非水电解质电池) Li | LiClO4, PC-DME | MnO2 例如:负极是将Li 插于溶有LiClO4的碳酸丙稀脂(PC)与乙二醇二甲醚(DME)的混合物溶剂中;正极为经热处理的电解MnO2,涂膏式或粉末式。 电池反应:LiMnO2MnOOLi 特点:开路电压3.54V,电压稳定; Li的摩尔质量小,比能量较高;非水电解质; 纽扣式、圆柱式、针型、薄膜式(可薄至0.5mm) 应用:携带式电子仪器、小型计算机、电子表、照相机及通信设备、心脏起博器等。,七、电池简介,H22OH2H2O2e
22、,1/2O2H2O 2e 2OH,特点:E为1.23V,实际电压为0.9V; 将燃料燃烧释放的能量,直接转换为电能; 高效,能量利用率达75;无污染; 成本高,目前只用于宇航等特殊场合。,燃料电池,七、电池简介,4,将燃料(H2、CH3OH、NH2NH2等)不断输入负极作为活性物质,将O2或空气输入正极作为氧化剂,产物CO2和H2O不断排出。目前最成功的是H2O2燃料电池。电池反应: H2(g)1/2O2(g)H2O(l),6-7 不可逆电极过程,一、分解电压,使用Pt电极电解H2O,加入中性盐(Na2SO4)用来导电,实验装置如图所示。,逐渐增加外加电压,由安培计G和伏特计V分别测定线路中的
23、电流强度I 和电压E,画出I-E曲线。,外电压很小时,几乎无电流通过,阴、阳极上无H2气和氧气放出。 E增大,电极表面产生氢气和氧气,构成原电池。外加电压须克服该反向电势。,一、分解电压,Pt | H2| Na2SO4(a)| O2 |Pt,H2(g) O2 (g) H2O (l),再增加电压,使I 迅速增加。氢气和氧气的压力增大,呈气泡逸出,反电动势达极大值 Eb,max。 将直线外延至I =0处,得E(分解)值,这是使电解池不断工作所必需外加的最小电压,称为分解电压。,一、分解电压,理论分解电压:使某电解质溶液连续不断发生电解所必须的最小外加电压。在数值上等于该电解池作为可逆电池时的可逆电
24、动势,一、分解电压,实际分解电压:要使电解池顺利地进行连续反应,除了克服作为原电池时的可逆电动势外,还要克服由于极化在阴、阳极上产生的超电势(阴)和(阳) ,及内阻IR,则:,二、电极的极化,实验表明,分解电压的数值会随着通入电流强度的增加而增加。 在有电流通过时,随着电极上电流密度的增加,电极电势值对平衡值的偏离也愈来愈大,这种对平衡电势的偏离称为电极的极化。,电极极化使阴极电势降低,阳极电势升高。即:,二、电极的极化,极化类型:,(1)浓差极化:由离子迁移的迟缓性,即由v(离子迁移)v(电极反应)引起电极附近溶液与体相溶液间产生浓度梯度,引起的电极电势的改变称为浓差极化。,用搅拌和升温的方
25、法可以减少浓差极化,但也可以利用滴汞电极上的浓差极化进行极谱分析。,例:Cu | Cu2+,二、电极的极化,极化类型:,(2)电化学极化:由电极反应的迟缓性,即v(电极反应)v(电子迁移)或某一中间步骤反应速率较慢,而引起的极化现象称为电化学极化。气体电极明显。,例:H2 | H+,为阴极发生还原;为阳极发生氧化,阴极e-过剩,阳极缺e- :,二、电极的极化,(2)电化学极化:塔费尔(Tafel)经验公式: 影响超电势的因素:电极材料、电极表面状态、电流密度、温度、电解质的性质、浓度及溶液中杂质等。 1905年,Tafel 发现,对于一些常见的电极反应,超电势与电流密度之间在一定范围内存在如下
26、的定量关系:,式中 j 是电流密度, a是单位电流密度时的超电势值,与电极材料、表面状态、溶液组成和温度等因素有关; b在常温下一般等于0.050 V。,电解质溶液通常用水作溶剂,在电解过程中, H+在阴极会与金属离子竞争还原。,利用氢在电极上的超电势,可以使比氢活泼的金属先在阴极析出,这在电镀工业上是很重要的。,例如,控制溶液的pH,利用氢气的析出有超电势,才使得镀Zn,Sn,Ni,Cr等工艺成为现实。,二、电极的极化,氢超电势的利用,二、电极的极化,氢超电势的利用,金属在电极上析出时超电势很小,通常可忽略不计。而气体,特别是氢气和氧气,超电势值较大。,氢气在几种电极上的超电势如图所示。可见
27、在石墨和汞等材料上,超电势很大,而在金属Pt,特别是镀了铂黑的铂电极上,超电势很小,所以标准氢电极中的铂电极要镀上铂黑。,二、电极的极化,氢超电势,氢超电势的利用电解产物析出顺序,二、电极的极化,解:条件为,例:25下,电解a=10-2的ZnSO4溶液,某电流密度下H2(g)在Zn阴极上的超电势为0.70 V。求使H2不析出的pH值(设H2析出的 )?,三、发生极化时电解池与原电池的差别,极化曲线:超电势或电极电势与电流密度之间的关系曲线。极化曲线的形状和变化规律反映了电化学过程的动力学特征。,(1)电解池中两电极的极化曲线,负极是阴极,正极是阳极。随着j的增大,两电极上增大,阳极析出电势变大
28、,阴极析出电势变小,外加的电压增加,额外消耗了电能。,(2)原电池中两电极的极化曲线,原电池:负极是阳极,正极是阴极。随着j的增大,两电极上增大,阳极析出电势变大,阴极析出电势变小。原电池的作功能力下降。,利用这种极化可降低金属的电化腐蚀速度。,三、电解池与原电池极化的差别,3,总结:,本章学习要求:,了解电解质溶液的导电机理;掌握电解质溶液活度、离子平均活度及活度系数的概念;了解离子强度的概念和Debye-Heckel极限公式的应用。 理解可逆电池电动势与热力学函数的关系;掌握Nernst方程及其计算;掌握各种类型电极的特征和电动势测定的主要应用。 理解产生电极极化的原因和超电势的概念;了解极化曲线及意义。,习题(下册P46-51):7-1,7-17, 7-19,7-20,7-21, 7-28,7-30,7-34,7-38,7-39,7-40,
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
