 理学06章化学平衡ppt课件
理学06章化学平衡ppt课件


《理学06章化学平衡ppt课件》由会员分享,可在线阅读,更多相关《理学06章化学平衡ppt课件(79页珍藏版)》请在装配图网上搜索。
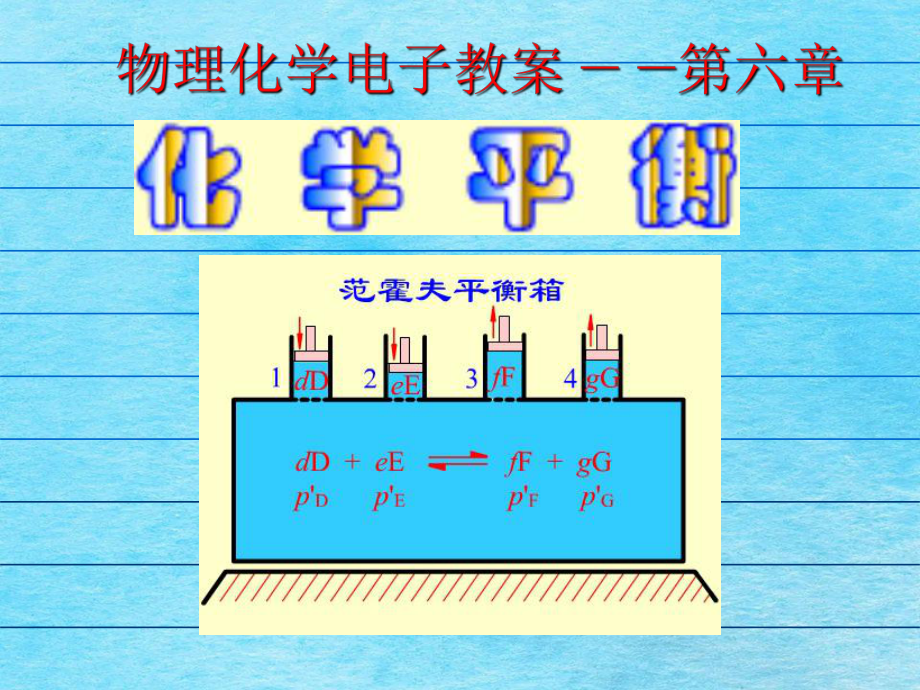
1、 6.1 化学反响的平衡条件 反响进度和化学反响的亲和势6.2 化学反响的平衡常数和等温方程式6.3 平衡常数的表示式6.4 复相化学平衡6.5 规范摩尔生成Gibbs自在能6.6 温度、压力及惰性气体对化学平衡的影响6.8 反响的耦合6.9 近似计算6.7 同时化学平衡 化学反响的亲和势 化学反响的平衡条件和反响进度 的关系化学反响系统:封锁的单相系统,不做非膨胀功,当发生了一个微小变化时,有:BBddddBUT Sp VnBBddddBGS TV pn 引入反响进度的概念BBddnBBdd n根本公式可表示为:BBBddddUT Sp V BBBddddGS TV p 等温、等压条件下,,
2、BBBddT pGn()BBBd,BBBddT pG()BBrmB,T pGG 这两个公式适用条件:1等温、等压、不做非膨胀功的一个化学反响;2反响过程中,各物质的化学势 坚持不变。B用 作判据都是等效的,Brm,B(),()T pBT pGG 或 rm,()0T pG反响自发地向右进展rm,()0T pG反响自发地向左进展rm,()0T pG反响到达平衡BBB0 BBB0 BBB0=用 判别,这相当于 图上曲线的斜率,T pGG,0T pG反响自发向右进展,趋向平衡,0T pG反响自发向左进展,趋向平衡,0T pG反响到达平衡由于是微小变化,反响进度处于01 mol之间。,0T pG,0T
3、pG,0T pG系统的Gibbs自在能和的关系01Ge 严厉讲,反响物与产物处于同一系统的反响都是可逆的,不能进展究竟。只需逆反响与正反响相比小到可以忽略不计的反响,可以粗略地以为可以进展究竟。这主要是由于存在混合Gibbs自在能的缘故。以反响为例,在反响过程中Gibbs自在能随反响过程的变化如下图。DE2FR点,D和E未混合时Gibbs自在能之和;P点,D和E混合后Gibbs自在能之和;T点,反响达平衡时,一切物质的Gibbs自在能之总和,包括混合Gibbs自在能;S点,纯产物F的Gibbs自在能。系统的Gibbs自在能在反响过程中的变化表示图01DnGRPST因D、E混合因生成F后使自在能
4、降低后的自在能降低D、E、F混合 假设要使反响进展究竟,需在vant Hoff 平衡箱中进展,防止反响物之间或反响物与产物之间的任何方式的混合,才可以使反响从R点直接到达S点。1922年,比利时热力学专家De donder首先引进了化学反响亲和势的概念。他定义化学亲和势A为:def ,()T pGArmAG BBB ddddUT Sp VAddddGS TV pA 代入根本公式,得对于普通的化学反响反响正向进展反响达平衡BB0BrBBBm,T pGGA 0A反响逆向进展0AA=0气相反响的平衡常数化学反响的等温方程式液相中反响的平衡常数BBppxBBB(,)()lnpxT pTRTpBBB(,
5、)()lnpT pTRTp对于非理想气体混合物,BBB(,)()lnfT pTRTp混合理想气体中B的化学势表达式为:BBB()lnpTRTp将化学势表示式代入的计算式,得:pTG,mr)(BBB,mr)(pTGBBBBBB()lnfTRTp rmBBB()()GTT 令:Brm,rmBB()()lnT pfGGTRTp 称为化学反响规范摩尔Gibbs 自在能变化值,仅是温度的函数。rm()GTghGHrmdeDrEm(/)(/)()ln(/)(/)fpfpGGTRTfpfp rm()lnfGTRTQ 这就是化学反响等温方程式DEGHdegh对于恣意反响fQ 称为“逸度商,可以经过各物质的逸度
6、求算rm()GT 值也可以经过多种方法计算从而可得 的值。rmG当系统到达平衡,那么0mr GGHeemDrEeeln()ghdeffppRTffppGT lnfRTK 称为热力学平衡常数,它仅是温度的函数。在数值上等于平衡时的“逸度商,是量纲一的量,单位为1。由于它与规范化学势有关,所以又称为规范平衡常数。fK化学反响等温式也可表示为:rmlnlnffGRTKRTQ rmlnlnppGRTKRTQ 对理想气体rm0ppKQG反响向右自发进展rm0ppKQG反响向左自发进展rm0ppKQG反响达平衡1在理想液态混合物中任一组分化学势为:*BBBB(,)(,)lnT p xT pRTx*BBBB
7、(,)(,)lnT p xT pRTa对于非理想液态混合物,利用活度概念不是规范态化学势*B(,)T pBBBBB(,)(,)lndppTT p xT pRTappBBB(,)lndppT pRTaVpBBBBBBBBBBBBB(,)()lndppT p xTRTaVp BBB0 当系统达平衡时忽略压力对液态系统的影响,得BBBBBBBB()lndppTRTaVp rmBBB()()GTT BBBlnRTa lnaRTK 2在理想稀溶液中,溶质服从Henry定律:*BBBB(,)(,)lnT p xT pRTx*BBB,B(,)(,)lnxT p xT pRTa假设对Henry定律发生偏向,得
8、不是规范态化学势*B(,)T p*BBBB(,)(,)d(,)ppT pT pVpT pBB,B,B(,)()lnxxT p xTRTa假设溶质浓度用质量摩尔浓度表示,得:BBBB(,)(,)lnmT p mT pRTmBBBB(,)(,)lncT p cT pRTc假设溶质浓度用物质的量浓度表示,得:BBB,B(,)(,)lnmT p mT pRTa,B,B()lnmmTRTaBBB,B(,)(,)lncT p cT pRTa,B,B()lnccTRTa显然,BBBBBB(,)(,)(,)T p xT p mT p c,B,B,B()()()xmcTTT但是由于对数项中的数值也都不相等。令:
9、fpKK对于理想气体BBGHDE()ghdep ppp pGHeeDEeeghdepppppppp GHDEghpdep pKp pBB()ppKKppK是规范平衡常数,单位为1pK是阅历平衡常数,单位视详细情况而定气体反响的阅历平衡常数的表示法有:BB()pKKpGHeeDEeeghfdeffppKffpp GHeeGHDEDEee ghghdedepppppppp pK1用压力表示的阅历平衡常数BB()fpKKKp气体反响的阅历平衡常数的表示法有:pK 1.用压力表示的阅历平衡常数BB()fpKKKpBBBpKp BBBK 由于rmBBB()n(l)fGTRTKT 所以fK仅是温度的函数K
10、与温度和压力有关pK也与温度和压力有关气体反响的阅历平衡常数的表示法有:xK 2.用摩尔分数表示的阅历平衡常数BBppxGHDEghxdex xKx x对于理想气体混合物所以xK与温度和压力有关GHeeDEeeghdepppppppp BBpK p气体反响的阅历平衡常数的表示法有:cK 3.用物质的量表示的阅历平衡常数pcRTHGDEhgcdec cKc c对于理想气体cK仅是温度的函数 GHGHeeDEDEeeghghpdedec RTc RTp pKp pc RTc RTBB()cKRT对于理想气体 对于液相和固相反响的阅历平衡常数,由于规范态不同,故有不同的表示方式BBBmKmBBBaK
11、aBBBcKc对于液相反响,相应的阅历平衡常数有严厉讲,是温度压力的函数,但忽略压力对凝聚相反响的影响,近似将 看作是温度的函数aKaKBBBxKx除 外,阅历平衡常数的单位不一定是1xK下标 m 表示反响进度为 1 mol 时的规范Gibbs自在能的变化值。显然,化学反响方程中计量系数呈倍数关系,的值也呈倍数关系,而 值那么呈指数的关系。rm()GTfKrm()lnfGTRTK rm,2rm,12GG 2,2,1()ffKK例如:HI(g)2g)(Ig)(H22HI(g)g)(Ig)(H22122112 有气相和凝聚相液相、固体共同参与的反响称为复相化学反响。什么叫复相化学反响?只思索凝聚相
12、是纯态的情况,纯态的化学势就是它的规范态化学势,所以复相反响的热力学平衡常数只与气态物质的压力有关。某一反响达化学平衡时BBB 10N 在参与反响的 N 种物质中,有 n 种是气体,其他凝聚相处于纯态 设一切气体为理想气体,代入其化学势表示式 令:BBBBB 1B10nNn BBBBBBB 1B 1B1ln0nnNnpRTp BBB 1nppKp 代入上式并整理,得:对于凝聚相,设BBBBB 1B1lnnNpnRTK BBBBrmB 1lnNpRTKG BBB()ppKTp常数 所以复相化学反响的热力学平衡常数只与气态物质的压力有关,与凝聚相无关。32CaCO(s)CaO(s)CO(g)2(C
13、O)ppKp称为 的解离压力。)CO(2p)s(CaCO3例如,有下述反响,并设气体为理想气体:该反响的阅历平衡常数为2COpKp 某固体物质发生解离反响时,所产生气体的压力,称为解离压力,显然这压力在定温下有定值。假设产生的气体不止一种,那么一切气体压力的总和称为解离压。432NH HS(s)NH(g)HS(g)例如:S)H()NH(23ppp解离压力32(NH)(H S)ppppKp热力学平衡常数为:214(/)p p 规范摩尔生成Gibbs自在能 Ellingham 图 规范形状下反响的Gibbs自在能变化值rmGrmlnaGRTK rmexpaGKRTrmG的用途:1.计算热力学平衡常
14、数 规范形状下反响的Gibbs自在能变化值rmG 在温度T 时,当反响物和生成物都处于规范态,发生反响进度为1 mol的化学反响的Gibbs自在能变化值,称为规范摩尔反响Gibbs自在能变化值,用 表示。rm()GT22rm(1)C(s)O(g)CO(g)(1)G122rm2(2)CO(g)O(g)CO(g)(2)G12rm2(3)C(s)O(g)CO(g)(3)Grmrmrm(3)(1)(2)GGG(1)(3)(2)pppKKK(1)(2)得3 例如,求 的平衡常数122C(s)O(g)CO(g)2.计算实验不易测定的 和平衡常数rmG3近似估计反响的能够性rmrmlnpGGRTQ 只能用
15、判别反响的方向frm,0()T p WG 只能反映反响的限制rmG 当 的绝对值很大时,根本上决议了 的值,所以可以用来近似地估计反响的能够性。rmGrmG3近似估计反响的能够性1rm(1)41.84 kJ molG反响根本不能进展1rm(2)(41.840)kJ molG改动反响外界条件,使反响能进展rm(3)0G存在反响进展的能够性1pKrm(4)0G反响有能够进展,平衡位置对产物有利1pKrm G的几种计算方法1热化学的方法rmrmrmGHTS 利用热力学数据表或测定反响热效应,先计算反响的焓变和熵变2用易于测定的平衡常数,计算rm G再利用Hess定律计算所需的rm G3测定可逆电池的
16、规范电动势rmGzE F 4从规范摩尔生成Gibbs自在能计算5用统计热力学的热函函数和自在能函数计算 由于Gibbs自在能的绝对值不知道,所以只能用相对规范,即将规范压力下稳定单质的生成Gibbs自在能看作零,那么:在规范压力下,由稳定单质生成单位物质的量化合物时Gibbs自在能的变化值,称为该化合物的规范摩尔生成Gibbs自在能,用下述符号表示:fmG化合物,物态,温度没有规定温度,通常在298.15 K时的表值容易查阅 有离子参与的反响,主要是电解质溶液。溶质的浓度主要用质量摩尔浓度表示,这时规定的相对规范态是1fmH(H,aq,1.0 mol kg)0Gm 由此而得到其他离子的规范摩尔
17、生成Gibbs自在能的数值,列表备查。fmG 的值在定义时没有规定温度,通常在298.15 K时的数值有表可查,利用这些表值,我们可以:fmGrmBfmB(B)GGrmG计算恣意反响在298.15 K时的(1)fmG(2)判别反响的能够性在有机合成中,能够有假设干条道路,用计算 的方法,看那条道路的值最小,那么能够性最大。假设 的值是一个很大的正数,那么该反响根本上不能进展。rmGrmG(3)用 值求出热力学平衡常数 值rmGpK 根据 与温度的关系,可以决议用升温还是降温的方法使反响顺利进展。pK在冶金工业中的几个反响21(1)M(s)O(g)MO(s)222111(2)C(s)O(g)CO
18、(g)22221(3)C(s)O(g)CO(g)2221(4)CO(g)O(g)CO(g)2rmrmddGST rm0Srm0Srmd0dGTrm0Srmd0dGTrm0S这些变化可用图表示温度对化学平衡的影响压力对化学平衡的影响惰性气体对化学平衡的影响这是vant Hoff 公式的微分式rm2dlndpKHTRT 根据Gibbs-Helmholtz方程,当反响物都处于规范形状时,有rmrm2ddGTHTT rmlnGRTK 代入,得rm2dlndpKHTRT对吸热反响rm0H升高温度,添加,对正反响有利pK对放热反响rm0Hdln0dpKTBB0气体分子数添加,加压,不利于反响正向进展ln(
19、)0 xTKp添加压力,反响向体积减少的方向进展rmBBB()lnaGTRTK *mln(B)aTKVpRT 对凝聚相反响,设各物处于纯态*Bm(B)TVp*Bm(B)TVp*mln(B)aTKVpRT 反响后系统的体积添加*m(B)0V 在压力不太大时,因凝聚相的 值不大,压力影响可以忽略不计。*m(B)Vln0aTKp添加压力 下降,对正反响不利aK反响后系统的体积变小*m(B)0V添加压力 上升,对正反响有利aKBBGHDEBBghden npn npn 惰性气体不影响平衡常数值,当 不等于零时,参与惰性气领会影响平衡组成。BBBB()pxpKKpBBGHDEghdex xpx xp惰性
20、气体的影响取决于 的值BBBBGHDEBBghpden npn npnKBB0添加惰性气体,值添加,括号项下降,BBn由于 为定值,那么 项应添加,产物的含量会添加。GHDEghden nn npK 对于分子数添加的反响,参与水气或氮气,会使反响物转化率提高,使产物的含量添加。反之,对于分子数减少的反响,参与惰性气体,会使反响向左挪动。在一个反响系统中,假好像时发生几个反响,当到达平衡态时,这种情况称为同时平衡。在处置同时平衡的问题时,要思索每个物质的数量在各个反响中的变化,并在各个平衡方程式中同一物质的数量应坚持一致。例1:323(1)CH Cl(g)H O(g)CH OH(g)HCl(g)
21、知在该温度下,,1,20.00154,10.6ppKK 600 K时,与 发生反响3CH Cl(g)2H O(g)同时存在如下两个平衡:生成 后,继而又分解为 3 2(CH)O(g)3CH OH(g)33 22(2)2CH OH(g)(CH)O(g)H O(g)求 的平衡转化率。3CH Cl(g)2H O(g)今以计量系数比的 和开场3CH Cl(g)解:设开场时 和 的量各为1.0,到达平衡时,HCl 的转化分数为 x,生成 的转化分数为y,那么在平衡时各物的量为:3CH Cl2H O32(CH)O323(1)CH Cl(g)H O(g)CH OH(g)HCl(g)112xyxxyx3322
22、(2)2CH OH(g)(CH)O(g)H O(g)-2 1-xyxyy由于两个反响的 都等于零,所以pxKKBB,1,1(2)0.00154(1)(1)xpxy xKKxxy 将两个方程联立,解得0.048,0.009xy,2,22(1)10.6(2)xpyxyKKxy 的转化率为0.0483CH Cl生成 的产率各不一样332CH OH,HCl,(CH)O耦合反响coupling reaction 设系统中发生两个化学反响,假设一个反响的产物在另一个反响中是反响物之一,那么这两个反响称为耦合反响。例如:(1)AB CD 利用 值很负的反响,将 负值绝对值较小甚至略大于零的反响带动起来。rm
23、GrmG(2)CE FH例如:在298.15 K时:22rm121,4(1)TiO(s)2Cl(g)TiCl(l)O(161.94g)o kJ m lG反响(1)、(2)耦合,使反响(3)得以顺利进展。1rm,222(2)C(s)O(g)CO(g)394.38 o J km lG2242 (3)TiO(s)C(s)2Cl(g)TiCl(l)CO(g)则1rm,3 232.44 kJ mol GrmBfmBBGG 利用以上公式虽然可以经过热力学数据表作一些计算,但是要获得完备的在各个温度下的热力学数据还是困难的,所以有时只能作一些估算。rmrmrm298.15 KGHS rm2dlndKHTRT
24、1 的估算rm()GTrmrmrm()()()GTHTTST rmrmrm298K298K()(298K)(298K)ddTTppGTHTSCCTTTT rmrm298K()(298K)dTpHTHCT 根据Gibbs自在能的定义式,在等温时有知rmrm298K()(298K)dTpCSTSTT 代入上面的计算式,得1 的估算rm()GTrmrmrm298K298K()(298K)(298K)ddTTppGTHTSCCTTTT rmrm(298K),(298K)HS的数据有表可查假设数据不全可以用如下两种方法,作近似计算。假设有完好的 数据,就可以计算恣意温度下的,mpCTrm()GT1 的估
25、算rm()GTrmrmrm298K298K()(298K)(298K)ddTTppGTHTSCCTTTT 假设令:1设pC常数rmrmrm()(298K)(298K)298K ln1298KGTHTSTTT 0298Kln1298KTMT rmrmrm0()(298K)(298K)GTHTSTM 不同温度下的 数值事先制表备用。0M1 的估算rm()GTrmrmrm298K298K()(298K)(298K)ddTTppGTHTSCCTTTT 这是一个非常粗略的估算公式。2设0pCrmrmrm()(298K)(298K)GTHTS abT这里实践上设焓和熵变化值与温度无关,从298.15 K的表值可求出恣意温度T 时的 值。rmG2估计反响的有利温度rmrmrm()()()GTHTTST 通常焓变与熵变在化学反响中的符号是一样的,对Gibbs自在能的奉献刚好相反。要使反响顺利进展,那么 的值越小越好。rm()GTrmrm()0,()0HTST提高温度对反响有利rmrm()0,()0HTST降低温度对反响有利这时温度就起了调理作用 通常将 时的温度称为转机温度,意味着反响方向在这里发生变化rm()0 (1)GTK 转机温度可以用298.15 K时的 和 值进展近似估算。rmHrmSrmrrmr()()HTTST转折)rmrm(298.15K)()(298.15K)HTS转折
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
