 《化学动力学基础》PPT课件.ppt
《化学动力学基础》PPT课件.ppt


《《化学动力学基础》PPT课件.ppt》由会员分享,可在线阅读,更多相关《《化学动力学基础》PPT课件.ppt(130页珍藏版)》请在装配图网上搜索。
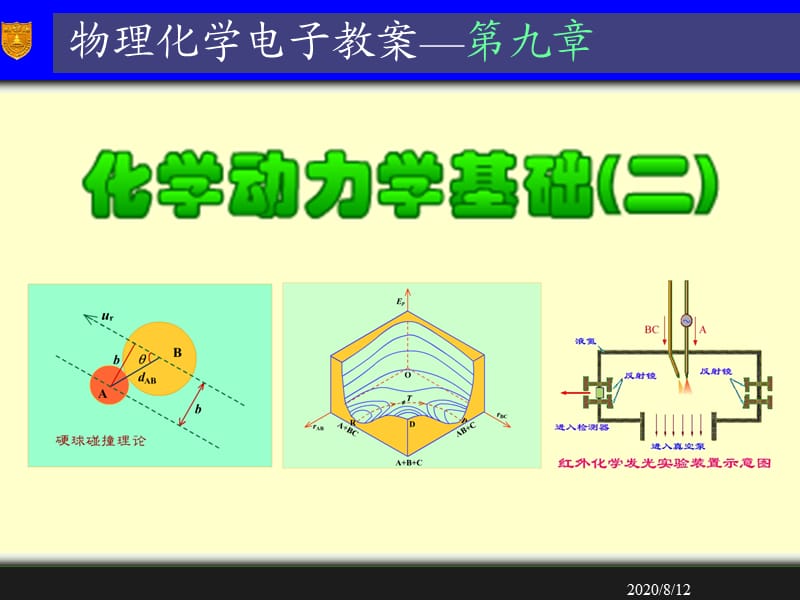
1、2020/8/12,物理化学电子教案第九章,2020/8/12,10.1 碰撞理论,第十章 化学动力学基础(二),12.2 过渡态理论,10.3 分子反应动态学简介,10.4 在溶液中进行的反应,10.5 快速反应的测试,10.6 光化学反应,10.7 酶催化反应,10.8 辅导答疑,2020/8/12,10.1 碰撞理论,速率理论的共同点,两个分子的一次碰撞过程,有效碰撞直径和碰撞截面,A与B分子互碰频率,硬球碰撞模型,碰撞参数,有效碰撞分数,反应阈能,碰撞理论计算速率系数 的公式,反应阈能与实验活化能的关系,概率因子,碰撞理论的优缺点,2020/8/12,速率理论的共同点,与热力学的经典理
2、论相比,动力学理论发展较迟。先后形成的碰撞理论、过渡态理论都是20世纪后建立起来的,尚有明显不足之处。,理论的共同点是:首先选定一个微观模型,用气体分子运动论(碰撞理论)或量子力学(过渡态理论)的方法,并经过统计平均,导出宏观动力学中速率系数的计算公式。,由于所采用模型的局限性,使计算值与实验值不能完全吻合,还必须引入一些校正因子,使理论的应用受到一定的限制。,2020/8/12,两个分子的一次碰撞过程,两个分子在相互的作用力下,先是互相接近,接近到一定距离,分子间的斥力随着距离的减小而很快增大,分子就改变原来的方向而相互远离,完成了一次碰撞过程。,粒子在质心体系中的碰撞轨线可用示意图表示为:
3、,2020/8/12,两个分子的一次碰撞过程,2020/8/12,有效碰撞直径和碰撞截面,运动着的A分子和B分子,两者质心的投影落在直径为 的圆截面之内,都有可能发生碰撞。,称为有效碰撞直径,数值上等于A分子和B分子的半径之和。,虚线圆的面积称为碰撞截面(collision cross section),数值上等于 。,2020/8/12,A与B分子互碰频率,将A和B分子看作硬球,根据气体分子运动论,它们以一定角度相碰。,相对速度为:,互碰频率为:,2020/8/12,硬球碰撞模型,将总的动能表示为质心整体运动的动能 和分子相对运动的动能 ,,两个分子在空间整体运动的动能 对化学反应没有贡献,
4、而相对动能可以衡量两个分子相互趋近时能量的大小,有可能发生化学反应。,设A和B为没有结构的硬球分子,质量分别为 和 ,折合质量为 ,运动速度分别为 和 ,总的动能为,2020/8/12,碰撞参数(impact parameter),碰撞参数用来描述粒子碰撞激烈的程度,通常用字母b表示。,通过A球质心,画平行于 的平行线,两平行线间的距离就是碰撞参数b 。,和B两个球的连心线 等于两个球的半径之和,,对速度 之间的夹角为 。,在硬球碰撞示意图上,,A,它与相,数值上:,2020/8/12,碰撞参数(impact parameter),硬球碰撞理论,2020/8/12,有效碰撞分数,分子互碰并不是
5、每次都发生反应,只有相对平动能在连心线上的分量大于阈能的碰撞才是有效的,所以绝大部分的碰撞是无效的。,要在碰撞频率项上乘以有效碰撞分数q。,2020/8/12,反应阈能(threshold energy of reaction),反应阈能又称为反应临界能。,值与温度无关,实验尚无法测定,而是从实验活化能Ea计算。,两个分子相撞,相对动能在连心线上的分量必须大于一个临界值 ,这种碰撞才有可能引发化学反应,这临界值 称为反应阈能。,2020/8/12,碰撞理论计算速率系数的公式,(1)(2)式完全等效,(1)式以分子计,(2)式以1mol计算。,2020/8/12,反应阈能与实验活化能的关系,实验
6、活化能的定义:,碰撞理论计算速率系数的公式:,将与T无关的物理量总称为B:,总结:阈能Ec与温度无关,但无法测定,要从实验活化能Ea计算。在温度不太高时,,Ea Ec,2020/8/12,概率因子(probability factor),概率因子又称为空间因子或方位因子。,由于简单碰撞理论所采用的模型过于简单,没有考虑分子的结构与性质,所以用概率因子 P 来校正理论计算值与实验值的偏差。,2020/8/12,概率因子(probability factor),(1)从理论计算认为分子已被活化,但由于有的分子只有在某一方向相撞才有效;,(2)有的分子从相撞到反应中间有一个能量传递过程,若这时又与另
7、外的分子相撞而失去能量,则反应仍不会发生;,(3)有的分子在能引发反应的化学键附近有较大的原子团,由于位阻效应,减少了这个键与其它分子相撞的机会等等。,理论计算值与实验值发生偏差的原因主要有:,2020/8/12,碰撞理论的优缺点,优点: 碰撞理论为我们描述了一幅虽然粗糙但十分明确的反应图像,在反应速率理论的发展中起了很大作用。,缺点:但模型过于简单,所以要引入概率因子,且概率因子的值很难具体计算。阈能还必须从实验活化能求得,所以碰撞理论还是半经验的。,对阿仑尼乌斯公式中的指数项、指前因子和阈能都提出了较明确的物理意义,认为指数项相当于有效碰撞分数,指前因子A相当于碰撞频率。,它解释了一部分实
8、验事实,理论所计算的速率系数k值与较简单的反应的实验值相符。,2020/8/12,10.2 过渡态理论,过渡态理论,势能面,反应坐标,马鞍点,势能面剖面图,三原子体系振动方式,热力学方法计算速率系数,活化焓与实验活化能的关系,势能面投影图,过渡态理论的优缺点,2020/8/12,过渡态理论(transition state theory),过渡态理论是1935年由艾林(Eyring)、埃文(Evans)与波兰尼(Polany)等人在统计热力学和量子力学的基础上提出来的。,他们认为由反应物分子变成生成物分子,中间一定要经过一个过渡态,而形成这个过渡态必须吸取一定的活化能,这个过渡态就称为活化络合
9、物,所以又称为活化络合物理论。,用该理论,只要知道分子的振动频率、质量、核间距等基本物性,就能计算反应的速率系数,所以又称为绝对反应速率理论(absolute rate theory)。,2020/8/12,势能面,对于反应:,令ABC=180o, EP=EP(rAB,rBC)。,随着核间距rAB和rBC的变化,势能也随之改变。,这些不同点在空间构成高低不平的曲面,称为势能面,如图所示。,该理论认为反应物分子间相互作用的势能是分子间相对位置的函数。,2020/8/12,势能面,A+BC,AB+C,A+B+C,R,P,2020/8/12,势能面,R点是反应物BC分子的基态,随着A原子的靠近,势能
10、沿着RT线升高,到达T点形成活化络合物。,随着C原子的离去,势能沿着TP线下降,到P点是生成物AB分子的稳态。,D点是完全离解为A,B,C原子时的势能;,OEP一侧,是原子间的相斥能,也很高。,2020/8/12,反应坐标是一个连续变化的参数,其每一个值都对应于沿反应体系中各原子的相对位置。如在势能面上,反应沿RTTP虚线进行,反应进程不同,则各原子间相对位置不同,体系的能量也不同。,如以势能为纵坐标,反应坐标为横坐标,画出的图可以表示反应过程中体系势能的变化,这是一条能量最低的途径。,反应坐标(reaction coordinate),2020/8/12,马鞍点(saddle point),
11、在势能面上,活化络合物所处的位置T点称为马鞍点。,该点势能与反应物和生成物所处的稳定态能量R点和P点相比是最高点,但与坐标原点一侧和D点的势能相比又是最低点。,如把势能面比作马鞍的话,则马鞍点处在马鞍的中心。从反应物到生成物必须越过这个能垒。,2020/8/12,马鞍点(saddle point),2020/8/12,势能面投影图,将三维势能面投影到平面上,就得到势能面的投影图。,图中曲线是相同势能的投影,称为等势能线,线上数字表示等势能线的相对值。,等势能线的密集度表示势能变化的陡度。,2020/8/12,势能面投影图,靠坐标原点(O点)一方,随着原子核间距变小,势能急剧升高,是一个陡峭的势
12、能峰。,在D点方向,随着rAB和rBC的增大,势能逐渐升高,这平缓上升的能量高原的顶端是三个孤立原子的势能,即D点。,反应物R经过马鞍点T到生成物P,走的是一条能量最低通道。,2020/8/12,势能面投影图,势能面投影图,2020/8/12,势能面剖面图,沿势能面上R-T-P虚线切剖面图,把R-T-P曲线作横坐标,这就是反应坐标。以势能作纵坐标,标出反应进程中每一点的势能,就得到势能面的剖面图。,从剖面图可见:从反应物A+BC到生成物走的是能量最低通道,但必须越过势能垒Eb。,Eb是活化络合物与反应物最低势能之差,E0是两者零点能之间的差值。,这个势能垒的存在说明了实验活化能的实质。,202
13、0/8/12,势能面剖面图,2020/8/12,三原子体系振动方式,线性三原子体系有三个平动和两个转动自由度,所以有四个振动自由度:,(a)为对称伸缩振动,rAB与rBC相等;,(b)为不对称伸缩振动,rAB与rBC不等;,(c)和(d)为弯曲振动,分别发生在相互垂直的两个平面内,但能量相同。,2020/8/12,三原子体系振动方式,对于稳定分子,这四种振动方式都不会使分子破坏。,但对于过渡态分子,不对称伸缩振动没有回收力,会导致它越过势垒分解为产物分子。,所以这种不对称伸缩振动每振一次,就使过渡态分子分解,这个振动频率就是过渡态的分解速率系数。,2020/8/12,热力学方法计算速率系数,过
14、渡态理论假设:,以三原子反应为例,设n是导致络合物分解的不对称伸缩振动的频率,其数值很小(可假定hnkBT).,1.反应物与活化络合物能按达成热力学平衡的方式处理;,2.活化络合物向产物的转化是反应的决速步。,2020/8/12,统计热力学方法计算速率系数,2020/8/12,热力学方法计算速率系数,是反应物与活化络合物达成平衡时的平衡常数。,2020/8/12,热力学方法计算速率系数,根据量子力学理论,,2020/8/12,活化焓与实验活化能的关系,对凝聚相反应:,对气相反应: (设n为气相反应物分子数),2020/8/12,过渡态理论的优缺点,1.形象地描绘了基元反应进展的过程;,缺点:引
15、进的平衡假设和速决步假设并不能符合所有的实验事实;对复杂的多原子反应,绘制势能面有困难,使理论的应用受到一定的限制。,2.原则上可以从原子结构的光谱数据和势能面计算宏观反应的速率常数;,优点:,3.对阿仑尼乌斯的指前因子作了理论说明,认为它与反应的活化熵有关;,4.形象地说明了反应为什么需要活化能以及反应遵循的能量最低原理。,2020/8/12,10.3 分子反应动态学简介,分子反应动态学,交叉分子束装置示意图,喷嘴源 溢流源 速度选择器散射室 检测器 速度分析器,2020/8/12,分子反应动态学(molecular reaction dynamics),分子反应动态学是从微观的角度研究反应
16、分子在一次碰撞行为中的性质。,这种研究起始于二十世纪三十年代,由Eyling,Polanyi 等人开始,但真正发展是在六十年代,随着新的实验技术和计算机的发展,才取得了一系列可靠的实验资料。,D.R.Herschbach和美籍华裔科学家李远哲在该领域做出了杰出的贡献,因而分享了1986年诺贝尔化学奖。,2020/8/12,分子反应动态学(molecular reaction dynamics),分子动态学主要研究:,(1)分子的一次碰撞行为及能量交换过程,(2)反应几率与碰撞角度和相对平动能的关系,(3)产物分子所处的各种平动、转动和振动状态,(4)如何用量子力学和统计力学计算速率系数。,20
17、20/8/12,交叉分子束装置示意图,交叉分子束装置主要由5部分组成:,(5)速度分析器,检测产物的速度分布、角分布和平动能分布。,(1)束源,用来产生分子束。图中有喷嘴源和溢流源两个束源。,(3)散射器,两束分子交叉的中部为反应散射室。,(2)速度选择器,在溢流源上方的一组平行线条,表示带有齿孔的选速盘。,(4)检测器,在360o立体角范围内检测碰撞后的结果。,2020/8/12,交叉分子束装置示意图,2020/8/12,喷嘴源,喷嘴源内气体压力很高,突然以超声速向真空作绝热膨胀,分子由随机的热运动转变为有序的束流,具有较大的平动能。,这种分子束的速率分布较窄,不需再加选速器,调节源内压力可
18、改变分子速度。,由于绝热膨胀后分子束温度较低,分子的转动和振动可处于基态。,2020/8/12,溢流源,溢流源俗称炉子,将反应物放入炉中加热变为蒸气,让蒸气从小孔中溢出形成分子束。,它的优点是适用与各种物质,炉子结构简单易控制,缺点是束流强度低,分子的速度分布宽。,2020/8/12,速度选择器,选速器是由一系列带有齿孔的圆盘组成,每个盘上刻有数目不等的齿孔。,溢流源产生的分子束中分子运动的速度具有玻尔兹曼分布,为了使进入散射室的分子具有很窄的速度范围,必须选速。,控制轴的转速,使符合速度要求的分子穿过齿孔进入散射室,不符合速度要求的分子被圆盘挡住,达到选择分子速度的要求。但这样也会降低分子束
19、的强度。,2020/8/12,散射室,散射室就是交叉分子束的反应室。两束分子在那里正交并发生反应散射,为了防止其它分子的干扰,散射室必须保持超高真空。,在散射室周围设置了多个窗口,由检测仪接收来自散射粒子辐射出的光学信号,以便分析它的量子态,或射入特定的激光束,使反应束分子通过共振吸收激发到某一指定的量子态,达到选态的目的。,2020/8/12,检测器,检测器用来捕捉在散射室内碰撞后产物的散射方向、产物的分布以及有效碰撞的比例等一系列重要信息。,由于稀薄的两束分子在散射室里交叉,只有一小部分发生碰撞,而且有效碰撞的比例更低,产物可能散射到各个不同的方向,所以检测器要灵敏的检测到以散射中心为圆心
20、的360o立体角范围内以每秒几个粒子计数的产物分子。,常用的检测器是电离四极质谱仪。,2020/8/12,速度分析器,在散射产物进入检测器的窗口前面安装一个高速转动的斩流器,用来产生脉冲的产物流。,斩流器到检测器之间的距离是事先设定的,可以调节。,用时间飞行技术(TOF)测定产物通过斩流器到检测器的先后时间,得到产物流强度作为飞行时间的函数,这就是产物平动能量函数,从而可获得产物的速度分布、角分布和平动能分布等重要信息。,2020/8/12,10.4 在溶液中进行反应,笼效应,一次遭遇,原盐效应,2020/8/12,笼效应(cage effect),在溶液反应中,溶剂是大量的,溶剂分子环绕在反
21、应物分子周围,好像一个笼把反应物围在中间,使同一笼中的反应物分子进行多次碰撞,其碰撞频率并不低于气相反应中的碰撞频率,因而发生反应的机会也较多,这种现象称为笼效应。,对有效碰撞分数较小的反应,笼效应对其反应影响不大;,对自由基等活化能很小的反应,一次碰撞就有可能反应,则笼效应会使反应速率变慢,分子的扩散速度起了速决步的作用。,2020/8/12,笼效应(cage effect),2020/8/12,一次遭遇(one encounter),反应物分子处在某一个溶剂笼中,发生连续重复的碰撞,称为一次遭遇,直至反应物分子挤出溶剂笼,扩散到另一个溶剂笼中。,在一次遭遇中,反应物分子有可能发生反应,也有
22、可能不发生反应。,每次遭遇在笼中停留的时间约为10-1210-11s,进行约1001000次碰撞,频率与气相反应近似。,2020/8/12,溶剂对反应速率的影响,溶剂对反应速率的影响是十分复杂的,主要有:,(1)溶剂介电常数的影响 介电常数大的溶剂会降低离子间的引力,不利于离子间的化合反应。,(2)溶剂极性的影响 如果生成物的极性比反应物大,极性溶剂能加快反应速率,反之亦然。,(3)溶剂化的影响 反应物分子与溶剂分子形成的化合物较稳定,会降低反应速率;若溶剂能使活化络合物的能量降低,从而降低了活化能,能使反应加快。,(4)离子强度的影响 离子强度会影响有离子参加的反应速率,会使速率变大或变小,
23、这就是原盐效应。,2020/8/12,原盐效应,稀溶液中,离子强度对反应速率的影响称为原盐效应。,例如有反应:,和 分别为无电解质和有电解质时的速率系数。,2020/8/12,原盐效应,(1) 0,离子强度增 大,k增大,正原盐效应。,(2) 0,离子强度增 大,k下降,负原盐效应。,(3) =0,离子强度不 影响k值,无原盐效应。,2020/8/12,原盐效应,2020/8/12,10.5 快速反应的测试,阻碍流动技术,闪光光解,驰豫法,2020/8/12,阻碍流动技术,对于混合未完全而已混合的部分反应已完成的 快速反应,可以采取这种阻碍流动技术。反应前, 两种反应物溶液分置于注射器A及B中
24、。,反应开始时,用机械的方法将注射器活塞迅速推下,两种溶液在反应器C中在1/1000s内快速混合并发生反应,用快速自动记录谱仪或照相技术,拍摄C窗口中与浓度呈线性关系的物理量,如电导、旋光、荧光等,然后进行分析。,2020/8/12,阻碍流动技术,2020/8/12,闪光光解(flash photolysis),闪光光解利用强闪光使分子发生光解,产生自由原子或自由基碎片,然后用光谱等技术测定产生碎片的浓度,并监测随时间的衰变行为。,由于所用的闪光强度很高,可以产生比常规反应浓度高许多倍的自由基;闪光灯的闪烁时间极短,可以检测半衰期在10-6 s以下的自由基;,反应管可长达1 m以上,为光谱检测
25、提供了很长的光程。所以闪光光解技术成为鉴定及研究自由基的非常有效的方法。,2020/8/12,闪光光解(flash photolysis),A:石英反应管 B:石英闪光管 F:为另一闪光管 D:为检测管,2020/8/12,驰豫法(relaxation method),驰豫法是用来测定快速反应速率的一种特殊方法。,对平衡体系施加扰动信号的方法可以是脉冲式、阶跃式或周期式。改变反应的条件可以是温度跃变、压力跃变、浓度跃变、电场跃变和超声吸收等多种形式。,当一个快速对峙反应在一定的外界条件下达成平衡,然后突然改变一个条件,给体系一个扰动,偏离原平衡,在新的条件下再达成平衡,这就是驰豫过程。,用实验
26、求出驰豫时间,就可以计算出快速对峙反应的正、逆两个速率常数。,2020/8/12,以1-1级对峙反应为例,速率方程,平衡时:,设,为扰动后与新平衡浓度的差值。,2020/8/12,以1-1级对峙反应为例,令,当,测定驰豫时间,解得k1和k-1,用方程组,2020/8/12,10.6 光化学反应,光的波长与能量,光化学基本定律,量子效率,量子产率,分子的重度(单重态、三重态),单重态与三重态的能级比较,激发到S1和T1态的概率,激发态电子能量的衰减方式,荧光与磷光的异同点,光化学反应动力学,光化学反应特点,光敏剂,雅布伦斯基图,化学发光,2020/8/12,光的波长与能量,e =hn =hc/l
27、,u =Lhn,一摩尔光量子能量称为一个“Einstein”。波长 越短,能量越高。紫外、可见光能引发化学反应。,由于吸收光量子而引起的化学反应称为光化学 反应。,2020/8/12,光化学基本定律,1.光化学第一定律,只有被分子吸收的光才能引发光化学反应。该定律在1818年由Grotthus和Draper提出,故又称为Grotthus-Draper定律。,2.光化学第二定律,在初级过程中,一个被吸收的光子只活化一个分子。该定律在19081912年由Einstein和Stark提出,故又称为 Einstein-Stark定律。,2020/8/12,光化学基本定律,3.Beer-Lambert定
28、律,平行的单色光通过浓度为c,长度为d的均匀介质时,未被吸收的透射光强度It与入射光强度I0之间的关系为(e为摩尔消光系数),2020/8/12,量子效率(quantum efficiency),当1,是由于初级过程活化了一个分子,而次级过程中又使若干反应物发生反应。 如:H2+Cl22HCl的反应,1个光子引发了一个链反应,量子效率可达106。,当1,是由于初级过程被光子活化的分子,尚未来得及反应便发生了分子内或分子间的传能过程而失去活性。,2020/8/12,量子产率(quantum yield),由于受化学反应式中计量系数的影响,量子效率与量子产率的值有可能不等。,例如,下列反应的量子效
29、率为2,量子产率却为1。 2HBr + hn H2 + Br2,2020/8/12,量子产率(quantum yield),在光化反应动力学中,用下式定义量子产率更合适:,式中r为反应速率,用实验测量, Ia为吸收光速率,用露光计测量。,2020/8/12,分子的重度(multiplicity of molecule),分子重度M的定义为: M=2S+1,式中S为电子的总自旋量子数,M则表示分子中电子的总自旋角动量在Z轴方向的可能值。,M=1为单重态或单线态;,M=3为三重态或三线态。,2020/8/12,单重态(singlet state),如果分子中一对电子为自旋反平行,则S=0,M=1,
30、这种态被称为单重态或单线态,用S表示。,大多数化合物分子处于基态时电子自旋总是成对的,所以是单线态,用S0表示。,在吸收光子后,被激发到空轨道上的电子,如果仍保持自旋反平行状态,则重度未变,按其能量高低可相应表示为S1态S2态。,2020/8/12,单重态(singlet state),2020/8/12,三重态(triplet state),当处于S0态的一对电子吸收光子受激后,产生了在两个轨道中自旋方向平行的电子,这时S=1,M=3,这种状态称为三重态或三线态。,因为在磁场中,电子的总自旋角动量在磁场方向可以有三个不同值的分量,是三度简并的状态,用T表示。按能量高低可表示为T1,T2激发态
31、。,2020/8/12,三重态(triplet state),2020/8/12,单重态与三重态的能级比较,在三重态中,处于不同轨道的两个电子自旋平行,两个电子轨道在空间的交盖较少,电子的平均间距变长,因而相互排斥的作用减低,所以T态的能量总是低于相同激发态的S态能量。,2020/8/12,激发到S1和T1态的概率,电子由S0态激发到S1态或T1态的概率是很不相同的。,从光谱带的强弱看,从S0态激发到S1态是自旋允许的,因而谱带很宽;而从S0态激发到T1态是自旋禁阻的,一般很难发生,它的概率是10-5数量级。,但对于顺磁物质,激发到T1态的概率将明显增加。,2020/8/12,激发到S1和T1
32、态的概率,2020/8/12,雅布伦斯基(Jablonski)图,分子吸收光子后各种光物理过程可用Jablonski图表示。当分子得到能量后,可能激发到各种S和T态,到S态的电子多于到T态的电子。,2020/8/12,雅布伦斯基(Jablonski)图,2020/8/12,雅布伦斯基(Jablonski)图,激发态电子能量衰减有多种方式:,1.振动弛豫(vibration relaxation) 在同一电子能级中,处于较高振动能级的电子将能量变为平动能或快速传递给介质,自己迅速降到能量较低的振动能级,这过程只需几次分子碰撞即可完成,称为振动弛豫。如图中垂直向下虚线箭头所示。,2020/8/12
33、,雅布伦斯基(Jablonski)图,振动弛豫,2020/8/12,雅布伦斯基(Jablonski)图,2.内部转变(internal conversion) 在相同的重态中,电子从某一能级的低能态按水平方向窜到下一能级的高能级,这过程中能态未变,如图中水平虚线箭头所示。,2020/8/12,雅布伦斯基(Jablonski)图,内部转变,2020/8/12,雅布伦斯基(Jablonski)图,3.系间窜跃(intersystem crossing) 电子从某一重态等能地窜到另一重态,如从S1态窜到T1态,这过程重态改变了,而能态未变,如水平箭头所示。,2020/8/12,雅布伦斯基(Jablo
34、nski)图,系间窜跃,2020/8/12,雅布伦斯基(Jablonski)图,4.荧光(fluorescence) 当激发态分子从激发单重态S1态的某个能级跃迁到S0态并发射出一定波长的辐射,这称之为荧光。荧光寿命很短,约10-9-10-6 s,入射光停止,荧光也立即停止。,2020/8/12,雅布伦斯基(Jablonski)图,荧光,2020/8/12,雅布伦斯基(Jablonski)图,5.磷光(phosphorescence) 当激发态分子从三重态T1跃迁到S0态时所放出的辐射称为磷光,这种跃迁重度发生了改变。磷光寿命稍长,约10-4-10-2秒。由于从S0到T1态的激发是禁阻的,所以
35、,处于T1态的激发分子较少,磷光较弱。,2020/8/12,雅布伦斯基(Jablonski)图,磷光,2020/8/12,激发态电子能量的衰减方式,振动驰豫 内转换 系间窜跃,荧光 S1S0+hni,磷光 T1S0+hnp,A*P,A*+BA+B* A*+M A+M +Q,2020/8/12,荧光与磷光的异同点,(1)相同点:,1.都是电子从激发态跃迁到基态时放出 的辐射,波长一般都不同于入射光的 波长。,2.温度均低于白灼光,一般在800 K以下,故称为化学冷光。,2020/8/12,(2)不同点:,1.跃迁时重度不同。 荧光:S1S0 重度未变。 磷光:T1S0 重度改变。,2.辐射强度不
36、同。 荧光:强度较大,因从S0S1是自旋允许的, 处于S1,S2态电子多,因而荧光亦强。 磷光:很弱,因为S0T1是自旋禁阻的,处 于T1态电子少。,荧光与磷光的异同点,3.寿命不同。 荧光:10-910-6s,寿命短。 磷光:10-410-2s,寿命稍长。,2020/8/12,光化学反应动力学,总包反应,反应机理,动力学方程,反应(1)中,速率只与 有关,与反应物浓度无关。,2020/8/12,光化学反应的特点,1.等温等压条件下,能进行DrG0的反应。,2.反应温度系数很小,有时升高温度,反应速 率反而下降。,3.光化反应的平衡常数与光强度有关。,2020/8/12,例如:H2+hn 2H
37、 Hg为光敏剂,CO2+H2O O2 + (C6H12O6)n 叶绿素为光敏剂。,光敏剂(sensitizer),有些物质对光不敏感,不能直接吸收某种波长的光而进行光化学反应。,如果在反应体系中加入另外一种物质,它能吸收这样的辐射,然后将光能传递给反应物,使反应物发生作用,而该物质本身在反应前后并未发生变化,这种物质就称为光敏剂,又称感光剂。,2020/8/12,化学发光(chemiluminescence),化学发光可以看作是光化反应的反面过程。,在化学反应过程中,产生了激发态的分子,当这些分子回到基态时放出的辐射,称为化学发光。,这种辐射的温度较低,故又称化学冷光。不同反应放出的辐射的波长
38、不同。有的在可见光区,也有的在红外光区,后者称为红外化学发光,研究这种辐射,可以了解初生态产物中的能量分配情况。,2020/8/12,10.7 酶催化反应,酶催化反应历程,用稳态近似法处理,酶催化的反应速率曲线,酶催化反应的级数,米氏常数,酶催化反应特点,2020/8/12,酶催化反应历程,Michaelis-Menten,Briggs,Haldane,Henry等人研究了酶催化反应动力学,提出的反应历程如下:,他们认为酶(E)与底物(S)先形成中间化合物ES,中间化合物再进一步分解为产物(P),并释放出酶(E),整个反应的速控步是第二步。,2020/8/12,用稳态近似法处理,2020/8/
39、12,酶催化反应的级数,令酶的原始浓度为E0,反应达稳态后,一部分变为中间化合物ES,余下的浓度为E,以r为纵坐标,以S为横坐标作图,从图上可以看出酶催化反应一般为零级,有时为一级。,2020/8/12,酶催化的反应速率曲线,1.当底物浓度很大时,SKM,r =k2E0,反应只与酶的浓度有关,而与底物浓度无关,对S呈零级。,2.当SKM时,r =k2E0S/KM 对S呈一级。,3.当S时,r = rm=k2E0。,2020/8/12,酶催化的反应速率曲线,典型的酶催化反应速率曲线,2020/8/12,米氏常数KM,为了纪念Michaelis-Menten对酶催化反应的贡献,,下面的数学处理可以
40、求出KM和rm,重排得:,以 作图,从斜率和截距求出KM和rm,将KM=(k-1+k2)/k1称为米氏常数,,将KM=ES/ES称为米氏公式。,当反应速率达到最大值rm的一半时, KM=S。,2020/8/12,酶催化反应特点,酶催化反应与生命现象有密切关系,它的主要特点有:,1.高选择性 它的选择性超过了任何人造催化剂,例如脲酶它只 能将尿素迅速转化成氨和二氧化碳,而对其他反应 没有任何活性。,2.高效率 它比人造催化剂的效率高出109至1015 倍。例如 一个过氧化氢分解酶分子,在1秒钟内可以分解十 万个过氧化氢分子。,3.反应条件温和 一般在常温、常压下进行。,4.反应历程复杂 受pH、
41、温度、离子强度影响较大。,2020/8/12,10.8 辅导答疑 10.1,10.1 什么是阈能?,答:阈能又称反应临界能。当A和B分子发生碰撞反应时,设相对平动能为r,它在连心线上的分量为r,当r大于阈能时,这样的碰撞可引发化学反应,才是有效碰撞。,1 mol 阈能用Ec表示,它是与温度无关的物理量,决定于反应分子的性质。Ec的值可以从阿仑尼乌斯活化能求得。,2020/8/12,辅导答疑 10.2,10.2 什么是有效碰撞分数?,答: 用碰撞频率计算出来的速率系数远远大于实验值,说明并不是每次碰撞都能引起化学反应。只有相对平动能在连心线上的分量超过阈能Ec时的碰撞才有可能引发化学反应。所以在
42、碰撞频率项上要乘上一个有效碰撞分数q,,2020/8/12,辅导答疑 10.3,10.3 什么是概率因子?,答:概率因子又称空间因子或方位因子,通常用字母P表示,所以又称为P 因子。由于简单碰撞理论所用的分子模型过于简单,即使相碰分子达到了能量要求,但由于碰撞瞬间真实分子的空间取向不合适,可能仍不发生反应。这样理论计算值和实验值就会发生偏差,所以引入概率因子加以校正。如计算的是指前因子A ,则概率因子等于:,2020/8/12,辅导答疑 10.4,10.4 简单碰撞理论有何优缺点?,答:碰撞理论为我们描绘了一幅虽然粗糙但十分明确的反应图象,对阿仑尼乌斯公式中的指前因子A提出了明确的物理意义,说
43、明它与碰撞频率有关;对反应阈能也给予了形象的描述;但碰撞理论是半经验的,阈能的值要从实验活化能求得;所用的模型过于简单,对于较复杂的分子,计算值与理论值相差较大,必须引入概率因子加以校正。,2020/8/12,辅导答疑 10.5,10.5 有反应 A + BC = P ,写出用热力学方法求k值的计算公式。,答:,式中kBT/h为普适常数,常温下数值约为1013 s-1。第二项用来平衡等式两边的单位。后面指数项上分别出现了标准摩尔活化活化熵和活化焓等物理量。,2020/8/12,辅导答疑 10.6,10.6 过渡态理论有哪些优点?,答:过渡态理论原则上可以从原子结构的光谱数据和势能面,计算宏观反
44、应的速率常数,所以又称为绝对反应速率理论。它对阿仑尼乌斯公式中的指前因子作了理论说明,认为它与反应的活化熵有关。从势能面上可形象地说明为什么反应需要活化能,以及反应途径的能量最低原理等。,2020/8/12,辅导答疑 10.7,10.7 过渡态理论有哪些缺点?,答:该理论还是不完善的。在推导计算式的过程中引入了几点假设:反应物与活化络合物处于热平衡,反应物先形成过渡态然后分解为产物,过渡态的分解是反应的速决步,有一个不对称伸缩振动导致络合物的分解等。如果真实反应不是如此,则理论计算值和实验值就会有偏差。另外,只有对较简单的分子才有可能画出势能面,对复杂的多原子分子几乎无法画出势能面,使理论的应
45、用受到一定的限制.。,2020/8/12,辅导答疑 10.8,10.8 碰撞理论和过渡态理论是否对所有反应都适用?,答:不,这两个理论只适用于基元反应。基元反应是一步完成的反应,这两个速率理论是要描述这一步化学反应的过程,根据反应的各种物理和化学性质,定量计算反应速率。,2020/8/12,辅导答疑 10.9,10.9 温度升高,反应速率增加。从碰撞理论看,升高温度主要是碰撞频率增加了呢?还是超过阈能的有效碰撞分数提高了?,答:温度对碰撞频率影响不大,升高温度主要是提高了有效碰撞分数。这可用计算说明。设反应温度为500 K,阈能值Ec = 150 kJ/mol,当升高10 K时,分别计算碰撞频
46、率和有效碰撞分数的变化:,2020/8/12,辅导答疑 10.9,续,2020/8/12,辅导答疑 10.9,续,从计算可知,增加10 K,碰撞频率增加极小,而有效碰撞分数增加得很显著。正因为这样,阿仑尼乌斯把频率因子A看作与温度无关的常数而不会引起太大误差。,2020/8/12,辅导答疑 10.10,10.10 过渡态理论中的活化焓 DrHm 与阿仑尼乌斯活化能 Ea 有什么不同?,答:(1)物理意义不同, DrHm是指反应物生成活化络合物时的焓变, Ea是指活化分子的平均能量与反应物分子平均能量的差值。,(2)在数值上也不完全相等,对凝聚相反应,两者差 RT;对气相反应,差nRT,n是气相
47、反应物的系数和。Ea = DrHm + RT (凝聚相反应) Ea = DrHm + nR T (气相反应),2020/8/12,辅导答疑 10.11,10.11 光化学初级反应的速率为什么通常等于吸收光速率,而与反应物的浓度无关?,答:因为在光化学初级反应中,一个光子活化一个反应物分子。而反应物一般是过量的,所以吸收光子的速率,即单位时间单位体积中吸收光子物质的量,就等于初级反应的速率。初级反应速率对反应物浓度呈零级反应。 A + hn PdP/dt = Ia,2020/8/12,辅导答疑 10.12,10.12 荧光和磷光有哪些共同点?,答:(1)它们都是电子从激发态跃迁到基态时放出的辐射
48、,波长一般都不同于入射光波长。,(2)它们的温度都低于常见的白灼光,一般在 800 K以下,所以称为化学冷光。,2020/8/12,辅导答疑 10.13,10.13 荧光和磷光有哪些不同点?,答:(1)荧光是从激发S态回到S基态发出的光,线态没有改变;而磷光是从激发的三线态回到S基态,线态发生了改变。,(2)荧光比磷光强得多,因为激发时从S基态到S激发态是自旋允许的,到三线T态的激发是自旋禁阻的。,(3)荧光寿命比磷光短得多,荧光寿命在10-910-6 s 范围内,而磷光在10-410-2 s之间。,2020/8/12,辅导答疑 10.14,10.14 已知HI在光的作用下分解为H2和I2的机
49、理,试说出该反应的量子产率。 反应机理: HI + hn H + I H + HI H2 + I I + I + M I2 + M,答:量子产率应该等于1。因为碘化氢吸收了一个光子,生成了一个氢分子(或一个碘分子)。但该反应的量子效率应该等于2,因为吸收了一个光子,消耗了两个碘化氢分子。,2020/8/12,辅导答疑 10.15,10.15 氧气在光作用下转变为臭氧,吸收了0.5 mol光子,生成了1 mol臭氧。问该光化反应的量子效率是多少?,答:量子效率应该为3。因为消耗1.5 mol氧气才能生成1mol臭氧。吸收0.5 mol光子,消耗1.5 mol氧气,所以量子效率为3。但量子产率为2
50、,吸收了0.5 mol光子,生成了1 mol臭氧。 3O2 + hn 2O3,2020/8/12,辅导答疑 10.16,10.16 光化学反应与热反应有哪些异同点?,答:相同点:两种反应都需要活化能。,不同点:,(1)两种反应活化能的来源不同,光化反应活化能来自吸收的光能,热反应来自分子碰撞。 (2)光化反应温度系数较小,有时升高温度,反应速率反而下降。 (3)光化反应在等温、等压下,可进行DG大于零的反应,因为它吸收光能。 (4)光化反应平衡常数与光强度有关,而热反应平衡常数一般与反应物浓度无关。,2020/8/12,辅导答疑 10.17,10.17 现在已有科学家成功地用水光解制备氢气和氧
51、气。为什么阳光照在水面上看不到有丝毫氢气和氧气生成?,答:因普通水中没有光敏剂。光化学反应的发生都要靠光敏剂吸收一定波长的光使自己活化,然后将能量传给反应物,使它发生化学反应。例如氢气光解时的汞蒸气和光合作用中的叶绿素都是光敏剂。 水光解的光敏剂在实验室规模已试制成功,如能大规模合成,而且又很便宜的话,就可以从水中提取氢气作燃料了。,2020/8/12,辅导答疑 10.18,10.18 催化剂为什么会加快反应速率?,答:这种问法不全面。催化剂不一定只会加快反应速率,也可能降低反应速率,所以应该说,催化剂可以改变反应速率。,改变反应速率的本质是改变反应历程,使各基元步骤活化能组成的总表观活化能降
52、低或升高,从而改变了反应速率。所以凡有催化剂参与的反应就不是基元反应。,2020/8/12,辅导答疑 10.19,10.19 合成氨反应在一定温度和压力下,平衡转化率为25%。现在加入一种高效催化剂后,反应速率增加了20倍,问平衡转化率提高了多少?,答:只要其他条件保持不变,平衡转化率仍然是25%。因为催化剂只能增加正、逆反应的速率,使体系缩短到达平衡的时间,而不能改变平衡的组成。同样,一个热力学认为不可能进行的反应,任何催化剂都不能使它进行。,2020/8/12,辅导答疑 10.20,10.20 有一酸催化反应,在速率方程中对酸催化剂呈一级,这是几级反应?,答:从速率方程看应该属于三级反应,k的单位是浓度-2时间-1。但是,在反应过程中,催化剂的浓度不变,可以并入速率常数项中,所以按准二级反应处理。 r = k AB k = k H+,
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
