 高分子化学线型缩聚动力学PPT精选文档
高分子化学线型缩聚动力学PPT精选文档


《高分子化学线型缩聚动力学PPT精选文档》由会员分享,可在线阅读,更多相关《高分子化学线型缩聚动力学PPT精选文档(22页珍藏版)》请在装配图网上搜索。
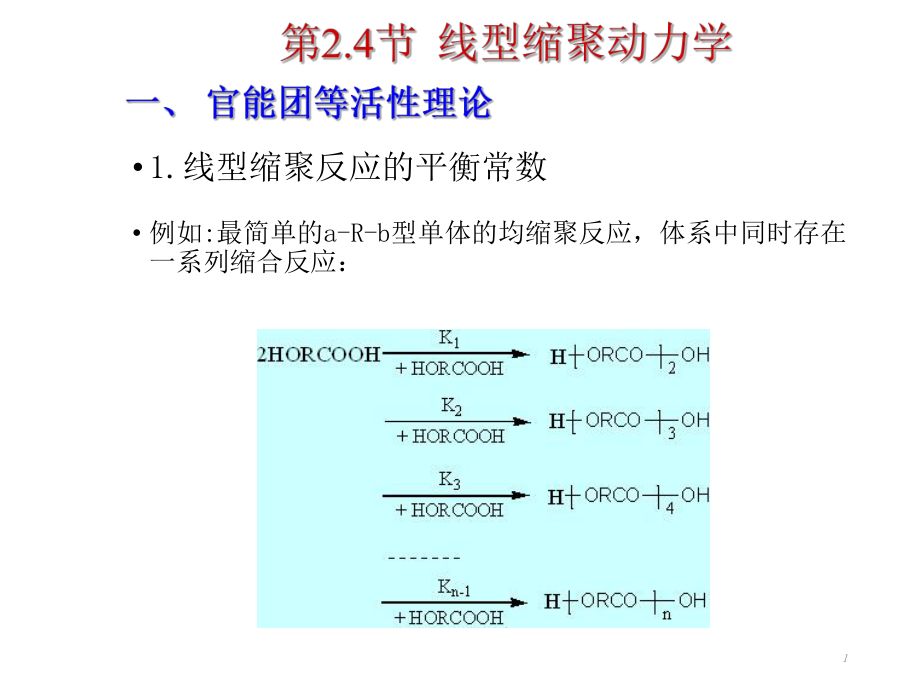
1、11.线型缩聚反应的平衡常数 例如:最简单的a-R-b型单体的均缩聚反应,体系中同时存在一系列缩合反应:2 可见,要生成聚合度为可见,要生成聚合度为n n的聚合物实际上的聚合物实际上需要经过需要经过(n-1)(n-1)?步连续的缩合反应过程。而且步连续的缩合反应过程。而且每一步反应都应该有一个平衡常每一步反应都应该有一个平衡常?数,并依次数,并依次为为K Kl l,K K2 2,K K3 3,K Kn-ln-l,共有,共有(n-1)(n-1)个平衡常个平衡常数。数。3 Flory提出了官能团等活性理论:不同链长的端基官能团,具有相同的反应能力和参加反应的机会,即官能团的活性与分子的大小无关1)
2、在碳链增长后,)在碳链增长后,诱导、共轭效应诱导、共轭效应等对官能团等对官能团的活性作用减弱,因而官能团活性相近。的活性作用减弱,因而官能团活性相近。2)官能团的活性与基团的碰撞频率有关,不决)官能团的活性与基团的碰撞频率有关,不决定于整个大分子的扩散速率。定于整个大分子的扩散速率。44.4.3 线型缩聚动力学以二元酸和二元醇的聚酯化反应为例51)不可逆条件下的线型缩聚反应动力学 缩聚反应不断排出低分子副产物情况下,符合不可逆条件。酯化或聚酯化是酸催化反应,机理如下:第一步 羧酸先质子化:C OH+HAk1OC OHOH+k2+A-6第二步 质子化种与醇反应成酯:聚酯化每一步反应是可逆平衡反应
3、,考虑实际,要获得高分子量产物,须使反应向聚合物方向移动,例如在减压条件下,不断脱除副产物水,可以认是不可逆反应。k5C OO+H2O+H+C O HO H+HOk3k4C O HO H+O H7k3是最慢的一步反应,由于不可逆,k4暂不考虑,聚酯反应速率用羧基消失速率来表示:C+(OH)2是质子化羧基的浓度,难以确定,设法消去,令+=AkHACOOHk)OH(C212)(23OHOHCkdtCOOHdRp(7-5)代入代入式式(7-57-5)AkHAOHCOOHkkdtCOOHd231=(7-7)HACOOHA)OH(CkkK221+=,(7-6)8考虑催化用酸HA的离解平衡+HAH+A-代
4、入式(代入式(7-7)得:)得:HAAHKHA+=(7-8)HAKHAHA+=HA231KkHOHCOOHkkdtCOOHd=(7-9)式式(7-9)(7-9)表明:聚酯反应属于三分子反应,即涉表明:聚酯反应属于三分子反应,即涉及羧基、羟基和质子三个参加反应的主体。及羧基、羟基和质子三个参加反应的主体。9为了加速反应,常外加酸作为聚酯化反应的催化剂反应速率将由自催化和酸催化两项组成:整个缩聚过程中,作为催化剂H+不变,而酸催化反应速率常数项 kaH+kC,kC略去,并令k=kaH+,则酸与醇等当量时,式(7-14)简化为:l?(1)?2a3CHkkCdtdC+=2aC)HkkC(dtdC+=2
5、C kdtdC=10t kC1C10=1110tCkp10tCkXn反应程度与时间(反应程度与时间(11图图4-4 对甲苯磺酸催化己二酸与二元醇缩聚反应动力学曲线对甲苯磺酸催化己二酸与二元醇缩聚反应动力学曲线 12外加酸催化的聚酯反应基本符合二级反应规律,聚合度与单体起始浓度和反应时间 t 是线性关系,即随反应时间增加而线性增长,由直线的斜率可以求kk有实验数据证明当P(或聚合度)在一定范围内,1/(1-P)t的线性关系良好,这也证明了官能团等活性的假定是正确的。工业生产总是以外加酸作催化剂来加速反应13(2)自催化聚酯化动力学 在无外外加酸的情况下,二元酸单体作催化剂。但有机羧酸电离度较少,
6、特别是随着聚合度的提高,体系将从少量电离逐步趋向不电离,催化作用减弱,情况比较复杂,分两种情况分析。14 A.羧酸不解离 缩聚物增长到较低的聚合度,就不溶于水,末端羟基就难电离出氢离子,但聚酯化反应还可能缓慢进行,推测羧酸经双分子络合如下式,起到质子化和催化作用。无外加酸,二元酸单体作催化剂,HA=COOH 羧基与羟基浓度相等,以C表示,将式(7-9)中的所有常数及A合并成 k表明自催化的聚酯反应呈三级反应分离变量,积分得分离变量,积分得3kCdtdC=t k2C1C1202=式中:式中:C、C0时间时间t和和?起始起始t=0的的15由反应程度由反应程度01NNp羧基数用羧基浓度羧基数用羧基浓
7、度C代替代替反应程度与时间反应程度与时间(12)1(1202tkCppXn11将聚合度与反应程度的关系式将聚合度与反应程度的关系式12)202(tkCXn16nX表明:表明:自催化的聚酯反应是涉及三个反应主体自催化的聚酯反应是涉及三个反应主体分子分子(二分子羧酸和一分子醇二分子羧酸和一分子醇)的三级反应。的三级反应。生成聚合物的聚合度生成聚合物的聚合度 的平方与反应时的平方与反应时间间t t成正比。成正比。?17 单体和聚合度很低的初期聚合物,有小部分羧酸可以电离出氢离子,参与质子化。由 得AHHA-K123-232325tkcXkcdtdcon如果成线性关系,则可判断属于二级半反应。182)
8、nX(2)nX(19图图4-3 己二酸自催化与四种二元醇得缩聚反应动力学曲线己二酸自催化与四种二元醇得缩聚反应动力学曲线1)癸二醇,)癸二醇,202C;2)癸二醇,)癸二醇,191C;3)癸二醇,)癸二醇,161C;4)二缩乙二醇,)二缩乙二醇,166C20当P0.8后,速率常数趋于稳定,遵循式2-7的线性关系。可以根据1/(1-p)2-t图的斜率,求得个反应温度下的速率常数k,由Arrhenius式求取频率因子和活化能。21 2.聚酯反应净速率是正、逆反应速率之差COOHHOk1k-1+C OO+H2O()2121C1kCkdtdC=22水部分排出时的总速率引入平衡常数:K k1/k1,k1=k1/K,代入上两式11N0000CCCCNNppC1:()W121nC1kCkdtdC=Kpnpkdtdpw211Kppkdtdp221 1
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
