 《电厂化学基础》PPT课件.ppt
《电厂化学基础》PPT课件.ppt


《《电厂化学基础》PPT课件.ppt》由会员分享,可在线阅读,更多相关《《电厂化学基础》PPT课件.ppt(35页珍藏版)》请在装配图网上搜索。
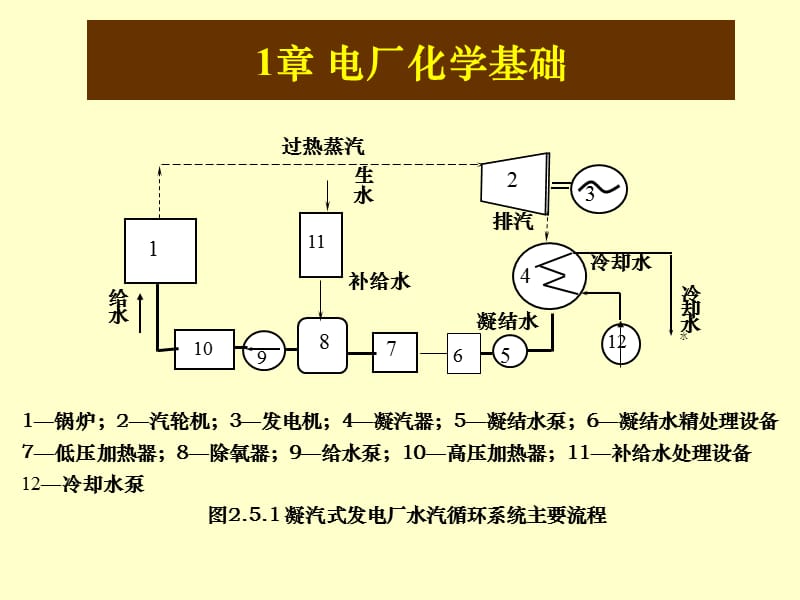
1、1章 电厂化学基础,1锅炉;2汽轮机;3发电机;4凝汽器;5凝结水泵;6凝结水精处理设备 7低压加热器;8除氧器;9给水泵;10高压加热器;11补给水处理设备 12冷却水泵 图2.5.1 凝汽式发电厂水汽循环系统主要流程,过热蒸汽,生 水,补给水,凝结水,冷却水,冷却 水 水,排汽,1,10,8,11,11,2,4,12,7,5,9,2,3,给水,6,第1章 电厂化学基础,1.1 物质的组成 1.2 化学反应及反应方程式 1.3 酸、碱、盐、氧化物及配合物 1.4 反应速度与化学平衡 1.5 弱电解质的电离平衡 1.6 缓冲溶液 1.7 盐类的水解 1.8 沉淀的溶解平衡及溶度积 1.9 理想
2、气体 1.10 液体 1.11 拉乌尔定律和亨利定律,1.1物质的组成,物质由分子组成。分子不带电。 分子由原子组成。原子不带电。 原子由原子核和电子组成。 原子核由质子和中子组成。中子不带电。 一个质子带有一个单位正电荷。 一个电子带有一个单位负电荷。 原子是电中性的。所以原子中质子的数目等于电子的数目。元素 元素是具有相同质子数(核电荷数)的一类原子的总称。 碳元素就是所有各种碳原子的总称。 元素和原子的区别是: 元素是一种总称,为不可数的名称, 而原子则是可数的。 同位素 具有相同的质子数而原子量(中子数)不同的同种元素的几种原子,叫做该元素的同位素。 例如,6C12 、6C13 、6C
3、14这三种原子中,都是由碳元素组成的,它们的原子核中质子数相同,都为6,但中子数分别为6、7、8,象这样的几种原子就是C元素的三种同位素。,1.元素及同位素,2.相对原子质量和相对分子质量,碳元素中一个6C12 的原子质量=1.99271023g,数值非常小,用起来很不方便,就好比用吨来表示一粒芝麻的质量一样。 为了使用方便,国际上统一规定:将一个6C12原子质量的1/12为“统一原子质量单位”,其它一个原子的质量是“统一原子质量单位”的多少倍就是该原子的相对原了质量。 如1H1其一个原子的质量是“统一原子质量单位”的1.00797倍,所以它的相对原子质量为1.00797。通常所说的相对原子质
4、量,实际上是某种元素所含有的各同位素的加权平均值。 相对分子质量:一个分子中各原子的相对原子质量的总和叫做相对分子质量(过去叫分子量)。由于相对原子质量没有单位,所以相对分子质量也无单位。,3.分子式的意义,分子是能够独立存在并保持物质化学性质的最小微粒 。 分子式表示如下五种意义: 表示物质的一个分子; 表示物质由哪些元素组成; 表示物质的一个分子中所包含各元素的原子数目; 表示物质的分子里各元素的质量比; 表示物质的相对分子质量。,物质的量是表示构成物质的基本单元的数目量,用n表示。单位名称是摩尔,符号为mol。1mol物质究竟含有多少基本单元数呢?国际单位制中规定:1mol任何物质所含的
5、基本单元数与0.012kg碳12中所含的原子数目相等,即(6.0231023个/mol) 。基本单元可以是原子、分子、离子、电子及其它微粒或者是这些微粒的特定组合体。 摩尔质量:每摩尔物质的质量叫做该物质的摩尔质量。 单位是g/mol。用符号M表示。在数值上摩尔质量等于其相对基本单元的式量。例如:氧气(O2)的相对分子质量为32,O2的摩尔质量M(O2) =32g/mol,而1/2O2的摩尔质量M(1/2O2)=16g/mol; M(1/2Ca2+)=20g/mol ; 水(1/2H2O)=9.0 g/mol ;M(1/3Fe3+)=18.7 g/mol,4.物质的量及其单位,解:NaCO3的
6、相对分子质量223+12+316=106 , M( NaCO3) =106 g/mol 1/2NaCO3的相对分子质量=53, M(1/2NaCO3)=53 g/mol n(NaCO3)=53g106g/mol=0.5mol, n (1/2NaCO3)=53g53g/mol=1mol 答: 53g碳酸钠用NaCO3 基本单元表示的物质的量为0.5mol,用1/2NaCO3基本单元表示的物质的量为1mol。,5. 溶液浓度的表示方法,质量分数 wB =mB/m 它表示单位质量的溶液中含有溶质B的质量, 质量浓度 B = mB/V ( g/L、mg/L、g/L)。 它表示单位体积的溶液中含有溶质的
7、质量 体积比浓度 (VB+VA) 它表示溶质B与溶剂A按VB+VA的体积关系配制而成。 物质的量浓度 Cb =nB/V(mol/L) 单位体积溶液中含溶质B的物质的量称为物质的量浓度。,解:标准溶液要求浓度准确,碳酸钠摩尔质量的有效数字应与浓度一样达到四位,即 M(1/2NaCO3)=(22.992+12.00+16.003)/2=52.99(g/mol) 由式cB=nB/V= (m/MB)/V 可得 m= cB MBV0.1000mol/L52.99g/mol1L=5.299g 答:需称取5.299g基准无水碳酸钠。 例1.1.3 配制(1+3)的硫酸溶液500mL需浓硫酸和水各多少mL?
8、解:该溶液中浓硫酸和水的体积共份,其中浓硫酸占1/4,水占3/4,所以,需浓硫酸:5001/4=125mL; 需水:500mL125mL=375mL,1.2 化学反应及反应方程式,1 化学基本定律 定组成定律(即定比定律):任何化合物都有固定的组成,即每一个化合物的分子,其组成元素、重量都有一定的比例。 质量守恒定律(即物质不灭定律):质量守恒定律表示发生化学反应时,反应物的总质量等于产物的总质量。即反应前后原子的种类和数目都不发生变化。 等物质的量相等原则:各物质相互反应时,其质量比等于相对分子质量比,也就是物质相互作用时物质的量相等。,2 .化学反应方程式类型,在火力发电厂常用到的一些反应
9、类型: 置换反应:单质的原子代替化合物分子中另一原子的反应。如铁受盐酸的腐蚀 : Fe + HCI = FeCI2 + H2 化合反应 : 两种或两种以上的物质互相化合生成一种化合物的反应。如:生石灰和水的反应: CaO + H2O = Ca(OH)2 分解反应: 一种化合物分解成两种或两种以上的新物质的反应。如: Ca(HCO3)2= CaCO3+CO2 +H2O 复分解反应:由两种化合物互相反应,彼此交换成分,生成几种新物质的反应。如: H2SO4+Na2CO3= Na2SO4+H2O+CO2 氧化还原反应:在反应过程中,元素的化合价发生变化的反应。如: Fe+ O2=FeO ;Na2SO
10、3+O2= 2Na2SO4 离子反应方程式:有离子参加的反应称之。(在水溶液中进行的) H+CO32=H2O+CO,3.根据化学反应方程式进行计算,例1: 锅炉在化学清洗前需先做垢样分析,称取垢样10.0g放到称重为20.4g的烧杯中,加入8%的盐酸150.0g,反应中有大量气泡,说明垢样中含有碳酸钙水垢,待垢样充分溶解,气泡消失后,称得总质量为177.4g,求该垢样中所含碳酸钙的质量及理论上为使碳酸钙全部分解所消耗盐酸的质量。 解: CaCO3 + 2HCI = CaCI2 + H2O + CO2 根据等物质量的规则:n(CaCO3)= n(CO2) mCO2=(150.0+20.4+10.
11、0) 177.4=(180.4177.4)g=3g n(CO2)=344= n(CaCO3)= x/100 x=6.8g n(1/2CO2)=n(HCI)=322=x/36.5 x=4.98g=5.0g 答:垢样中含碳酸钙水垢为6.8克;理论上消耗纯盐酸为5.0克。,1.3 酸、碱、盐、氧化物及配合物,酸:凡是在水溶液中电离出来的阳离子全部是H+的化合物称为酸。 碱:凡是在水溶液中电离出来的阴离子全部是OH的化合物称为碱。 盐:凡是在水溶液中电离时生成金属离子酸根的化合物称为盐。 氧化物:由氧和另一种元素组成的化合物称为氧化物。 碱性氧化物:凡能与酸起反应生成盐和水的氧化物称为碱性氧化物。 酸
12、性氧化物:凡能与碱起反应生成盐和水的氧化物称为酸性氧化物。 两性氧化物:既能与酸反应又能与碱反应生成盐和水的氧化物称为两性氧化物。,配位化合物:由一个简单的阳离子与一定数目的中性分子或阴离子以配位健结合而成的离子 称为配位离子(或配离子) ;含有配离子的化合物叫配位化合物(简称配合物);简单的阳离子称为中心离子; 一定数目的中性分子或阴离子称为配位体。 配位键:由一个原子单独提供一对电子而与另一原子共用所形成的化学键称为配位键,配位化合物由内界和外界两部分组成,内界就是配离子,常用方括号括起来。与配离子化合的,即方括号以外的为外界。例如,在硫酸四氨合铜Cu(NH3)4SO4中,Cu(NH3)4
13、2+是配离子,为内界,其中Cu2+为中心离子,与中心离子以配位键结合的配位体的数目称配位数。NH3是配位体,中心离子的配位数为4;SO42为外界。,KAl(SO4)212H2O? 不是配合物,因它在水中全部电离成简单离子。,1. 4 反应速度与化学平衡,1. 质量作用定律: 反应速度与反应物浓度的幂次方乘积成正比,方次为对应物质的计量系数。这就是质量定律。 = kAaBb 2.可逆反应: aA+bB cC +dD 正= k正AaBb 逆= k逆CcDd 正=逆 K =k正/ k逆=CcDd/ AaBb 3.平衡常数: K = CcDd/ AaBb 平衡常数表达式,反应物的浓度: Ba2+ +S
14、O42 BaSO4 增加Ba2+ 的浓度可以使SO42 沉淀完全 压力: 2NO2 N2O4 棕红色 无色 增加压力颜色变浅, 减小压力颜色变深 温度: 此反应为放热反应升高温度颜色变深, 降低温度颜色变浅。,4. 影响化学平衡移动的因素,1. 氨水的电离平衡(25) NH3H2O NH4+ + OH Kb= NH4+ OH/ NH3H2O =1.8105 OH= KbNH3H2O / NH4+ 两边取负对数:lg OH= lgK b lgNH3H2O /NH4+ pOH = pKb + lg(NH4+ / NH3H2O ) 2. 醋酸的电离平衡(25) HAc H+ + Ac Ka= H+
15、Ac/ HAc =1.8105 pH=pKa + lg(Ac / HAc ) 3. 碳酸的电离平衡: (25) 第一级电离 H2CO3 H+ + HCO3 K1=4.45107 第二级电离 HCO3 H+ +CO32 K2=4.681011 pH=p Ka + lg(HCO3 / H2CO3 ),1.5 弱电解质的电离平衡,5. 水的离子积常数及pH值,水是一种极弱的电解质:H2O H+ +OH。 其电离平衡常数为:K= H+ OH/H2O 由于水的电离度极小,H2O可视为不变的定值,在一定温下KH2O可视为常数,该常数称为水的离子积常数,常用KW表示: KW= H+ OH =1.01014
16、实验测得在中性溶液中 H+ =OH =1.0107(mol/L) 将式(1)两边取负对数: lgKW= lg H+ lgOH =lg1.01014 并定义: pKW = lgKW ;pH=lgH+ ; pOH=lgOH pKW= pH + pOH = 14,配合物的内界和外界以离子键相结合。在水中全部电离。 硫酸四氨合铜 :Cu(NH3)4SO4Cu(NH3)42+ SO42 配离子是弱电解质,在水中存在电离平衡: Cu(NH3)42+ Cu2+ + 4NH3 K不稳=(Cu2+NH34)/ Cu(NH3)42+ K稳=1/ K不稳= Cu(NH3)42+/(Cu2+NH34) K稳值越大,说
17、明配离子稳定性越高。,1. 5. 配合物在水溶液中的电离,1.6 缓冲溶液,1.同离子效应 弱电解质在溶液中存在着电离平衡,如果在此溶液中加入一种含有与此弱电解质相同离子的强电解质,则此弱电解质原来的电离平衡就会被破坏,电离度也会因电离平衡的移动而发生变化。例如,氨水是弱碱,其电离平衡为: NH3H2O NH4+ +OH 氯化铵是强电解质,在溶液中全部电离生成NH4+ 和OH,如果把氯化铵加入到氨水中,则氨水的电离平衡会由于NH4+浓度的增加而朝着生成NH3H2O方向移动,结果是氨水的电离度降低,从而使溶液中的OH浓度降低。像这种在弱电解质溶液中,由于加入了相同离子的强电解质,从而使电离平衡发
18、生移动的现象,称为同离子效应。,2. 缓冲溶液,在氨水中加入一定量的氯化铵后,由于同离子效应,不仅使氨水的电离度降低,更重要的是能使溶液中的pH值,在一定范围内不受加入少量酸、碱和溶液稀释的影响而保持相对稳定。像这种在一定程度上能抵御少量外来酸、碱或稀释的影响,使溶液的pH值不发生改变的作用,称为缓冲作用;具有缓冲作用的溶液称为缓冲溶液。缓冲溶液的种类很多: 如醋酸与醋酸钠(HAc+NaAc)混合溶液, 其pH值通常小于7。 如氨水与氯化铵(NH3+NH4CI)混合溶液其pH值通常大于7 如磷酸二氢钠与磷酸氢二钠(NaH2PO4 +Na2HPO4)混合液。,3.缓冲溶液pH值的计算,NH4CI
19、 NH4+ +CI NH3H2O NH4+ +OH 盐 平衡时 弱碱 盐 OH K弱碱=盐OH/ 弱碱 pK弱碱= pOH+lg 盐/ 弱碱 pH=14pK弱碱+lg弱碱/ 盐 弱碱及其盐组成的缓冲溶液的pH值的 一般计算公式为: pH=14pK弱碱+lg弱碱/盐 同理,弱酸及其盐组成的缓冲溶液的pH值的一般计算公式为: pH=pK弱酸lg弱酸/盐,将20g氯化铵加适量除盐水溶解,再加150mL浓度为13.5mol/L 的浓氨水(密度为0.88g/mL,含NH326%),然后稀释至1L。 求此缓冲溶液的pH值. 解:NH4CI的摩尔质量为53.3g/mol, NH4+ = NH4CI=20g5
20、3.5 g/mol/1L=0.4 mol/L NH3= 13.5mol/1000mL 150mL1L=2.0 mol/L pKNH3=4.75将上述数据代入式 pH=14pKNH3+lgNH3/ NH4+ =144.75+lg(2.0/0.4)=9.95,NH3+NH4CI缓冲溶液pH值的计算,如醋酸钠(CH3COONa)水解,在水中它全部电离,电离出的CH3COO与水电离出的H+反应生成难电离的CH3COOH分子,溶液中有过剩的OH,因此溶液呈碱性。 总的离子方程式为:H2O+ CH3COO= CH3COOH + OH 弱碱强酸生成的盐: 如氯化铵(NH4CI)水解,NH4CI在水中全部电离
21、,电离出的 NH4+与水电离出的OH反应生成难电离的NH3H2O分子,溶液中有过剩的H+,因此溶液呈酸性。 总的离子方程式为:NH4+H2O=NH3H2O+ H+ 弱酸弱碱生成的盐水解: 溶液的酸碱性由组成盐的弱酸和弱碱的相对强弱来决定。若弱酸的电离常数大于弱碱的电离常数,则溶液呈酸性;反之,呈碱性。若弱酸与弱碱的电离平衡常数较接近,就呈中性,如CH3COONH4水解, 溶液呈中性。 弱酸强碱生成的盐水解:,1.7 盐类的水解,已知H3PO4在水溶液中的分级电离及25时的电离常数为: 第一级电离:H3PO4= H+H2PO4 k1=7.5103 第二级电离:H2PO4= H+HPO42 k2=
22、6.2108 第三级电离:HPO42= H+PO43 k3=4.41013 解:(1) 求Na3PO4的水解平衡常数(kh)。Na3PO4的水解方程式为: PO43H2O =HPO4 +OH kh(HPO4OH)PO43H2O 在稀溶液中,H2O;OH= K W/H+代入上式,得 kh(HPO4K WH+PO43 即 khK W(H+PO43(HPO4) 式中分母为H3PO4的第三级电离常数。 所以 khK Wk3 kh1014/4.41013=2.3102 (2) 求pH值。 kh=(HPO4OH)PO432.3102 HPO4OH, PO43OHPO43 OH= khPO430.012.3
23、102=2.3104(mol/L) OH=1.5102 H+ =1014/1.5102=6.61013, pH=12,1.8. 沉淀与溶解平衡,溶解度: 在一定温度下每100克水中溶解溶质的最大克数,称为该温度下此溶质在水中的溶解度。 溶度积: 难溶物质(如AgCI)在水中溶解达平衡时,各离子浓度的乘积等于其平衡常数。这个平衡常数称为溶度积常数,简称溶度积,用KSP表示。 即KSP(AgCI)=Ag+CI 。 溶解度规则:当溶液中Ag2+ CI KSP时,为过饱和溶液,应有沉淀析出,直至离子浓度之积达KSP 。,例1.8.1 测得某水样中含有Ca2+ =80.0mg/L; Mg2+ =28.8
24、mg/L; SO42=105.6 mg/L;CO32=0.8mmol/L; OH= 2.8mmol/L。 25时相关物质的溶度积常数为:KSP(AgCI)=1.81010;KSP(CaSO4)=6.1105; KSP(CaCO3)=4.8109 ; KSP(Ca(OH)2)= Ca2+ OH2 =3.1105;KSPMg(OH)2= Mg2+ OH2= 5.01012。 问此温度下是否有沉淀析出?,解:先把各离子浓度换算为以mol/L表示, Ca2+ =(80/40)103=2.0103(mol/L); Mg2+ =(28.8/24) 103=1.2103(mol/L); SO42=(105.
25、6 /96) 103 =1.1103 (mol/L); CO32=0.8mmol/L=0.8103 (mol/L); OH= 2.8mmol/L=2.8 103 (mol/L)。 各物质的离子积为: Ca2+ CO32=2.01030.8103=1.6106 KSP(CaCO3) 有沉淀析出; Ca2+ CO42=2.01031.1103=2.2106 KSP(CaCO3) 有沉淀析出。 答:溶液中会有碳酸钙和氢氧化镁沉淀析出。,1.9 理想气体,理想气体:分子之间的作用力可以忽略不计,分子本身的体积为零的气体。 pV = nRT 道尔顿分压定律:混合气体的总压力等于其中各组分气体的分压力之和
26、。该经验定律称为道尔顿分压定律,其数学表达式为: pp1+p2+p3+pipi pipninyi yi 表示组分i的浓度用量分数表示:,T=273.15+20=293.15K P=1.013107Pa代入式n = pV/RT =1.013107Pa0.03m3/8.314Jmol1K1293.15K=124.69mol 氮气的摩尔质量为28gmol1, rn=nM=124.69mol28gmol13.49103g。 答:钢瓶内氮气的物质的量为124.69mol,质量为3.49103g。,例1.9.1 某氮气钢瓶的容积为30.00L,当温度为20时,测得瓶内的压力为1.013107Pa,试计算钢
27、瓶内的氮气的物质的量和质量。,1.10 液体的性质,饱和蒸气压 一定温度下,在一个密闭容器中,当液体的蒸发速度与冷凝速度相等时,液体与其蒸气之间达到动态平衡,此时的蒸气称为饱和蒸气,该饱和蒸气具有的压力称为饱和蒸气压,简称为蒸气压。温度升高蒸汽压增大。 沸点: 当液体的蒸气压等于外压时的温度称为液体的沸点。外压升高,沸点升高。 溶点: 在一定的外压下,纯物质的固态与其液态成平衡时的温度称为固态物质的熔点或称该液态物质的凝固点,1.11.拉乌尔定律和亨利定律,拉乌尔定律: 在一定温度下,当稀溶液与其蒸气达平衡时,溶剂A的蒸气压pA等于同温度下纯溶剂的蒸气压p*A乘以其在液相中的物质的量分数xA。
28、这就是拉乌尔定律,其数学表达式为:pA= p*AxA 亨利定律: 一定温度下,稀溶液中挥发性溶质在平衡气相中的分压pA与溶质在溶液中的浓度成正比。 pB=kxB 式中k称为亨利常数。其单位为(压力浓度1)。其物理意义是:单位浓度时的溶质的分压。 分配定律: 实验证明:在一定的温度、压力下,当某组分在共存的两种不互溶的物质相间分配达平衡时,若该组分在所形成的两相中的浓度不大,则该组分在两相中的浓度之比为一常数。这就是分配定律。KB=c/c,1.12.稀溶液的依数性质,稀溶液中溶剂的蒸气压下降:pA=pA- p*A= p*AxB 稀溶液的凝固点降低:(条件:析出固态纯溶剂)Tf = KfbB 稀溶
29、液的沸点升高:(条件:溶质不挥发) Tb = KbbB 稀溶液的渗透压: =cBRT,稀溶液的渗透压 在一定温度下用一个只能使溶剂透过而不能使溶质透过的半透膜把纯溶剂与溶液隔开,那么,溶剂就会通过半透膜渗透到溶液中使溶液的液面上升,直到溶液液面升到一定高度达到平衡状态,渗透才停止,如图1.11.3(a)所示。此时溶液的液面比纯溶剂的液面高出h。这种对于溶剂的膜平衡叫做渗透平衡。渗透平衡时,溶剂液面和同一水平的溶液截面上所受的压力差值等于gh, 这就是稀溶液的渗透压。表示平衡时溶液的密度,g是重力加速度,h是溶液与纯溶剂液面高度差。任何溶液都有渗透压,如果没有半透膜把溶剂和溶液隔开,渗透压无法体
30、现。测定渗透压的一种方法,是在溶液一侧施加一额外压力,发生反渗透,使纯溶剂和稀溶液的液面一样高,此额外的压力即为渗透压,,如图1.11.3(b)所示。,例1.11.1 测得30是时蔗糖水溶液的渗透压为252.0kPa,试求: (1) 溶液中蔗糖的质量摩尔浓度bB; bB = nB/mA即1kg溶剂中含溶质的物质的量。 (2) 沸点升高值Tb; (3) 凝固点降低值Tf。 解:(1)由式=cRT 故 cB=/RT= (252.0103/8.314303.15) molm3 =100 molm3 在稀溶液中由于溶质的量很小,因此,溶液的体积近似看成是纯溶剂水的体积,且水的密度近似为1kg/L这样cB=bB,于是bB=(100/1000)molkg1=0.1molkg1。 (2)由表2.3.2查得Kb=0.52 Kmol1kg Tb = KbbB=0.520.1K=0.052K (3)由表2.3.1查得Kf=1.86 Kmol1kg Tf = KfbB=1.860.1K=0.186K,
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
