 物质的量人教版知识精讲
物质的量人教版知识精讲


《物质的量人教版知识精讲》由会员分享,可在线阅读,更多相关《物质的量人教版知识精讲(8页珍藏版)》请在装配图网上搜索。
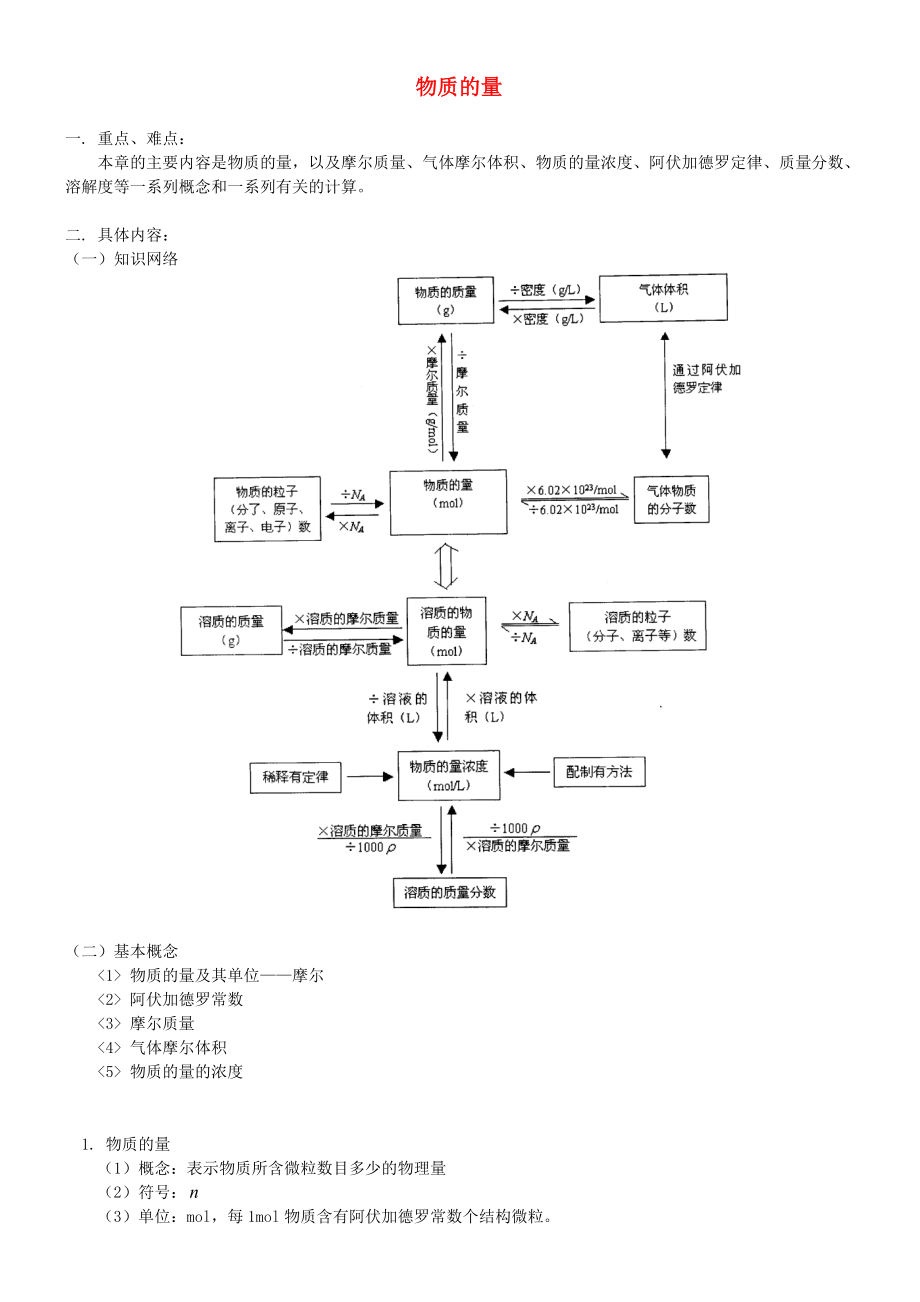
1、物质的量一. 重点、难点:本章的主要内容是物质的量,以及摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗定律、质量分数、溶解度等一系列概念和一系列有关的计算。二. 具体内容:(一)知识网络(二)基本概念 物质的量及其单位摩尔 阿伏加德罗常数 摩尔质量 气体摩尔体积 物质的量的浓度1. 物质的量(1)概念:表示物质所含微粒数目多少的物理量(2)符号:(3)单位:mol,每1mol物质含有阿伏加德罗常数个结构微粒。 当描述物质的物质的量(使用mol)时,必须指明物质微粒的名称,不能是宏观物质名称。 常见的微观粒子有:分子、原子、离子、电子、质子、中子或它们特定的组合。 mol只是物质的量的单位,没
2、有摩尔数这一概念。 每mol物质含有阿伏加德罗常数个微粒。2. 阿伏加德罗常数(1)含义:实验测定12g12C中碳原子的个数(2)符号:NA(3)单位:mol1(4)说明: NA的基准是12g碳-12中的原子个数 12C不仅是摩尔的基准对象,而且还是相对原子质量的基准 NA是一个实验值,现阶段常取6.021023作计算 要注意NA与6.021023的区别3. 摩尔质量(1)概念:单位物质的量的物质的质量(2)符号:(3)单位:gmol1(4)说明: 使用范围:A. 任何一种微观粒子B. 无论是否纯净C. 无论物质的状态 与式量的比较: 与1mol物质的质量的比较:4. 气体摩尔体积(1)概念:
3、单位物质的量的气体的体积(2)符号:(3)单位:Lmol1(4)标准状况下的气体摩尔体积 标准状况:0、1atm即1.01105Pa 理想气体:A. 不计大小但计质量。B. 不计分子间的相互作用。 标准状况下的气体摩尔体积:约22.4Lmol1(5)影响物质体积大小的因素: 构成物质的微粒的大小(物质的本性) 结构微粒之间距离的大小(温度与压强来共同决定) 结构微粒的多少(物质的量的大小)5. 物质的量浓度(1)概念:用单位体积的溶液中溶解溶质的物质的量的多少来表示溶液的浓度(2)符号: (3)单位:molL1(4)说明: 物质的量浓度是溶液的体积浓度 溶液中的溶质既可以为纯净物又可以为混合物
4、,还可以是指某种离子或分子。(四)阿伏加德罗定律及其推论(1)标准状况下的气体摩尔体积 标准状况是指:0和1.01105Pa 标准状况下1mol任何气体的体积都约为22.4L(2)气体摩尔体积 温度和压强一定时,1mol任何气体的体积都约为一个定值 说明了温度和压强以及气体的物质的量共同决定了气体的体积,而气体分子本身的大小对气体体积的影响很小 气体摩尔体积比标准状况下气体摩尔体积的范围广(三)阿伏加德罗定律1. 内容:同温同压下相同体积的任何气体都具有相同的分子数说明:(1)阿伏加德罗定律依然是忽略了气体分子本身的大小(2)阿伏加德罗定律比气体摩尔体积的应用更为广泛: 主要是应用于不同气体之
5、间的比较,也可以同一种气体的比较 被比较的气体既可以是纯净气体又可以是混合气体2. 阿伏加德罗定律的重要的四个推论(1)同温同体积时,任何气体的压强之比都等于其物质的量之比,也等于其分子数之比(2)同温同压时,任何气体的体积之比都等于其物质的量之比,也等于其分子数之比(3)同温同压同体积时,任何气体的质量之比都等于其摩尔质量之比,也就是其式量之比(4)同温同压同体积时,任何气体的密度之比都等于其摩尔质量之比,也就是其式量之比(四)有关计算关系1. m、n、N之间的计算关系(1)计算关系:=(2)使用范围:只要物质的组成不变,无论是何状态都可以使用2. V、n、N之间的计算关系(1)计算关系:=
6、(2)使用范围: 适用于所有的气体,无论是纯净气体还是混合气体 当气体摩尔体积用22.4Lmol1时,必须是标准状况3. c、m、V、N之间的计算关系(1)计算关系:(2)使用范围: 以上计算关系必须是在溶液中使用 微粒数目是指某种溶质 若溶液是由气体溶解于水形成的,要特别注意以下几点:A. 必须根据定义表达式进行计算B. 氨水中的溶质主要是NH3H2O,但要以NH3为准计算C. 溶液的体积不能直接用气体的体积或水的体积或气体与水的体积之和,而必须是通过计算得到4. c、%、之间的计算关系(1)计算关系:(2)使用范围:同一种溶液的质量分数与物质的量浓度之间的换算(3)推断方法: 根据物质的量
7、浓度的定义表达式 溶质的物质的量用计算 注意溶液体积的单位5. 分子量的有关计算(1)标准状况下mgA气体的体积为V升,求A的相对分子质量M=(2)标准状况下A气体的密度为g/L,求A的相对分子质量使用说明: 适用于所有的物质,不受物质状态的限制,也适用于所有的混合物 所有物质:,标准状况下气体 某有机物气体在同温同压下对氢气的相对密度为2.69,求该气体的式量。 使用说明:A. 相对密度是在同温同压下两种气体的密度之比 B. 既可以用于纯净气体之间的计算,也可以用于混合气体之间(3)平均相对分子质量有a mol A气体,与b mol B气体混合,则混合气体的平均式量为 M() =(4)阿伏加
8、德罗推论同温同压同体积时,任何气体的密度之比都等于其摩尔质量之比,也就是其式量之比(五)溶解度1. 知识网络2. 基本概念:(1)饱和溶液:一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液。(2)溶解度(S):一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。3. 影响溶解度的因素(1)溶质的本身性质:相似相溶(2)温度固体或液体溶质:随温度的升高,溶解度增大(多数)随温度的升高,溶解度减小(极少数)气体溶质:随温度的升高,溶解度减小随压强的升高,溶解度增大4. 计算在一定温度下某物质的饱和溶液里存在着下述正比例关系:
9、【典型例题】例1 用NA表示阿伏加德罗常数,下列叙述中正确的是( )A. 0.1molL1稀硫酸100mL中含有硫酸根个数为0.1NAB. 1molCH3+(碳正离子)中含有电子数为10NAC. 2.4g金属镁与足量的盐酸反应,转移电子数为 2NAD. 12.4g白磷中含有磷原子数为0.4NA例2 阿伏加德罗常数约为6.021023mol1。下列叙述中正确的是( ) A. 标准状况下,2.24L苯中约含有3.612x1023个碳原子B. 常温常压下,氧气和臭氧的混合物16g中约含有6.021023个氧原子C. 25时,1 L pH=13的氢氧化钠溶液中约含有6.02l023个氢氧根离子D. 0
10、.5mol CH4中约含有3.011024个电子 例3 依照阿伏加德罗定律,下列叙述中正确的是( )A. 同温同压下两种气体的体积之比等于摩尔质量之比B. 同温同压下两种气体的物质的量之比等于密度之比C. 同温同压下两种气体的摩尔质量之比等于密度之比D. 同温同体积下两种气体的物质的量之比等于压强之比例4 同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内的气体一定具有相同的( )A. 质量 B. 原子总数 C. 碳原子数 D. 密度变式1:两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同的()A. 原
11、子总数 B. 质子总数 C. 分子总数 D. 质量变式2:将“变式1”中的NO改为NO2以后,答案是什么呢?()例6 下列关于固体溶解度的说法中正确的是( ) A. 在一定温度下,某固态物质在100g溶剂里溶解的质量B. 在一定温度下,某固态物质的100g饱和溶液里所溶解该物质的质量C. 某物质在100g溶剂里达到饱和状态时所溶解的质量D. 在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量 例7下列说法中,正确的是( ) A. 任何一种固体物质在水中的溶解度都是一定的,只有一个值B. 固体溶质的溶解度随温度的升高而增大,气体溶质的溶解度随温度升高而减小C. 固体物质的溶解度就
12、是该物质在100g溶剂中所溶解的克数D. 在一定温度下,溶质A的溶解度为SAg,溶质B的溶解度为SBg。已知SASB,相同质量的A和B的饱和溶液,A溶液的溶剂量小于B溶液里的溶剂量例8下图是A、B、C三种物质的溶解度曲线。据图回答下列问题(1)30时,A物质的溶解度为_g。(2)10时,三种物质的溶解度从大到小的顺序是_。(3)_时,AB两种物质的溶解度相同。(4)当温度变化时,溶解度变化最明显的是_物质,溶解度变化不大的是_物质。 例9 把55g50的硼酸饱和溶液蒸干,得到5g硼酸固体。求硼酸在50时的溶解度。 例10 某温度下,在100g水中加入mgCuSO4或加入ngCuSO45H2O,
13、均可使溶液恰好达到饱和,则m与n的关系符合( )9 BA. m=n B. m= C. m= D. m= 例11 t时在一烧杯中盛有一定量KCl溶液,若向该溶液中加x g KCl晶体,充分搅拌后仍有y g晶体末溶:若将原溶液加热蒸发掉zg水,再冷却到t,溶液恰好达到饱和.则t时KCl的溶解度为( )A. B. C. D. 【模拟试题】(答题时间:45分钟)1. X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量约为( )A.(m+n+2)w/m mol B.(mn+2)w/m mol C.(m+n2)w/m mol D.(mn2)w/m mol2. 主族元素X、Y,
14、已知X的原子序数为a,X2+比Y2核外少8个电子,若Y原子的质量数为b,则Y原子核内中子数为( )A. ba10 B. ba8 C. b+a+8 D. ba43. 有aXn和bYm+两种简单离子(X、Y为短周期元素),且Xn比Ym+多一个电子层,则下列关系式正确的是( )A. abmn=10 B. an=bmC. abmn=8 D. an=bm2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl离子,则S2O32将转化成( )A. S2 B. S C. SO32 D. SO42 5. 设NA表示阿伏加德罗常数的数值,下列说法正确的是( ) A. 由2H和18O所组成的水11g,其中
15、所含的中子数为NA B. 3 NA个NO2分子跟水分子充分作用,转移(偏移)的电子数为2 NA C. 在石英晶体中,NA个硅原子与2 NA个氧原子形成共价键 D. 在标准状况下,11.2L氖气含有NA个氖原子 6. NA表示阿伏加德罗常数的值,下列说法正确的是( ) A. 53gNa2CO3固体含有的CO32-离子数为0.5 NA B. 0.5mol氖气含有的原子数为NA C. 常温常压下,11.2L氧气含有的分子数为0.5 NA D. 1molNa2O2与水充分反应后转移的电子数为3NA 7. 设阿伏加德罗常数的符号为NA,标准状况下某种O2和N2的混合气体m克含有b个分子,则n克该混合气体
16、在相同状况下所占的体积(单位L)应是( )A. 22.4nb/NA m B. 22.4mb/bNA C. 22.4nNA/mb D. nbNA/22.4m 8. 若某钠原子的质量是ag,12C原子质量是bg,用NA表示阿伏加德罗常数,下列说法中正确的是( )A. 钠元素的原子量一定是 B. mg该钠原子的物质的量一定是C. 该钠原子mg中所含的质子数是 D. 该钠原子的摩尔质量是aNAg 9. 在标准状况下,a L HCl 气体溶于1000g水中,得到盐酸的密度为b g/cm-3,则该盐酸的物质的量浓度为( ) A. a/22.4mol/L B. ab/22400mol/L C. ab/(22
17、400+36.5a)mol/L D. 1000ab/(22400+36.5a)mol/L 10. 现有质量分数为m%的KOH溶液,加热使其蒸发掉n g水后,体积浓缩到VmL,质量分数变为2m%,则加热后浓溶液的物质的量浓度为( )A. 5mn/14L mol/L B. 10mn/14 mol/L C. 56mn/V mol/L D. mn/56V mol/L 11. toC时,在VL密度为dg/cm3的FeCl3(式量为M)饱和溶液中,加入足量铁粉,充分搅拌后,测得溶液中有2molFeCl2,则toC时FeCl3的溶解度为( ) A. 200M/(3Vd2M)g B. 400M/(3000Vd
18、4M)g C. 100M/(1000VdM)g D. M/15Vd g 15. 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则所用硫酸溶液的物质的量浓度为( )A. 3.50mol/L B. 1.75mol/L C. 0.85mol/L D. 无法计算16. 分别取等质量80的甲、乙两种化合物的饱和溶液,降温至20后,所析出的甲的质量比乙的大(甲和乙均无结晶水)。下列关于甲、乙的溶解度的叙述中肯定正确的是( )A. 20时,乙的溶解度比甲的大 B. 8
19、0时,甲的溶解度比乙的大C. 温度对乙的溶解度影响较大 D. 温度对甲的溶解度影响较大17. 密度为0.91克/厘米3的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度为( )A. 等于12.5% B. 大于12.5% C. 小于12.5%D. 无法确定18. 300毫升某浓度的NaOH溶液中含有60克溶质。现欲配制1摩/升NaOH溶液,应取原溶液与蒸馏水的体积比约为( )A. 1:4 B. 1:5 C. 2:1 D. 2:319. 将标准状况下的a升氯化氢气体溶于1000克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是(
20、 )A. B. C. D. 20. 已知25%氨水的密度为0.91克/厘米3,5%氨水的密度为0.98克/厘米3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是( )A. 等于15% B. 大于15% C. 小于15 D. 无法估算21. 某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g 。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是( )A. 30% B. 100% C. 26.5% D. 10022.(2003理综)某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度。下列叙述正确的是( )A. 沉淀物的质量为5.6
21、g B. 沉淀物的质量为7.4gC. 饱和石灰水的质量大于98.2g D. 饱和石灰水的质量小于98.2g23. 等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为( )A. 1:2:3 B. 1:6:9 C. 1:3:3 D. 1:3:624.(2003上海)某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为( )A. 10 B. 15 C. 20 D. 2525(2004天津理综)在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物Wg,从原饱和溶液中析出溶质R的质量为( )A. B. C. D.
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
