 新版工艺规程模板
新版工艺规程模板


《新版工艺规程模板》由会员分享,可在线阅读,更多相关《新版工艺规程模板(12页珍藏版)》请在装配图网上搜索。
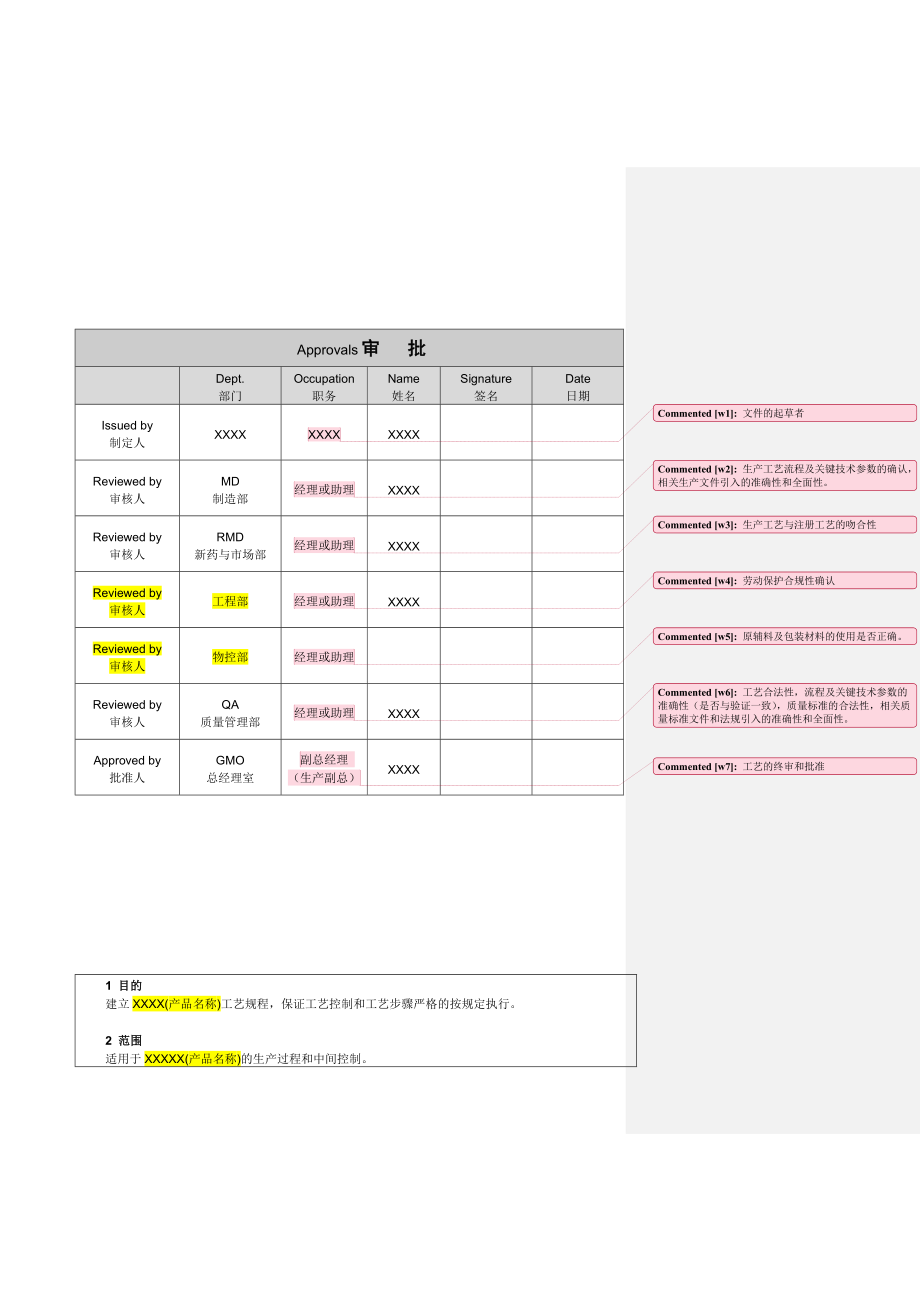
1、Approvals审 批Dept.部门Occupation职务Name姓名Signature签名Date日期Issued by制定人XXXXXXXX文件的起草者XXXXReviewed by审核人MD制造部经理或助理生产工艺流程及关键技术参数的确认,相关生产文件引入的准确性和全面性。XXXXReviewed by审核人RMD新药与市场部经理或助理生产工艺与注册工艺的吻合性XXXXReviewed by审核人工程部经理或助理劳动保护合规性确认XXXXReviewed by审核人物控部经理或助理原辅料及包装材料的使用是否正确。Reviewed by审核人QA质量管理部经理或助理工艺合法性,流程及关
2、键技术参数的准确性(是否与验证一致),质量标准的合法性,相关质量标准文件和法规引入的准确性和全面性。XXXXApproved by批准人GMO总经理室副总经理(生产副总)工艺的终审和批准XXXX1 目的建立XXXX(产品名称)工艺规程,保证工艺控制和工艺步骤严格的按规定执行。2 范围适用于XXXXX(产品名称)的生产过程和中间控制。3 职责制造部、新药与市场部、质量管理部对本规程的实施负责。4制定依据药品生产质量管理规范(XXXX年修订)第XXXX条、第XXXX条第XXXX条中国药典(XXXX年修订)第XXXX条、第XXXX条第XXXX条国家食品药品监督管理局标准YBH01142006要求所有
3、的数据和标准都应有据可依,并方便查找。如验证文件号、设备使用和清洁的标准操作规程号等等5 程序5.1 工艺流程及环境区域划分 十万级洁净区原辅料 非洁净区 内包装材料中间产品检验 外包装材料外包装 成品检验成品经检验合格入库 生产车间XXXX车间生产工序操作间房间号洁净级别温湿度及压差设备名称固定资产编号辅料处理湿法制粒间XXXX十万级温湿度 :XXXX相对压差:XX%XX%热风循环烘箱HG081007称量配料称量配料间(1)XXXX十万级温湿度 :XX相对压差: XX%热风循环烘箱N/A外包外包装XXXX三十万级参照-药品生产质量管理规范(2010年修订)第一百七十条(二)生产操作要求:15
4、.2 产品名称、剂型、规格产品名称:盐酸贝那普利胶囊商 品 名:XXXX剂 型:胶囊剂规 格:XXXX性 状:本品为硬胶囊,内容物为白色至类白色颗粒和粉末。药品批准文号:国药准字XXXXXX有效期:XX个月内包装形式:铝塑包装规格:X粒/盒、XX粒/盒、XX粒/盒、XX粒/盒、XX粒/盒注册的包装规格参照-药品生产质量管理规范(2010年修订)第一百七十条 (一)生产处方:1、25.3 处方序号原辅料名称申报处方生产处方XXXX粒处方量(g)XXXXXXXX粒处方量(kg)1主药XX.XXXX.XX2辅料AXX.XXXX.XX3辅料BXX.XXXX.XX4辅料CXX.XXXX.XX5.4 产品
5、的法定质量标准和内控标准项目国家标准内控标准性状本品为硬胶囊,内容物为白色至类白色颗粒和粉末鉴别高效液相色谱法供试品溶液主峰的保留时间与盐酸贝那普利对照品峰的保留时间保持一致氯化物鉴别应呈正反应 检 查溶出度限度为标示量的80%限度为标示量的85%含量均匀度A+1.80S15.0,应符合规定A+1.80S13.0,应符合规定有关物质供试品溶液的色谱图中单个最大杂质的峰面积不得过对照溶液的主峰面积1倍(1.0),各杂质峰面积之和不得超过对照溶液主峰面积的2倍(2. 0)微生物限度细菌数不得过1000个/g;霉菌和酵母菌数不得过100个/g;大肠埃希菌不得检出细菌数不得过500个/g;霉菌和酵母菌
6、数不得过50个/g;大肠埃希菌不得检出含量测定含盐酸贝那普利(C24H28CLN2 O5HCl)应为标示量的90.0%110.0%含盐酸贝那普利(C24H28CLN2 O5HCl)应为标示量的92.0%108.0% 原辅料、中间产品质量标准 原辅料质量标准: XXXXXX质量标准见:QS/AFP012、QS/RM033XXXXXX质量标准见:QS/AM082XXXXXX质量标准见:QS/AM036XXXXXX质量标准见:QS/AM068 包装材料质量标准:QS/PM040中间产品质量标准:QS/SP052检验项目质量指标M1(混粉)M2(素囊)性状外观白色至类白色粉末本品为硬胶囊剂,内容物为白
7、色或类白色粉末或颗粒检查溶出度-限度为85%,应符合规定干燥失重小于1.5%(现场控制)-含量均匀度-A+1.80S13.0,应符合规定含量测定5.25%5.80%- 成品内控标准见:QS/FP041参照-药品生产质量管理规范(2010年修订)第一百七十条 (二)生产操作要求:4 (三)包装操作要求:6 ,各质量标准5.5 操作过程及工艺条件(XX万粒/批)5.5.1 混粉制造5.5.1.1 辅料处理:称取取辅料A XX.XXkg、辅料B XX.XXkg,分别放入烘箱,温度控制XXX温度干燥约XX小时时间至两种辅料的干燥失重在X.XX%要求以下,备用。参照-药品生产质量管理规范(2010年修订
8、)第一百七十条 (二)生产操作要求:3预处理5.5.1.2根据处方量的主药(折干折纯)XX.XXkg精确的参数,计算并精确称取盐酸贝那普利实际需投入量,然后再称取与盐酸贝那普利实际投入量相同量的辅料A XX.Xkg加入到主药中,手工准确详细的描述混合过XX目筛,称为M1;取主药2倍量的辅料B加入到M1中手工混合过XX目筛,称为M2;取M2相同重量的辅料C加入到M2中手工混合过60目筛,称为M3;取剩余量的辅料C手工过XX目筛后加入加入物料的顺序到M3中于XXXX型多向运动混合机准确详细的描述中混合XX分钟,总混机转速XX转/分钟。参照-药品生产质量管理规范(2010年修订)第一百七十条 (二)
9、生产操作要求:3盐酸贝那普利实际使用量计算公式: N1C1+ N2C2+ +NnCn = 0.50kg (注:N1、N2N n为本批使用的每个流水号的盐酸贝那普利实际投料量, C1、C2Cn为与之对应的湿品含量)参照-药品生产质量管理规范(2010年修订)第一百七十条 (一)生产处方:3 ,原辅料折算公式5.5.1.3 按照XXXXX“取样标准操作规程”进行取样,取样数量为XX.XX,检测中间产品含量应在X.XX% X.XX%范围内,干燥失重X.XX%,粒度X.XX%。参照-药品生产质量管理规范(2010年修订)第一百七十条 (二)生产操作要求:4 , (三)包装操作要求:6.(应将取样方法和
10、取样数量进行详细描述,并描述取样检测内容及限度).4将混粉置于洁净内衬两层聚乙烯塑料袋的干燥物料桶中,扎好袋口,交中间站称量,贴上内外标签,加盖封好后,贮存,计算收率和物料平衡率,填写物料、中间产品请验单。5.5.1.5 清场:清场并填写生产记录及清场记录。5.5.1.6本工序涉及文件及其使用范围。本工序涉及文件使用范围文件号文件名称MF107热风循环烘箱的清洁标准操作规程1、 设备生产前检查、清洁及消毒2、 设备生产结束后清场MF070HD-1000型多向运动混合机清洁标准操规程MF044生产车间洁净区清洁程序1、 操作间生产前检查、清洁及消毒2、 操作间生产结束后清场XXXXX容器、小工具
11、清洁标准操作规程1、容器、小工具清洁生产前检查、清洁及消毒;2、生产后清洁EM/O090GMP-1型热风循环烘箱操作规程1、 设备生产前检查及组装、调试2、 设备操作EM/O096CT-C2型热风循环烘箱标准操作规程EM/O011HD-1000多向运动混合机操作规程MF023制粒岗位操作法生产全过程MF026总混岗位操作法5.6关键控制点:工序控制项目要 求辅料处理烘干温度XXXX干燥失重X.XX%制软材湿法制粒机转速XX转/分钟预混时间XX分钟湿混时间XX分钟制湿颗粒筛网目数XX目筛网材质尼龙颗粒烘干烘干温度进风温度:XXXX出风温度:XXXX干燥失重X.XX%摇摆整理筛网目数XX目筛网材质
12、不锈钢总混混合时间物料A与物料B :XX分钟 混合物料C与物料D:XX分钟设备转速XX转/分钟胶囊填充胶囊规格型号X号;红白胶囊装量差异X.XX%抽称频次及数量XX粒/次/XX分钟设备转速XX转/分钟(或XX粒/分钟)外观无开裂、短体、套环、重蘸、瘪壳、切边、锁合不良、双帽、毛口、套爪皱、薄点、短/长体、长帽、气泡、皱壁、黑头、异点、刮瘪、污斑内包装封合温度成型温度:XXXX泡罩温度:XXXX设备运行速度XX切/分钟外观印刷文字正确、清晰,复合层间严密无分离,涂层均匀;复合膜不粘连,无异物、异味、脏污、穿孔和明显损伤,没有直径大于等于0.5cm的印刷污染及宽度大于等于0.2cm的深色印刷刀线。
13、外包装外观打包带倾斜度:X防伪标签或电子监管码粘贴倾斜度:X大箱封口超出封口起始点长度:XX厘米包装规格: X粒/板*XX 板/盒*XX盒/中盒*XX中盒/箱;XX粒/板*XX 板/盒*XX盒/中盒*XX中盒/箱;XX粒/板*XX板/盒*XX盒/中盒*XX中盒/箱;XX粒/板*XX板/盒*XX盒/中盒*XX中盒/箱;XX粒/板*XX板/盒*XX盒/中盒*XX中盒/箱;参照-药品生产质量管理规范(2010年修订)第一百七十条 (三)包装操作要求:1 (与生产实际完全一致的详细包装规格)5.7 物料、中间产品、成品储存注意事项5.7.1 原辅料贮存于中间站内,一个整包装未能一次性用完时,将剩余原辅
14、料称量后,按原包装密闭封存,附内外标签(一张置于两层聚乙烯袋中间,另一张贴在最外层聚乙烯袋上或物料桶外),置于中间站暂存,并作为下一次优先使用。5.7.2 生产过程中的混粉用两层聚乙烯袋装好,胶囊用两层聚乙烯袋装好,并尽量将内空气挤出,扎紧封闭,置于白色洁净干燥物料桶中加盖,附内外标签(一张置于两层聚乙烯袋中间,另一张贴在物料桶外),贮存于中间站,贮存时间不超过72小时。5.7.3 原辅料、中间产品、成品贮存条件要求:遮光、阴凉、密闭封存,温度XX XX,湿度XX%XX%,压差XXPa。参照-药品生产质量管理规范(2010年修订)第一百七十条 (二)生产操作要求:65.8物料消耗定额表5.8.
15、1原辅料物料代码及消耗定额表原辅料名称物料代码每批5万粒胶囊的投料量(kg)XXXXXXX(折干折纯)XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX XXXXXXXX5.8.2 包装材料物料代码及消耗定额表名 称X粒/盒XX粒/盒物料代码消耗定额物料代码消耗定额2#空白空心胶囊XXXXXXXX粒XXXXXX粒PVC硬片XXXXXXXXkgXXXXXXkg铝箔XXXXXXXXXXXXXX说明书 XXXX XXXX张 XXXX XX张小盒XXXXXXXX个XXXXXX个工号卡XXXX XXXX张XXXX XX张PVC袋XXXXXXXX个XXXXXX个防潮袋 X
16、XXXXXXX个 XXXXXX个包装袋XXXXXXXX个XXXXXX个大箱XXXX XXXX个XXXX XX个合格证XXXXXXXX张XXXXXX张先声封口胶带 XXXX XXXX个 XXXX XX个打包带XXXXXXXXkgXXXXXXkg封口签 XXXX XXXX枚 XXXX XX枚参照-药品生产质量管理规范(2010年修订)第一百七十条 (一)生产处方:所有原辅料清单及物料代码和用量5.9 技术经济指标的计算及物料平衡参照-药品生产质量管理规范(2010年修订)第一百七十条 (二)生产操作要求:5 (三)包装操作要求:7 ( XX.XX% XX.XX% ) ( XX.XX% XX.XX%
17、 ) ( XX.XX% XX.XX% )( XX.XX% XX.XX% ) ( XX.XX% XX.XX% )( XX.XX% XX.XX% ) ( XX.XX% XX.XX% )( XX.XX% XX.XX% ) ( XX.XX% XX.XX% ) ( XX.XX% XX.XX% )( XX.XX% XX.XX% ) 5.10 技术安全与劳动保护5.10.1 各工序应严格按照XXXXXX “安全生产管理规程”、XXXXXX“安全手册-普通类固体制剂车间”进行车间日常及定期的安全巡检并记录。5.10.2 在进行生产时,必须按XXXXX劳动保护清单的要求穿戴劳保用品,严格按设备操作规程使用设备。
18、5.10.3任何时刻都必须保持安全通道的畅通。5.10.4车间操作人员必须经过MSDS “化学试剂安全技术说明书”、XXXXX“安全生产管理规程”、XXXXXX“安全手册-普通类固体制剂车间”、 XXXXX“普通类固体制剂车间逃生路线图”以及三级安全教育培训和演习,并考核合格。5.11 工艺卫生和环境卫生5.11.1生产车间为十万级洁净区,生产工艺卫生符合生产要求,厂房周围为草地或水泥路面。5.11.2 个人卫生按MF031“生产操作人员个人卫生管理规程”进行,人员净化按MF049“人员进出生产区更衣程序”进行,物料净化按MF097“物料进入生产区清洁操作程序”进行,工作服清洁、使用按MF04
19、1“工作服管理规程”进行。4.12 主要设备一览表设备名称和设备厂家应与设备铭牌一致序号设备名称设备型号固定资产编号生产厂家1热风循环烘箱XXXXXXXXXXXXXXXXXXXXXXXX2热风循环烘箱XXXXXXXXXXXXXXXXXXXXXXXX3多向运动混合机XXXXXXXXXXXXXXXXXXXXXXXX4胶囊充填机XXXXXXXXXXXXXXXXXXXXXXXX5胶囊磨光机XXXXXXXXXXXXXXXXXXXXXXXX6自动铝塑包装机XXXXXXXXXXXXXXXXXXXXXXXX7多道墨轮打码机XXXXXXXXXXXXXXXXXXXXXXXX8激光标刻机XXXXXXXXXXXXXX
20、XXXXXXXXXXXXXXXXXXXXXXXXXXXXXX9折页机XXXXXXXXXXXXXXXXXXXXXXXX10捆扎机XXXXXXXXXXXXXXXXXXXXXXXX11热风式收缩包装机XXXXXXXXXXXXXXXXXXXXXXXX5.13印刷型包装材料原样:见QAXXXX盐酸贝那普利胶囊标准样稿参照-药品生产质量管理规范(2010年修订)第一百七十条(三)包装操作要求:3(如果有电子版本,应附电子版本,并有详细的尺寸和字样及内容的说明,此外,还需标注批号、效期的打印位置和防伪标签或电子监管码粘贴位置等) 5.14 劳动组织与岗位定员人员定编应根据生产实际和操作间级别及空间等因素设置
21、,使之同时满足生产需要和法规要求制定生产计划,指挥生产运作确保本部门的正常运转。经理 车间管理员组织本车间人员完成经理或助理安排的生产任务。 铝塑内包装外包装胶囊填充中间站制粒工序注:1、制造部经理X名,车间管理员X名。2、每班洁净区中间站管理员X名、清洁工X名,制粒制备人员X名,车间管理员或制粒工段长X名,胶囊填充操作工X名,铝塑内包操作工X名,分装工段主管X名,包装工段主管X名、非洁净区中间站管理员X名、包装工序操作工X名。 5变更历史变更实施日期变更内容文件号变更修订号新文件N/A001、 增加制定依据2、 增加所有原辅料及包装材料物料代码3、 增加车间生产工序及设备定置表4、 增加生产
22、涉及的其他文件名称及文件号5、 .由XXXXXXX变为XXXXXXX01各工序需描述的内容汇总粉碎筛网目数及材质;粉碎数量及粉碎时间; 物料平衡率;筛网断裂的处理措施过筛筛网目数及材质;过筛数量及时间;过筛的顺序;过筛的方式(手工或设备);筛网断裂的处理措施称量物料名称及数量;称量顺序;计量仪器的最小分度值及量程;折算物料的计算方法;容器制粒预混和湿混时间;切刀和搅拌桨的状态(高低速);物料加入顺序及加入方法(停机加还是从观察口加);设备操作(是否开压缩空气等);软材的判断方法。摇摆筛网目数及材质;制湿颗粒的数量及时间(确认摇摆速度);筛网更换的频次及检查方法;湿颗粒的判断方法烘箱烘干烘干温度
23、范围;烘干时间;摊盘厚度;翻盘时间及次数;温度检查频次;温度超限的规定及处理措施;烘干时间的记录方法(推进去就计时或是温度到了计时,应有其风险评估)沸腾干燥机进出风温度范围;烘干时间;温度检查频次;送风量风量范围;压缩空气范围;采集布袋的材质;烘干时间的记录方法(推进去就计时或是温度到了计时,应有其风险评估,规定从进料后至达到正常温度的时间范围);干燥失重范围整粒筛网目数及材质;过筛数量及过筛时间(确认过筛速度);不同筛网的安装顺序(先经过的筛网目数,后经过的筛网目数);粒度要求;筛网断裂的处理方法;筛网更换的频次及检查方法;总混总混时间;物料加入的顺序;进料和下料方式(手工或真空);含量均匀
24、度范围;物料平衡率压片压片机转速范围及压力范围;素片的硬度、厚度、脆碎度、崩解(或溶出)、片重范围;理论片重及片重范围的计算方法;模具型号包衣包衣材料的名称、型号、粘度范围及用量;包衣浆的配制方法、搅拌速度及搅拌、静置时间;预热温度及时间;预热方法(空锅预热或物料预热);雾化压力;喷浆速度;喷枪高度及角度(确定雾化面积);包衣锅转速;包衣时间及包衣浆用量范围;包衣片/丸成膜性检查方法;干燥时间;干燥失重范围;包衣片/丸理论重量及重量范围;溶出度或释放度素片或包衣片目检无污斑、破损、半片、印字不清晰、印字错误、包衣不完整、色泽差异过大、粘连胶囊填充填充机转速范围;胶囊的溶出、填充范围;理论粒重及
25、粒重范围的计算方法;模具及胶囊型号抛光目检抛光时间;外观:无开裂、短体、套环、重蘸、瘪壳、切边、锁合不良、双帽、毛口、套爪皱、薄点、短/长体、长帽、气泡、皱壁、黑头、异点、刮瘪、污斑内包装横纵封温度范围;压缩空气范围;设备运行速度;检漏方法及频次;生产批号;生产日期;有效期至打印位置及表现形式板检板重范围;外观:无破损压花不均匀、压花不清晰;泡眼不圆整;印刷歪斜(及标准);印刷颠倒;缺粒;多粒;破损;半片防潮袋打印批号效期生产日期打印位置及表现形式;打印数量范围;打印错误的处理方法;平衡率或误差范围;打印时间及检查频次小盒打印批号效期生产日期打印位置及表现形式;打印数量范围;打印错误的处理方法
26、;平衡率或误差范围;打印时间及检查频次;外观检查:无破损;印刷内容正确;无污染、无重影、无错误;无夹杂其他物品(如蚊子);折说明书说明书使用数量范围;折叠详细方法(含手工或设备);平衡率或误差范围;外观检查:无破损;印刷内容正确;无污染、无重影、无错误;无夹杂其他物品(如蚊子);贴标贴标方法(手工或设备);贴标位置及数量;倾斜角度要求;平衡率或误差范围包装标准包装内容物清单(如小盒:18小包、一张说明书、一张防伪标签、两枚封口签);检查频次及方法(含员工本身及管理人员和QA);热塑热塑的温度范围;详细的流程装箱详细的装箱流程;胶带的粘贴要求(如胶带中线与两个粘贴面交接线基本吻合,不超过多少毫米,胶带两端应超出多少厘米。打包打包位置及偏差范围;打包线数量大箱称量重量范围及超限的处理方法;外观检查:无破损;印刷内容正确;无污染;印刷无错误、无重影;批号等打印正确、位置正确;表面规整无凹陷
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 幼儿园绘本故事当我睡不着的时候课件
- 人教版小学五年级品德与社会上册《五十六个民族五十六朵花》ppt课件
- 人教版小学一年级音乐下册红眼睛绿眼睛ppt课件
- 人教版小学数学四年级上册《数学广角》ppt课件
- 幼儿园优质课件小猫的生日
- 幼儿园科学活动区创设与材料投放课件
- 人教版小学四年级音乐小螺号ppt课件
- 幼儿园科学教育的方法和途径课件
- 开盘前广告策略案课件
- 人教版小学一年级品德与生活《校园铃声》ppt课件
- 人教版小学五年级音乐吹起羌笛跳锅庄ppt课件
- 人教版小学四年级英语下册unit3_weather第三课ppt课件
- 人教版小学一年级上册数学第二单元上下前后ppt课件
- 人教版小学五年级美术第17课电脑动画ppt课件
- 幼儿园优质课件-幼儿园中班“我们都是好朋友”课件
