 第十七堂课工科化学
第十七堂课工科化学


《第十七堂课工科化学》由会员分享,可在线阅读,更多相关《第十七堂课工科化学(40页珍藏版)》请在装配图网上搜索。
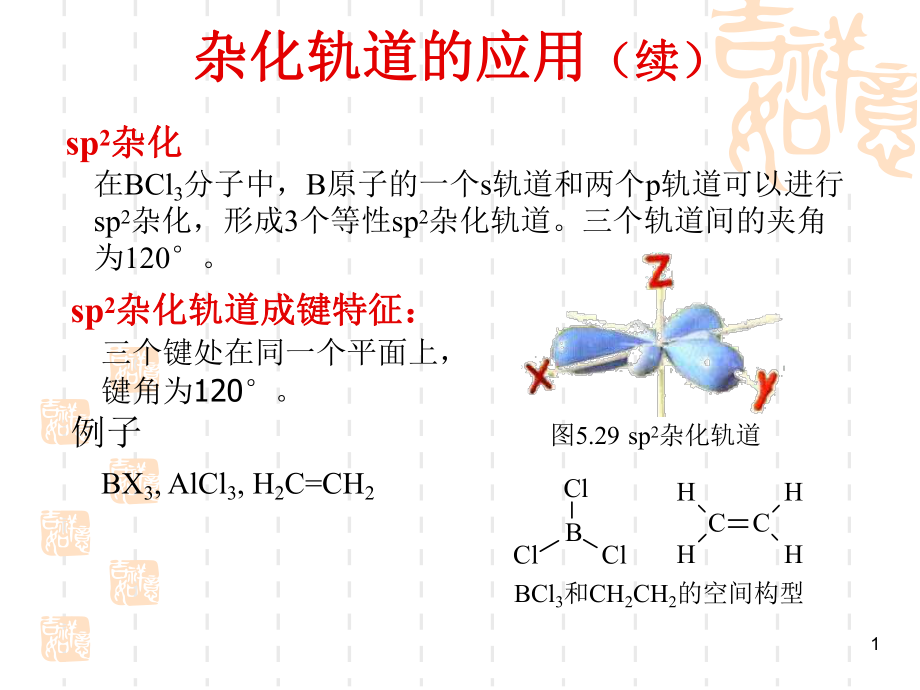
1、1杂化轨道的应用杂化轨道的应用(续)(续)sp2杂化杂化在BCl3分子中,B原子的一个s轨道和两个p轨道可以进行sp2杂化,形成3个等性sp2杂化轨道。三个轨道间的夹角为120。图5.29 sp2杂化轨道sp2杂化轨道成键特征:杂化轨道成键特征:三个键处在同一个平面上,键角为120。例子BX3,AlCl3,H2C=CH2ClBClClCCHHHHBCl3和CH2CH2的空间构型2杂化轨道的应用(续续)等性等性sp3杂化杂化甲烷分子中C原子的一个s轨道和3个p轨道可以进行sp3杂化,形成4个等性sp3杂化轨道。4个轨道间的夹角为10928。每个键中,s成分占1/4,p成分占3/4。sp3杂化轨道
2、成键特征:杂化轨道成键特征:4个键指向正四面体的四个顶点,键角为10928。例如:CH4,CX4,C(金刚石),SiC等。图5.30 sp3杂化轨道HCHHH甲烷的空间构型3杂化轨道的应用(续续)Sp3不等性杂化不等性杂化氨分子中N原子可以进行sp3杂化形成不等性sp3杂化轨道。N原子不等原子不等性性sp3杂化轨道成键特征:杂化轨道成键特征:其中有一个杂化轨道含有一对电子(孤对电子),含孤对电子的轨道因内部斥力较大而较胖,因此压迫另3个轨道使键角小于10928。O原子和原子和S原子也能进行不等性原子也能进行不等性sp3杂化杂化NHHH.OHH.图5.31 NH3和H2O分子的空间构型4杂化轨道
3、与分子极性杂化轨道与分子极性分子分子杂化形式杂化形式分子构型分子构型分子极性分子极性示例示例AB2sp等性线形非极性CO2,BeCl2AB3sp2等性平面三角非极性BF3,SO3sp3不等性AB2角型极性H2O,SF2AB3三角锥极性NH3AB4sp3等性 正四面体 非极性CH4,NH4+55.3.3 分子间相互作用力分子间相互作用力范德华力包含:取向力、诱导力和色散力分子间作用力:分子间作用包括范德华力、氢键、疏水作用等,比化学键要弱得多。分子间作用力存在于所有分子中分子间作用力存在于所有分子中。范德华力的特点:永远存在于分子间的弱相互作用;永远存在于分子间的弱相互作用;短程力短程力没有方向
4、性、没有饱和性没有方向性、没有饱和性以色散力为主以色散力为主61 取向力 取向力取向力分子固有电偶极之间的作用力,存在于极性分子中分子固有电偶极之间的作用力,存在于极性分子中。距离较远时距离较近时相互接近图5.32 取向力示意图72 诱导力诱导力诱导力固有偶极与诱导偶极之间的作用力,存在于极性分子之间或固有偶极与诱导偶极之间的作用力,存在于极性分子之间或极性分子与非极性分子之间极性分子与非极性分子之间。+-+-图5.33 诱导力产生的示意图83 色散力色散力色散力当非极性分子相互靠近时,由于电子和原子核的不断运动,正负电荷中心不能始终保持重合,产生瞬间偶极,瞬间偶极之间的相互作用称为色散力。色
5、散力存在于所有分子之间,同类型分子距离相等时,相对分子质量越大,其色散力越大。例例5.10:下列两组物质的色散力大小 1)卤素单质;2)卤化氢解解:卤素单质按色散力从大到小:I2,Br2,Cl2,F2;卤化氢按色散力从大到小:HI,HBr,HCl,HF思考思考:实际上实际上卤化氢中卤化氢中HF的沸点高于的沸点高于HCl,说明在说明在HF分分子中还存在其它的相互作用?可能是什么?子中还存在其它的相互作用?可能是什么?94 氢键氢键氢键电负性很大的原子电负性很大的原子X(F、O、N)与)与H原子成键时,由于原子成键时,由于X吸吸引电子的能力很强,使氢原子带有较多正电荷,它与另一个引电子的能力很强,
6、使氢原子带有较多正电荷,它与另一个电负性大且半径又小的原子电负性大且半径又小的原子Y(F、O、N)形成氢键:形成氢键:XHY氢键具有方向性和饱和性。氢键可以是分子间的也可以是分子内的。X120YYYYYYY图5.34 氢键的方向性和饱和性105 分子间力和氢键对物质性质的影响分子间力和氢键对物质性质的影响熔点和沸点熔点和沸点分子间氢键使物质的熔点和沸点大幅升高,无氢键时,同类单质和化合物的熔点和沸点随分子摩尔质量的增加而升高。(为什么?为什么?)溶解性溶解性溶剂与溶质间的氢键或分子间作用力大于溶质之间的作用力,或溶质与溶剂之间有相似的结构、极性等,有利于溶质的溶解,即相似相溶原理。11分子间作
7、用力的应用示例分子间作用力的应用示例例例5.11:卤素单质和卤化氢的沸点(C)如下:说明理由。卤素单质:F2:-219.62;Cl2:-34.6;Br2:58.78;I2:184.35。卤化氢:HF:19.5;HCl:-84.1;HBr:-67;HI:-35解解:卤素单质的分子间力是色散力,从大到小的顺序为:I2,Br2,Cl2,F2,因此沸点从高到低的顺序也是I2,Br2,Cl2,F2,卤化氢是极性分子,除色散力外还有取向力和诱导力,但色散力是主要的。范德华力从高到低的顺序应是HI,HBr,HCl,HF,但由于HF中存在氢键,因此HF的沸点意外地高。图5.35 氢键对氢化物沸点的影响125.
8、3.4 超分子化学超分子化学分子利用相互间的非共价作用,聚集形成有序的空间结构,并可以表现出特殊的功能。这种聚集体被称为超分子超分子。在生物体中,蛋白质,磷酯分子等利用分子所具有的氢键,亲水基团和疏水基团等自动组装成细胞膜3.3氢键图5.36 Cu(DABT)Cl2分子的有序聚集DABT:2,2二氨基-4,4-联噻唑13超分子的特征超分子的特征超分子物质具有以下三个重要特征自组装、自组织、自复制图5.37 双乙酰基胍(1)与磷酸二酯的自组装14 u 沙粒沙粒u 雪花雪花晶晶体体 Crystal 源于希腊文源于希腊文“洁净的冰晶洁净的冰晶”155.4 晶体结构固体物质可以分为晶体和非晶体两类。晶
9、体中物质微粒(分子、原子或离子)按一定的周期性和对称性按一定的周期性和对称性排列排列。晶体的特点 具有一定的几何外形 具有固定的熔点 各向异性图5.40 晶体的各向异性 16石英晶体的不同外形与晶面石英晶体的不同外形与晶面17点阵(晶格点阵(晶格lattice):晶体中的重复单元,用一个抽象的点表示,一晶体中的重复单元,用一个抽象的点表示,一组无限的点,有平移对称性组无限的点,有平移对称性例:例:一维点阵:一维点阵:A B A B A B A B二维二维点阵(平面点阵)点阵(平面点阵)CH2CH2CH2CH2CH218三维点阵三维点阵金属钠、钾的体心立方点阵金属钠、钾的体心立方点阵195.4.
10、1 晶体的基本类型晶体的分类根据晶体点阵点上粒子间的相互作用力,可以分为:离子晶体离子晶体点阵点上的物质微粒是正、负离子,粒子之间作用力是离子键力。原子晶体原子晶体点阵点上的物质微粒是原子,微粒之间的作用力是共价键,20 金属晶体点阵点上的物质微粒是金属离子,微粒之间作用力是金点阵点上的物质微粒是金属离子,微粒之间作用力是金属键属键,分子晶体分子晶体点阵点上的物质微粒是分子,微粒之间作用力是分子间力,211 离子晶体负离子的半径比正离子的半径大得多,负离子采取紧密堆积,而较小的正离子则填充在负离子形成的孔穴内。离子晶体的特点离子晶体的特点熔点高,硬度大,质脆,延展熔点高,硬度大,质脆,延展性差
11、。熔融状态可导电性差。熔融状态可导电离子晶体的熔点、硬度等性质可以相差很大,主要与晶格能晶格能有关有关。钠原子氯原子图5.41 NaCl晶体22离子晶体的性质晶体的晶格能晶体的晶格能298.15K,标准状态下,由气态正、负离子形成单位物质的标准状态下,由气态正、负离子形成单位物质的量的离子晶体所释放的能量称为晶体的晶格能。量的离子晶体所释放的能量称为晶体的晶格能。离子晶体晶格能与离子电荷和离子半径有关。rrZZEL晶格能越大,离子晶体越稳定。熔点和硬度就相应较高。例例5.12 试判断Na的卤化物的熔点高低。解:离子F-、Cl-、Br-、I-的电荷数相同,离子半径从氟到碘增加,因此晶格能下降,熔
12、点依次降低NaF:996;NaCl:801 ;NaBr:755 ;NaI:661 23 CsCl的晶胞的晶胞 CsCl的的 简单立方点阵简单立方点阵24 NaCl的晶胞的晶胞 NaCl的的 面心立方点阵面心立方点阵25主要的离子晶体形式主要的离子晶体形式:NaCl型:型:Na+在在 Cl-的八面体空隙(的八面体空隙(6配位)配位)ZnS型(立方):型(立方):Zn2+在在S2-的四面体空隙(的四面体空隙(4配位)配位)CsCl型:型:Cs+在在Cl-的的 立方体空隙(立方体空隙(8配位)配位)r+/r-越大,阳离子的配位数越高越大,阳离子的配位数越高 空隙类型空隙类型 配位数配位数 例子例子平
13、面三角空隙平面三角空隙 3 BO3,CO3四面体空隙四面体空隙 4 ZnS,SiO2八面体空隙八面体空隙 6 NaCl立方体空隙立方体空隙 8 CsCl262 原子晶体原子晶体中粒子的空间排列取决于共价键的方向和数量,如金刚石晶体,C原子采取sp3杂化。原子晶体的特点原子晶体的特点一般具有低配位、硬度高,强度大与熔点高等特点。一般具有低配位、硬度高,强度大与熔点高等特点。除金刚石外,SiC,SiO2,Si3N4,BN,AlN等都是原子晶体。图5.42 金刚石晶体的结构图5.43 SiO2晶体的结构273 金属晶体金属晶体中,金属离子紧密堆积,依靠自由电子对金属离子的引力结合。由于自由电子可以在
14、整个金属晶体的范围内运动,因此,金属晶体又具有独特的性质:展延性展延性金属离子之间可以错位移动。导电导热性导电导热性在外电场存在下,金属中的自由电子可以定向移动而导电或导热。金属晶体的硬度、强度、熔点等相差很大金属晶体的硬度、强度、熔点等相差很大具有高的价电子/半径比的金属一般具有高的溶点、强度和硬度,如钨,反之,则熔点、硬度和强度都很低,如碱金属和碱土金属(Be除外)。284 分子晶体分子晶体中,占据在点阵点上的物质粒子是分子点阵点上的物质粒子是分子。粒子之间的相互作用是分子间作用力分子间作用力。因此,分子晶体的熔点、硬度分子晶体的熔点、硬度和强度都很差和强度都很差,如干冰、冰等晶体。许多分
15、子晶体还具有挥发性。图5.44 CO2分子晶体例例5-135-13:判断分子晶体1):SiF4、SiCl4、SiBr4、SiI42):H2O、H2S、H2Se、H2Te的熔点高低。解解:分子晶体的熔点取决于粒子间的相互作用力。1)的顺序:从左到右依次升高。2)中由于H2O晶体中粒子间存在氢键熔点特高,其它分子晶体的熔点从左到右升高。29 晶体的四种基本类型对比 晶体类型晶格结点上的微粒粒子间作用力晶体的一般性质物质实例离子晶体阴、阳离子静电引力mp较高,略硬而脆,固态不导电活泼金属的氧化物和盐类等原子晶体原子共价键mp高,硬度大,不导电C金、Si、B、SiC、SiO2、BN分子晶体分子分子间力
16、、氢键mp低,易挥发,硬度小,不导电稀有气体、多数非金属单质、有机物金属晶体金属原子、阳离子金属键导电、导热性,延展性好,有金属光泽金属或合金305.4.2 过渡型晶体有些固体物质,粒子与粒子之间存在着不止一种相互作用,如石墨晶体。C原子通过sp2杂化形成层状架构,每个C原子剩余的一个p轨道互相平行形成大健。大健中的电子可以在整个平面内离域运动。因此,石墨具有二维导电性质。由于石墨在层平面上可以错位滑动,因此具有片状解理的特性。大多数硅酸盐中存在着链状或岛状的硅氧四面体晶相。图5.45 石墨的层状结构图5.46 硅氧四面体链315.4.3 晶体缺陷与非整比化合物 点缺陷点缺陷晶体的某些点阵点未
17、被原应占有的粒子所占有或非点阵点上被物质粒子所占领。图5.47 晶体中的点缺陷 面缺陷面缺陷线缺陷在平行位置上的扩展就形成面缺陷 体缺陷体缺陷在晶体结构中存在着空洞或包裹了杂质。线缺陷线缺陷出现线状位置的短缺或错乱。图5.48 晶体中的线缺陷思考思考:人们一般都想获得高纯度的晶体,如作为半导体材料的单晶硅。但晶体中的杂质是否都是有害的?32晶体中的晶体中的Schottky缺陷缺陷(空位)空位)晶体中的晶体中的Frenkel缺陷缺陷(位错)位错)33非整比化合物及其应用也称为非计量式化合物。当晶体中存在大量缺陷或大量杂质也称为非计量式化合物。当晶体中存在大量缺陷或大量杂质时,就形成非整比化合物时
18、,就形成非整比化合物。如MgSO4晶体中,20%的Mg用Ca取代后,就得到Mg 0.8Ca 0.2SO4晶体。非整比化合物可以改变物质的性质。应用实例:催化领域催化领域:例如纯的V2O5导致烃类完全氧化(产物为CO2),因此需要在其中掺杂P、Mo等“杂质”才能使烃类催化氧化成二烯、醛、酮或羧酸等重要化工原料。材料领域材料领域:无机材料中掺杂稀土等可以有效地改变材料的电、磁、光学等性能。如YBa2Cu3O7-,就是在1987年发现的一种高温超导材料。345.4.4 非线性光学晶体当一束射线照射在某物质上时,该物质会产生与入射光频率相同的射线,在光学上称为“线性效应”。但是,当强度很当强度很高的激
19、光束照射到某些特殊物质时,除产生与入射射线频率高的激光束照射到某些特殊物质时,除产生与入射射线频率相同的射线外,还可以产生二倍、三倍于入射射线频率的射相同的射线外,还可以产生二倍、三倍于入射射线频率的射线,此现象被称为线,此现象被称为“非线性效应非线性效应”。非线性光学晶体能够对激光进行调频、调相、调偏振方向等处理,因此在激光领域中有广泛的应用。355.17 判断熔点高低(1)NaF,MgO(2)BaO,CaO(3)SiC(原子晶体),SiCl4(分子晶体)(4)NH3,PH336离子晶体晶格能与离子电荷和离子半径有关。rrZZEL375.18 熔点高低(1)SiF4,SiCl4,SiBr4,SiI4,(2)PF3,PCl3,PBr3,PI3,38 解:SiF4SiCl4,SiBr4,SiI4,属于分子晶体化合物,非极性分子间色散力虽分子量增大而增大,因此熔点增高 PF3,PCl3,PBr3,PI3,属于分子晶体化合物,属极性分子,取向力,诱导力和色散力,以色散力为主虽分子量增大而增大,因此熔点增高395.19 熔点高低(1)KCl,(2)SiC,(3)HI(4)BaO40(1)KCl,(2)SiC,(3)HI,(4)BaO 离子晶体 原子晶体 分子晶体 离子晶体 解:(2)SiC,(4)BaO,(1)KCl,(3)HI
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
