 羰基的亲核加成PPT优秀课件
羰基的亲核加成PPT优秀课件


《羰基的亲核加成PPT优秀课件》由会员分享,可在线阅读,更多相关《羰基的亲核加成PPT优秀课件(80页珍藏版)》请在装配图网上搜索。
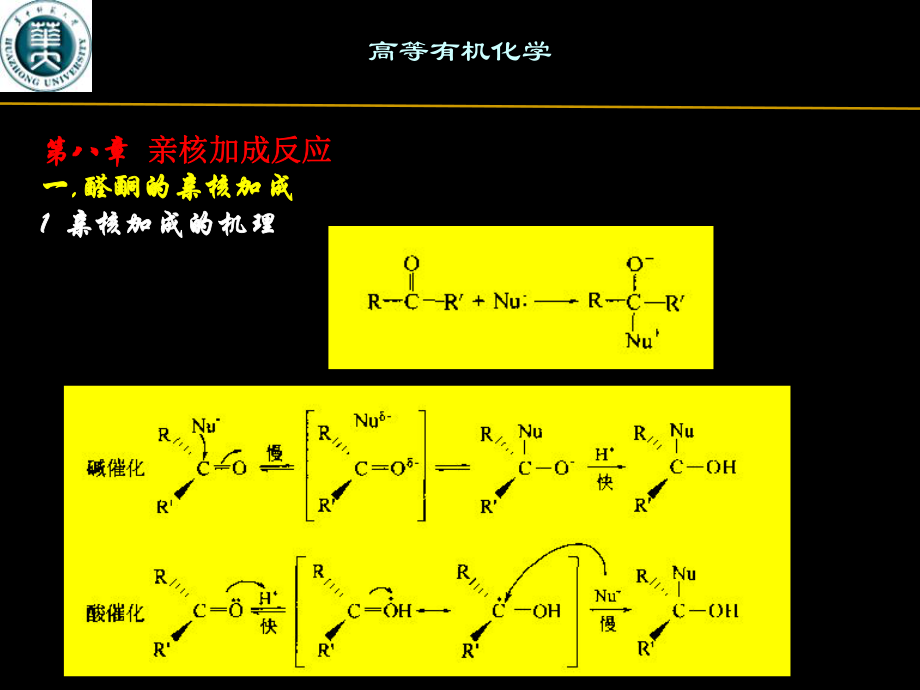
1、第八章第八章 亲核加成反应亲核加成反应一一,醛酮的亲核加成醛酮的亲核加成1 1 亲核加成的机理亲核加成的机理高等有机化学第八章第八章 亲核加成反应亲核加成反应一一,醛酮的亲核加成醛酮的亲核加成2 2 羰基的活性羰基的活性电子因素电子因素*当羰基碳上连有给电子基团当羰基碳上连有给电子基团(如烷基、芳基等如烷基、芳基等)时,由时,由于中心碳原子的电正性减小,从而降低了它的亲电能力,使反应活于中心碳原子的电正性减小,从而降低了它的亲电能力,使反应活性下降。相反,若羰基碳上连有吸电子基团性下降。相反,若羰基碳上连有吸电子基团(如如F F3 3C-C-等等)时,则会使时,则会使反应速率加快。反应速率加快
2、。空间因素,由于从反应物到过渡态及产物,羰基碳由空间因素,由于从反应物到过渡态及产物,羰基碳由spsp2 2杂化变为杂化变为spsp3 3杂化,反应中存在着明显的空间特性。在反应过程中,杂化,反应中存在着明显的空间特性。在反应过程中,R R基会被越来越近地挤在一起,非键张力使过渡态内能增加,不利基会被越来越近地挤在一起,非键张力使过渡态内能增加,不利于反应的进行之故:于反应的进行之故:R R基的体积增大时,反应速率迅速下降。基的体积增大时,反应速率迅速下降。NuNu体体积增大,同样也会降低反应速率。综合上述两方面的影响,可以得积增大,同样也会降低反应速率。综合上述两方面的影响,可以得出一般醛、
3、酮亲核加成反应的话性次序:出一般醛、酮亲核加成反应的话性次序:高等有机化学第八章第八章 亲核加成反应亲核加成反应高等有机化学Cl3CCHO HCHO RCHO RCOR RCOAr p-N(R)2-ArCOR RCHO ArCHO ArCOCH3二,二,羰基加成反应及产物羰基加成反应及产物(1)羰基与水形成水合物+H2OCH3CHOOHHCH3CH=O高等有机化学A A 对于多数醛酮平衡偏向左边,故醛的水合物多不稳定,它们对于多数醛酮平衡偏向左边,故醛的水合物多不稳定,它们容易脱水而生成醛酮容易脱水而生成醛酮。B 甲醛在水中可以完全变成水合物,但不易分离。甲醛在水中可以完全变成水合物,但不易分
4、离。C C 含吸电子基的羰基化合物其水合物比较稳定含吸电子基的羰基化合物其水合物比较稳定.如如:三氯乙醛三氯乙醛,六六氯丙酮氯丙酮,茚三酮茚三酮D D 酸和碱催化能加速水合物的形成酸和碱催化能加速水合物的形成(2)与醇与醇 形成半缩醛与缩醛形成半缩醛与缩醛H+CRH=OROH+HHCRHOOR+HCRHOORH半缩醛(Hemiacetal)高等有机化学+HRCRHOOR+HROHHCRHOORH+HCRHOOR高等有机化学A A 酮与简单的醇不易得到缩酮,但与乙二醇或丙三醇作用可酮与简单的醇不易得到缩酮,但与乙二醇或丙三醇作用可得到环状的缩酮得到环状的缩酮 。B硫醇与醛酮也能起类似的缩合反应,
5、并且比醇与醛酮缩合更硫醇与醛酮也能起类似的缩合反应,并且比醇与醛酮缩合更容易,这是因为硫的亲核能力比氧大。容易,这是因为硫的亲核能力比氧大。C C 缩醛和缩酮是一种醚类化合物,暴露在空气中易生成过氧缩醛和缩酮是一种醚类化合物,暴露在空气中易生成过氧化物,化物,D D 缩醛和缩酮在碱性条件下稳定,但在酸性水溶液中易缩醛和缩酮在碱性条件下稳定,但在酸性水溶液中易水解成醛酮。水解成醛酮。E E 在有机合成中常用缩醛和缩酮的生成来保护羰基在有机合成中常用缩醛和缩酮的生成来保护羰基高等有机化学(3)与含氮亲核试剂作用)与含氮亲核试剂作用+NH2XNXH2OCOCX=NH2 R OH CONH2 NHAr
6、 NHCONH2A 弱酸时对其有催化作用B 它们的反应产物一般是固体,在酸性条件下能水解还原成原来的醛酮C 仲胺与醛酮作用不能生成亚胺,但与含a 氢的醛酮作用得到烯胺高等有机化学+RNHROCC CH H3 3C CH H2 2C CH H3 3N NR RR R C CC CH HC CH H3 3C CH H3 3(4)与其它亲核试剂加成)与其它亲核试剂加成高等有机化学三三,羰基加成的立体化学羰基加成的立体化学高等有机化学+Nu AOCRROCRRHNu(1)如果羰基两边空间条件不相同,则进攻试剂从位阻小的一端进攻.NaBH4OOHH(2)4-叔丁基环己酮的优势构象为叔丁基在e键上.当进攻
7、试剂体积大时试剂从位阻小的一端进攻.高等有机化学HB(CHCH2CH3)3LiCH3O(CH3)3C+(CH3)3COHHH2O(3)当进攻试剂体积小时,则试剂可从a 键的方向进攻,得到的羟基为e键 NaBH4H2O(CH3)3C+O(CH3)3COHH高等有机化学Cram规则一规则一基团的大小顺序为基团的大小顺序为LMS,无分子内氢键。,无分子内氢键。:11.01.9CH3CH21:2.5CH31:24R+OHCH3HHRPhPhRHOHHCH32)H3O+1)CH3MgIOHRPhH(CH3)2CH高等有机化学Cram规则二规则二羰基邻位的不对称碳原子上有一羰基邻位的不对称碳原子上有一OH
8、,一,一NH2等能与羰基氧等能与羰基氧形成氢键的基团时,亲核试剂从含氢键环的空间阻碍小的形成氢键的基团时,亲核试剂从含氢键环的空间阻碍小的一边对羰基加成。一边对羰基加成。CORLRSCOZRY(3)Cram规则三规则三 当酮的当酮的a a手性碳原子上连接着卤原子时,由于卤原手性碳原子上连接着卤原子时,由于卤原于与碳基的偶极相互作用,使酮的优势构象是卤原子与碳基在问一于与碳基的偶极相互作用,使酮的优势构象是卤原子与碳基在问一平面上处于对位交叉位置,碳基进行反应时试剂优先从空间阻碍平面上处于对位交叉位置,碳基进行反应时试剂优先从空间阻碍最小的一边即小基团一侧进攻碳基碳原子,也称为最小的一边即小基团
9、一侧进攻碳基碳原子,也称为cornforth规规则。例如:则。例如:高等有机化学第八章第八章 亲核加成反应亲核加成反应四,含碳亲核试剂的加成反应四,含碳亲核试剂的加成反应(1)羟醛缩合具有具有H H的醛,在碱催化下生成碳负离子,的醛,在碱催化下生成碳负离子,-CH2CHO,-CH2CHO,然后然后 -CH2CHOCH2CHO作为一个亲核试剂对醛酮进行亲核加成,生成作为一个亲核试剂对醛酮进行亲核加成,生成-羟基醛,羟基醛,-羟基醛在加热时易脱水变成羟基醛在加热时易脱水变成、不饱合醛。不饱合醛。高等有机化学2_OH_H2OH2ORCH2COHRCH2CHCHCHOHORRCH2CHCCHOR碱催化
10、历程可以是烯醇负离子,也可以是碳负离子碱催化历程可以是烯醇负离子,也可以是碳负离子高等有机化学O*RHOOHR CH2 C CH C HOH*RHR CH2 C C C HRCH2CHOH2OStep 1*OR CH2 C HO*R CH C HStep 2Step 3O*R CH C HStep 4*RHOR CH2 C CH C HOH2O如果用两种不同的具有如果用两种不同的具有-H-H的醛缩合时为混合物,其产物复杂,的醛缩合时为混合物,其产物复杂,合成上意义不大。但无合成上意义不大。但无-H-H的醛可以与有的醛可以与有-H-H 的醛发生羟醛的醛发生羟醛缩合。如:甲醛和乙醛缩合,再通过歧化
11、反应可以生成季戊四缩合。如:甲醛和乙醛缩合,再通过歧化反应可以生成季戊四醇。醇。羟醛缩合也可在酸件环境下进行羟醛缩合也可在酸件环境下进行高等有机化学高等有机化学2 2 重要的缩合反应重要的缩合反应(1)Claisen-Schmidt reaction其过程是将酮滴加到无其过程是将酮滴加到无-H的醛中的醛中C6H5 CHO CH3CH2CHO+OH_10 CoC6H5 CH C CHOCH3上述构型中双键碳上所连的两个大的基团处在反位比较稳定(即上述构型中双键碳上所连的两个大的基团处在反位比较稳定(即构型以反式为主)。构型以反式为主)。当分子中含有两个羰基时(二醛、二酮、或一种醛与一种酮),当分
12、子中含有两个羰基时(二醛、二酮、或一种醛与一种酮),在碱催化作用下,也可发生分子内羟醛缩合生成五元环或六元环在碱催化作用下,也可发生分子内羟醛缩合生成五元环或六元环的不饱和醛酮。的不饱和醛酮。高等有机化学CH3 C CH2CH2CH2CHOOOHCOCH3(2)Knoevenagel缩合不含a氢的醛酮与含活泼的a氢的化合物的合成高等有机化学(3)Mannich反应反应 醛、胺和含活泼氢化合物缩合,使全部醛、胺和含活泼氢化合物缩合,使全部活泼活泼氢都进行胺甲基化得到氢都进行胺甲基化得到氨是酮。氨是酮。高等有机化学Mannich反应常在弱酸性介质中进行,因反应中必须有一定浓度的质子才有利于形成氨甲
13、基阳碳离子.Mannich反应在酸性溶液中的历程可能是:_H2O+H HC CH HO OH HN N(C CH H3 3)2 2H H+H H C C H HO OH HN N(C CH H3 3)2 2H H C C H HN N(C CH H3 3)2 2+H H C C H HN N(C CH H3 3)2 2+RCH2CORR RC CH H C C R RO OH HH H C C H HN N(C CH H3 3)2 2+RCH CORC CH H2 2N N(C CH H3 3)2 2+R RC CH H C C R RO OH HH H C C H HN N(C CH H3
14、3)2 2+活泼氢化合物可以是:高等有机化学C CH H N NO O2 2H HC CH H C CN NH HC CH H H HCOORCORC CH H H HCOOHR RC C C C H HC CH H H HR RO OR RS SH HH HO O H HH HH HN NO O2 2C CH H2 2 H H如如高等有机化学(4)安息香缩合)安息香缩合 苯甲醛在氰离子作用下生成二苯羟乙酮的苯甲醛在氰离子作用下生成二苯羟乙酮的反应反应H H+R RS SH H+H HC CH HO OH HN N(C CH H3 3)2 2+R RS SC CH H2 2N N(C CH H
15、3 3)2 2R RC CH H2 2N NO O2 2+H HC CH HO OH HN N(C CH H3 3)2 2+R RC CH HC CH H2 2N N(C CH H3 3)2 2N NO O2 2+H HC CH HO OH HN N(C CH H3 3)2 2+R RC CH HC CH H2 2N N(C CH H3 3)2 2N NO O2 2R RC CH H2 2N NO O2 2H H+H H+高等有机化学(5)Claisen缩合缩合 含含a-a-H的酯在碱的作用下得到的酯在碱的作用下得到酮酸酯酮酸酯CO-HCN+COHCCNO-HCO-HHCCNCO-HO-HCC
16、O-HO+CHOCN-CO-HCNCO-HCN高等有机化学(6)Darzen反应反应 (环氧酯合成环氧酯合成)醛酮在碱作用下与醛酮在碱作用下与“a a卤代酸酯反应生成卤代酸酯反应生成 环氧酯。环氧酯。高等有机化学Darzen反应在合成上的应用是基于环氧酯能以当量的氢氧化钠反应在合成上的应用是基于环氧酯能以当量的氢氧化钠水解为钠盐,然后用酸中和时发生脱羧和开环过程,最后互变水解为钠盐,然后用酸中和时发生脱羧和开环过程,最后互变异构为一个在羰基碳原于上增长一个碳的醛。因此,从苯乙酮异构为一个在羰基碳原于上增长一个碳的醛。因此,从苯乙酮经经Darzen反应可方便合成反应可方便合成2苯基丙醛。苯基丙醛
17、。高等有机化学如维生素如维生素A合成中间体的制备合成中间体的制备高等有机化学(7)混合酯缩合)混合酯缩合COOCH2CH3COOCH2CH3EtO-EtOH+CH2CH2COOC2H5CH2CHCOCOOEtCOOEt(8)酮酯缩合)酮酯缩合酮的酮的a a碳进攻酯的羰基的缩合:即酮在碱的作用下生成烯醇负碳进攻酯的羰基的缩合:即酮在碱的作用下生成烯醇负离子,进攻酯的羰基发生的缩合反应,产物为离子,进攻酯的羰基发生的缩合反应,产物为-二酮二酮高等有机化学+EtO-EtOHCH3COCH3-CH2COCH3CH3COCH2COCOOEtCOOCH2CH3COOCH2CH3COCH2CH3COOCH2
18、CH3OCH3COCH2C OCH2CH3COOCH2CH3O+EtO-EtOHCH3COCH3-CH2COCH3CH3COCH2CHOHCOOEtHCOCH2CH3O+完成下列反应完成下列反应高等有机化学OHCHO+CH2(COOC2H5)2NH高等有机化学OHCHO-CH(COOC2H5)2+COOEtCOOEtOHCH=CCOOEtCOOEtO-CH=COCHCCOCOOEt高等有机化学OH*OR CH2 C HO*R CH C HO*R CH C H(9)Perkin缩合缩合五,烯醇的烷基化反应五,烯醇的烷基化反应1,烯醇负离子烯醇负离子(1)烯醇负离子烯醇负离子 从碳基化合物中移去一
19、个质子得到的碳负离子是从碳基化合物中移去一个质子得到的碳负离子是烯醇负离子烯醇负离子烯醇负离子碳与氧均具有亲核性,但亲电试剂进攻一般主要发生在烯醇负离子碳与氧均具有亲核性,但亲电试剂进攻一般主要发生在碳上。(氧负离子电荷较集中,易溶剂化,此外,碳原子的核外电碳上。(氧负离子电荷较集中,易溶剂化,此外,碳原子的核外电子云变形大)子云变形大)O*R CH C H+CH3CH2 IO*CH2CH3R CH C H高等有机化学CH3COCH2COOEtRO-CH3C CHCOOEtO+CH3CH2 ICH2CH3CH3COCHCOOEt当乙酰乙酸乙酯在烷氧基碱的作用下与当乙酰乙酸乙酯在烷氧基碱的作用下
20、与1,3-二溴丙烷作用,产二溴丙烷作用,产物中有下列化合物出现物中有下列化合物出现试提出其反应机理试提出其反应机理高等有机化学(2)烯胺的烷基化与酰基化应)烯胺的烷基化与酰基化应 仲胺与醛酮在酸催化下缩合得到烯胺仲胺与醛酮在酸催化下缩合得到烯胺 它与卤代物反应生成烷基它与卤代物反应生成烷基化化(或酰基化或酰基化)产物,不对称酮和胺反应时,主要生成双键上取代产物,不对称酮和胺反应时,主要生成双键上取代最少的烯胺。如:最少的烯胺。如:高等有机化学H3O+H3O+CH3CH2COClCH3CH2CH2ClNCH3NCH3CH3CH2CH2+OCH3CH3CH2CH2OCH3NCH3CH3CH2CH2
21、C+CH3CH2CH2COO高等有机化学高等有机化学六,六,Michael 加成加成(1)定义活泼次甲基的阴碳离子向,不饱和羰基或不饱和羧酸衍生物等共轭体系进行的共轭加成称为Michael加成CH3CH CHCOOEt+CH2(COOEt)2+-CH(COOEt)2CH3CH CHCOOEtC2H5ONaC2H5OHC2H5OHCH3CH CHCOOEtCH(COOEt)2CH3CH CH2COOEtCH(COOEt)2(2)供电体形成阴碳离子的活泼次甲基化合物称为Michael供电体高等有机化学*CH3NO2*CH2(COOEt)2CH3CO*CH2COOEt*CH3NO2NCH3*CH3C
22、H2CN*(3)接受体,不饱和体为Michael加成的接受体CH3C CH CH2O OCH3CH CHCOOEtRCH CHCNCH2 CHNO2高等有机化学(4)反应机理B-+H C Z C ZCH3CH CHCOOEt+C ZCH3CH CHCOOEt C ZB HCH3CH CH COEt C ZOCH3CH CH COEt C ZOHCH3CH CHCOOEt C ZCH3CH CH2COOEt C ZB H高等有机化学CH3CH CHCOOEt+CH2(COOEt)2+-CH(COOEt)2CH3CH CHCOOEtC2H5ONaC2H5OHC2H5OHCH3CH CHCOOEtC
23、H(COOEt)2CH3CH CH2COOEtCH(COOEt)2OCH2CH2COOEtH3O+例例1例例2,合成,合成OCH2CH2COOEt为什以不直接在碱性条件下生成碳负离子,然后再进行加成为什以不直接在碱性条件下生成碳负离子,然后再进行加成高等有机化学OCH2CH2COOEtOCH2CH2COOEtMichael加成反应的应用(1)在合成上的意义+CH2 CH CNKOHCHCNC2H5CHCH2CH2CNC2H5导眠能中间体导眠能中间体利用Michael加成与Robinsen关环合成环关化合物高等有机化学OCH2CH2COOEtOCH2CH2COOEt+CH3C CH CH2O O
24、CH3C CH CH2O OO OC2H5ONaC2H5OHC2H5OHO OCH2CHC OCH3O OCH2CH2C OCH3O OCH2CH2C OCH2O OOHOH2OO+CH3C CH CH2O OCH3C CH CH2O OO OC2H5ONaC2H5OHC2H5OHO OCH2CHC OCH3O OCH2CH2C OCH3O OCH2CH2C OCH2O OOHOH2OO(2)合成子分析高等有机化学OCH2CH2COOEtOCH2CH2COOEtCH3COOOOO OCOOEtC6H5COOHOO OCH3COOOCH3COCH2COOEt+CH2 CHCOCH3高等有机化学O
25、CH2CH2COOEtOO OOO O+CH2 CHCOCH3C6H5COOHC6H5COOH+高等有机化学OCH2CH2COOEtOCH2CH2COOEtCH2(COOEt)2CH3C CHCOCH3CH3+OO OCOOEt高等有机化学OCH2CH2COOEtOCH2CH2COOEtCH3COOOCH3COCH2COOEt+CH2 CHCOCH3+H+H+Y ZYZ_Z-H+YH+-HYOCH2CH2COOEt3 3 取代反应实验的证实取代反应实验的证实通过中间体的分离和捕获等方法,巳证明了芳香亲电取代反应通过中间体的分离和捕获等方法,巳证明了芳香亲电取代反应中中络合物的存在。络合物的存在
26、。例如,在低温下用硝酰氟和氟化硼硝化三氟甲苯的反应,例如,在低温下用硝酰氟和氟化硼硝化三氟甲苯的反应,其中间体其中间体络合物已被分离出来,结构也为核磁共振所证实。络合物已被分离出来,结构也为核磁共振所证实。OCH2CH2COOEt+H+H+Y ZYZ_Z-H+YH+-HY+H+H+Y ZYZ_Z-H+YH+-HY3 3 取代反应实验的证实取代反应实验的证实通过中间体的分离和捕获等方法,巳证明了芳香亲电取代反应通过中间体的分离和捕获等方法,巳证明了芳香亲电取代反应中中络合物的存在。络合物的存在。例如,在低温下用硝酰氟和氟化硼硝化三氟甲苯的反应,例如,在低温下用硝酰氟和氟化硼硝化三氟甲苯的反应,其
27、中间体其中间体络合物已被分离出来,结构也为核磁共振所证实。络合物已被分离出来,结构也为核磁共振所证实。MeMeMeMeFCH2CH3BF3MeMeHEt+BF4-再例;再例;这些中间体都以用核磁进行检定这些中间体都以用核磁进行检定高等有机化学 络合物系一种活性中间体,在某些情况下,可由亲核试剂捕络合物系一种活性中间体,在某些情况下,可由亲核试剂捕获再根据捕获生成物推论获再根据捕获生成物推论络合物的存在,以证明芳烃正离络合物的存在,以证明芳烃正离子机理。如:子机理。如:二,亲电试剂二,亲电试剂高等有机化学第一章有机反应总论下面为常见的亲电试剂及其生成的形式下面为常见的亲电试剂及其生成的形式以上亲
28、电试剂是强亲电体,既可取代含致活定位基的劳环也可取以上亲电试剂是强亲电体,既可取代含致活定位基的劳环也可取代含致钝基团的芳环代含致钝基团的芳环高等有机化学第一章有机反应总论以上亲电试剂只能取代含致活取代基团的芳环以上亲电试剂只能取代含致活取代基团的芳环高等有机化学第一章有机反应总论三三,定位效应与取代活性定位效应与取代活性1 带有负电荷或孤对电子的原子和基团连接在苯环上时,它们一般是邻对位定位基,较强的至活基团.NH2OHSH高等有机化学第一章有机反应总论2 2 卤素是一种邻对位定位基但是至钝基团卤素是一种邻对位定位基但是至钝基团.3 3 带正电荷的基团或不饱和键直接与苯环相连的基团是至钝基带
29、正电荷的基团或不饱和键直接与苯环相连的基团是至钝基,一般是间位定位基一般是间位定位基.+NR3C=ON=Oph-,RO-,R 一般是邻对位定位基,至活基团常见的致活基团有:常见的致活基团有:高等有机化学第一章有机反应总论5 5 当苯环上有两个不同的定位基时当苯环上有两个不同的定位基时,第三个基团进入的位置主要第三个基团进入的位置主要以邻对位定位基决定以邻对位定位基决定.高等有机化学第一章有机反应总论C=ON=OCH3OCH3CH3OCH36 6 当苯环上连有取代基都属邻对位定位基时当苯环上连有取代基都属邻对位定位基时,第三个基团进入第三个基团进入强的基团的定向位置强的基团的定向位置.ClCH3
30、高等有机化学第一章有机反应总论7 当苯环上连有两个间位定位基时当苯环上连有两个间位定位基时,第三个基团很难进入第三个基团很难进入,即便即便进入其位置以间位强的定向为主进入其位置以间位强的定向为主.为了定量表示基团的定位效应,引入分速度因子为了定量表示基团的定位效应,引入分速度因子(或因数或因数)的概念,的概念,它以苯的六个位置之它以苯的六个位置之为比较标难为比较标难(规定其值为规定其值为1)1)衡量取代苯中衡量取代苯中某个取代位置的反应活性的数值。其值大于某个取代位置的反应活性的数值。其值大于1 1的,说明该位置的反的,说明该位置的反应活性大于苯,小于应活性大于苯,小于1 1者则反应活性小于苯
31、。其计算式为:者则反应活性小于苯。其计算式为:高等有机化学第一章有机反应总论高等有机化学第一章有机反应总论四,典型的亲电取代反应实例四,典型的亲电取代反应实例1 1 付克烷基化付克烷基化烯烯 醇醇 卤代烃都可作为烷基化剂卤代烃都可作为烷基化剂烷基化一般会发生重排烷基化一般会发生重排环上的烷基化也可发生重排环上的烷基化也可发生重排如果烷基化能成环时尽是以五元环或六元环为宜如果烷基化能成环时尽是以五元环或六元环为宜如果环上有如果环上有OH-,NH2-,OR-,OH-,NH2-,OR-,反应不易进行?反应不易进行?高等有机化学第一章有机反应总论AlCl3CH2CH2CH2CH2Cl2 酰化反应酰化反
32、应酰化反应一般不重排酰化反应一般不重排在合成上可以通过合成酮然后得到不重排的烃在合成上可以通过合成酮然后得到不重排的烃如合成间丁基苯磺酸钠是一种较好的缓蚀剂,如何合成该物质如合成间丁基苯磺酸钠是一种较好的缓蚀剂,如何合成该物质高等有机化学第一章有机反应总论+ClCOCH2CH2CH2ClAlCl3COCH2CH2CH2ClAlCl3O在酰化反应中注意选择性反应在酰化反应中注意选择性反应+ClCOCH2CH2CH3AlCl3COCH2CH2CH3H2SO4CH2CH2CH2CH3COCH2CH2CH3SO3HAlCl3SO3H高等有机化学第一章有机反应总论酰酰 胺在胺在POCl3作用下作用下,也
33、可得到苯环上含羰基的反应也可得到苯环上含羰基的反应Gatterman Koch 反应反应Reimer-tiemann反应反应主要是在芳环上引入甲酰基。主要是在芳环上引入甲酰基。重氮盐的偶联重氮盐的偶联酚与胺中有吸电子基使反应难进行酚与胺中有吸电子基使反应难进行芳香重氮盐中芳环上有吸电子基反应加快芳香重氮盐中芳环上有吸电子基反应加快.3 影响邻影响邻/对位取代产物的比例因素对位取代产物的比例因素(1)空间效应空间效应(2)电子效应电子效应(3)试剂与苯环上原有基团作用的影响)试剂与苯环上原有基团作用的影响高等有机化学第一章有机反应总论高等有机化学第一章有机反应总论+OCH3BrHNO3OCH3B
34、rNO2+OCH3NO2+AlCl3CMe3CMe3CMe3Br2CMe3BrBr4 离去基团效应(或自位取代)离去基团效应(或自位取代)高等有机化学第一章有机反应总论高等有机化学第一章有机反应总论2+CHOAlCl3写出下列反应产物写出下列反应产物2+AlCl3ClCl3CCHO解释下列反应解释下列反应高等有机化学第一章有机反应总论高等有机化学第一章有机反应总论第二节,第二节,芳香化合物的亲核取代反应芳香化合物的亲核取代反应1 SNAr机理机理 其过程示意如下:其过程示意如下:该络合物已被子分离出,紧接着乙氧基离开该络合物已被子分离出,紧接着乙氧基离开高等有机化学第一章有机反应总论第二节,第
35、二节,芳香化合物的亲核取代反应芳香化合物的亲核取代反应2 分子内亲核取代的转位反应分子内亲核取代的转位反应(Smile reaction)如:如:高等有机化学第一章有机反应总论第二节,第二节,芳香化合物的亲核取代反应芳香化合物的亲核取代反应2 分子内亲核取代的转位反应分子内亲核取代的转位反应(Smile reaction)高等有机化学第一章有机反应总论芳香环的亲核取代机理与亲电取代反应机理非常相似,属于芳香环的亲核取代机理与亲电取代反应机理非常相似,属于SN2型,芳环上的型,芳环上的SN2称称SNAr3,SN1机理机理 某些重氮盐发生亲核取代反应时按某些重氮盐发生亲核取代反应时按SN1机理进行。机理进行。高等有机化学第一章有机反应总论4,苯炔机理苯炔机理 卤代芳烃在强碱作用下,取代反应按苯炔机理卤代芳烃在强碱作用下,取代反应按苯炔机理进行。进行。高等有机化学第一章有机反应总论思考题:思考题:1 写出下列反应的机理写出下列反应的机理高等有机化学第一章有机反应总论高等有机化学第一章有机反应总论由指定原料合成下列化合物由指定原料合成下列化合物高等有机化学第一章有机反应总论高等有机化学第一章有机反应总论高等有机化学第一章有机反应总论试写出下列反应的机理试写出下列反应的机理高等有机化学第一章有机反应总论高等有机化学第一章有机反应总论
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
