 2022高中必修一化学镁铝铁知识归纳
2022高中必修一化学镁铝铁知识归纳


《2022高中必修一化学镁铝铁知识归纳》由会员分享,可在线阅读,更多相关《2022高中必修一化学镁铝铁知识归纳(11页珍藏版)》请在装配图网上搜索。
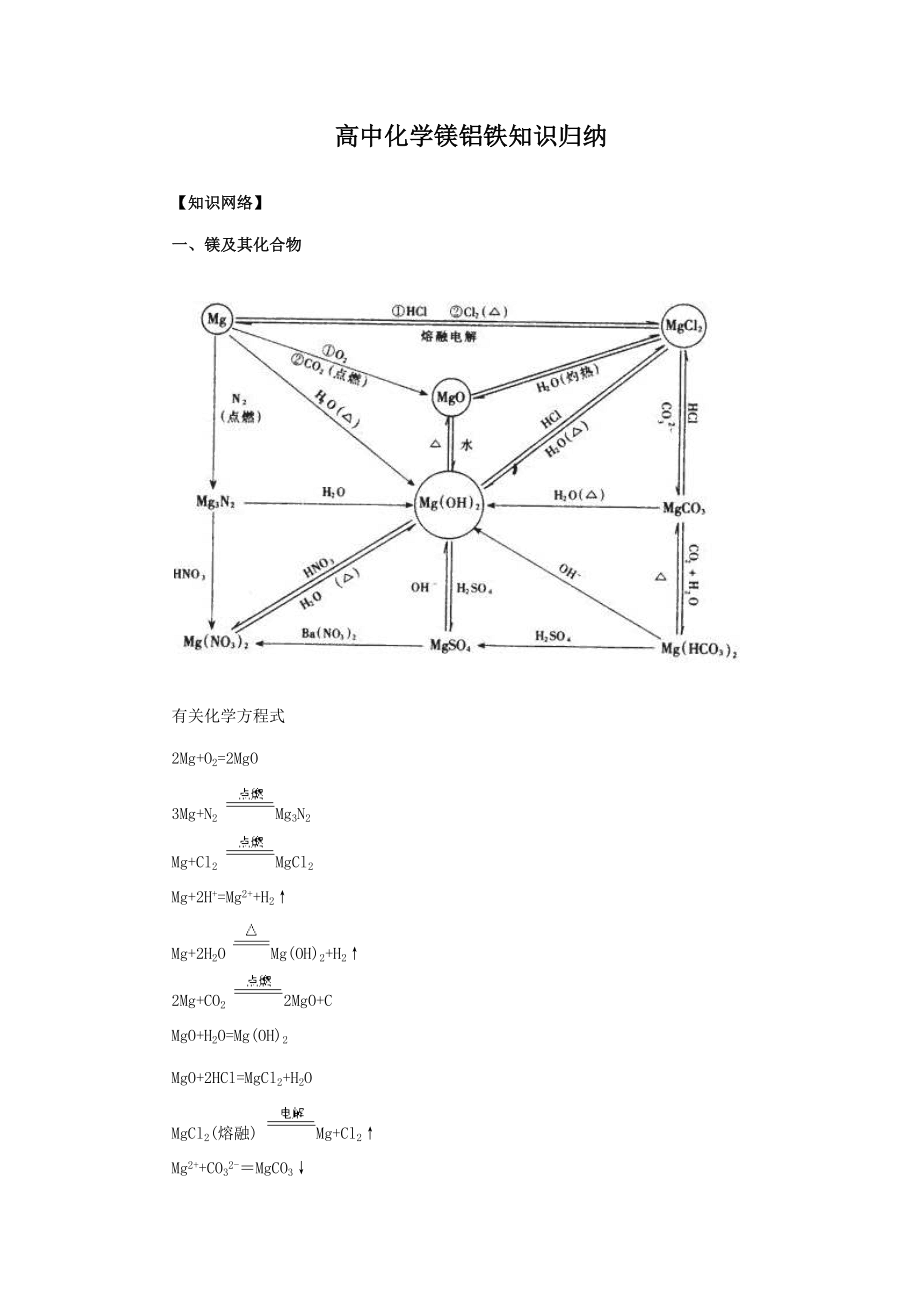
1、高中化学镁铝铁知识归纳【知识网络】一、镁及其化合物有关化学方程式2Mg+O2=2MgO3Mg+N2 Mg3N2Mg+Cl2 MgCl2Mg+2H+=Mg2+H2Mg+2H2O Mg(OH)2+H22Mg+CO2 2MgO+CMgO+H2O=Mg(OH)2MgO+2HCl=MgCl2+H2OMgCl2(熔融) Mg+Cl2Mg2+CO32-MgCO3MgCO3+2H+Mg2+CO2+H2OMgCO3+CO2+H2OMg(HCO3)2MgCO3+H2O Mg(OH)2+CO2Mg(OH)2 MgO+H2OMg3N2+6H2O3Mg(OH)2+2NH3 二、铝及其化合物有关化学方程式4Al+3O22
2、Al2O33S+2Al Al2S32Al+3Cl2 2AlCl32Al+6HCl2AlCl3+3H22Al+6H2O 2Al(OH)3+3H22Al+Fe2O3 Al2O3+2Fe2Al+2NaOH+2H2O2NaAlO2+3H2Al2O3+6HCl2AlCl3+3H2OAl2O3+2NaOH2NaAlO2+2H2OAl3+3H2O=Al(OH)3+3H+Al3+3NH3H2O=Al(OH)3+3NH4+Al3+3OH-=Al(OH)3Al3+4OH-=AlO2-+2H2OAl2S3+6H2O=2Al(OH)3+3H2SAl(OH)3+3H+=Al3+3H2OAl(OH)3+OH-=AlO2-
3、+2H2OAlO2-+CO2+2H2O=Al(OH)3+HCO3-AlO2-+H+H2O=Al(OH)3AlO2-+4H+=Al3+2H2O3AlO2-+Al3+6H2O=4Al(OH)3 三、铁及其化合物有关化学方程式3Fe+2O2(纯) Fe3O4Fe+S FeS2Fe+3Cl2 2FeCl3Fe+2H+Fe2+H23Fe+4H2O Fe3O4+4H2Fe+Cu2+Cu+Fe2+FeO+2HClFeCl2+H2OFe(OH)2+2HClFeCl2+2H2O4Fe(OH)2+O2+2H2O4Fe(OH)32FeCl2+Cl22FeCl3FeS+2H+Fe2+H2S2Fe3+Fe3Fe2+4F
4、eS2+11O2 2Fe2O3+8SO2Fe2O3+6H+2Fe3+3H2OFe2O3+3CO 2Fe+3CO2Fe3+3H2O Fe(OH)3+3H+Fe3+SCN-=Fe(SCN)2+Fe(OH)3+3H+Fe3+3H2O2Fe(OH)3 Fe2O3+3H2O【各部分知识回忆】一、镁1原子构造示意图:2单质(1)在周期表中位置:第三周期A族(碱土金属) (2)物理性质:银白色,质软,轻金属,硬度较小,熔沸点较低。 (3)化学性质与非金属反映 (发出耀眼白光),常温形成致密氧化膜 与非金属氧化物反映 与非氧化学性质酸反映 与氧化学性质酸(如硝酸、浓硫酸)反映,不放出H2 与水反映 (能使酚酞
5、变红) 与盐溶液反映,能置换出背面旳金属 (4)冶炼: (5)用途:制轻合金、飞机、汽车部件、烟火、照明弹等。 3化合物(1)MgO物理性质:白色粉末,密度小,熔点高,硬度大,难溶于水。 化学性质:碱性氧化物, (缓慢) 制法:MgCO3 MgO+CO2 用途:耐火材料 (2)Mg(OH)2:难溶性中强碱: (3)MgCl2:无色、味苦、易溶、易潮解旳白色晶体,具有可溶性盐旳通性。 (4)KClMgCl26H2O(光卤石):从中可提取MgCl26H2O 二、铝1原子构造示意图:2在周期表中位置:第三周期A族 3单质(1)物理性质:银白色,质软,轻金属。 (2)化学性质与金属反映常温下被O2氧化
6、,形成致密氧化膜,在O2中或高温下点燃生成Al2O3 4Al+3O2 2Al2O3与Cl2、S等非金属反映 2Al+3Cl2 2AlCl3 2Al+3S Al2S3 与Fe3O4、WO3、MnO2等金属氧化物发生铝热反映8Al3Fe3O4 4Al2O39Fe 与非氧化性酸发生置换反映2Al+6H+2Al3+3H2 注:常温下在浓硫酸、浓硝酸中钝化。 与沸水发生置换反映2Al+6H2O 2Al(OH)3+3H2 与强碱液液反映: 与盐溶液反映,置换背面旳金属 (3)冶炼: (熔融电解) (4)用途:制轻合金、飞机、汽车、轮船部件,导线,炊具、还原剂,铝热剂。 4化合物(1)Al2O3物理性质:白
7、色难溶固体,熔点高,硬度大。 化学性质:两性氧化物Al2O3+6H+=2Al3+3H2OAl2O3+2OH-=2AlO2-+H2O 制法: 用途:制铝、耐火材料。刚玉可做仪器、手表轴承、磨料等。 (2)Al(OH)3:两性氢氧化物,不溶于水旳白色胶状物 Al(OH)3+3H+Al3+3H2OAl(OH)3+OHAlO2+2H2O (3)AlCl3:具有可溶性盐旳通性,能水解而呈酸性,只存在于酸性溶液中。 (4)NaAlO2:易水解而显碱性,只存在于强碱性溶液中AlO2+ H+ H2OAl(OH)3 (5)KAl(SO4)212H2O(明矾):属复盐,易水解生成胶状Al(OH)3,可做净水剂。
8、三、铁1原子构造示意图: 能失去最外层2个电子及第三层1个电子 2在周期表中位置:第四周期第族,属过渡元素 3存在游离态:少量存在于陨石中。 化合态:赤铁矿、磁铁矿、褐铁矿、黄铁矿、菱铁矿。 4单质(1)物理性质:银白色,=7.86gcm3,熔点1535;纯铁抗蚀能力较强,能被磁铁吸引和磁化。 (2)化学性质:典型金属,有金属通性。 与非金属反映与O2:常温干燥空气中不易与O2反映 ,但在潮湿空气中易形成原电池等形式被腐蚀;铁粉能在纯氧中燃烧: 与卤素: I2+Fe FeI2与硫: 与酸反映非氧化学性质酸: 与浓硝酸、浓硫酸:常温下钝化,加热时反映 与盐: 与水: (3)冶炼: 5化合物(1)氧化物:FeO、Fe2O3、Fe3O4 (2)氢氧化物:Fe(OH)2、Fe(OH)3 (3)盐:亚铁盐:FeSO47H2O(绿矾) 铁盐:FeCl3、Fe2(SO4)3 络盐:Fe(SCN)n3n(n=16)
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
