 化学物质与蛋白质相互作用总结
化学物质与蛋白质相互作用总结


《化学物质与蛋白质相互作用总结》由会员分享,可在线阅读,更多相关《化学物质与蛋白质相互作用总结(4页珍藏版)》请在装配图网上搜索。
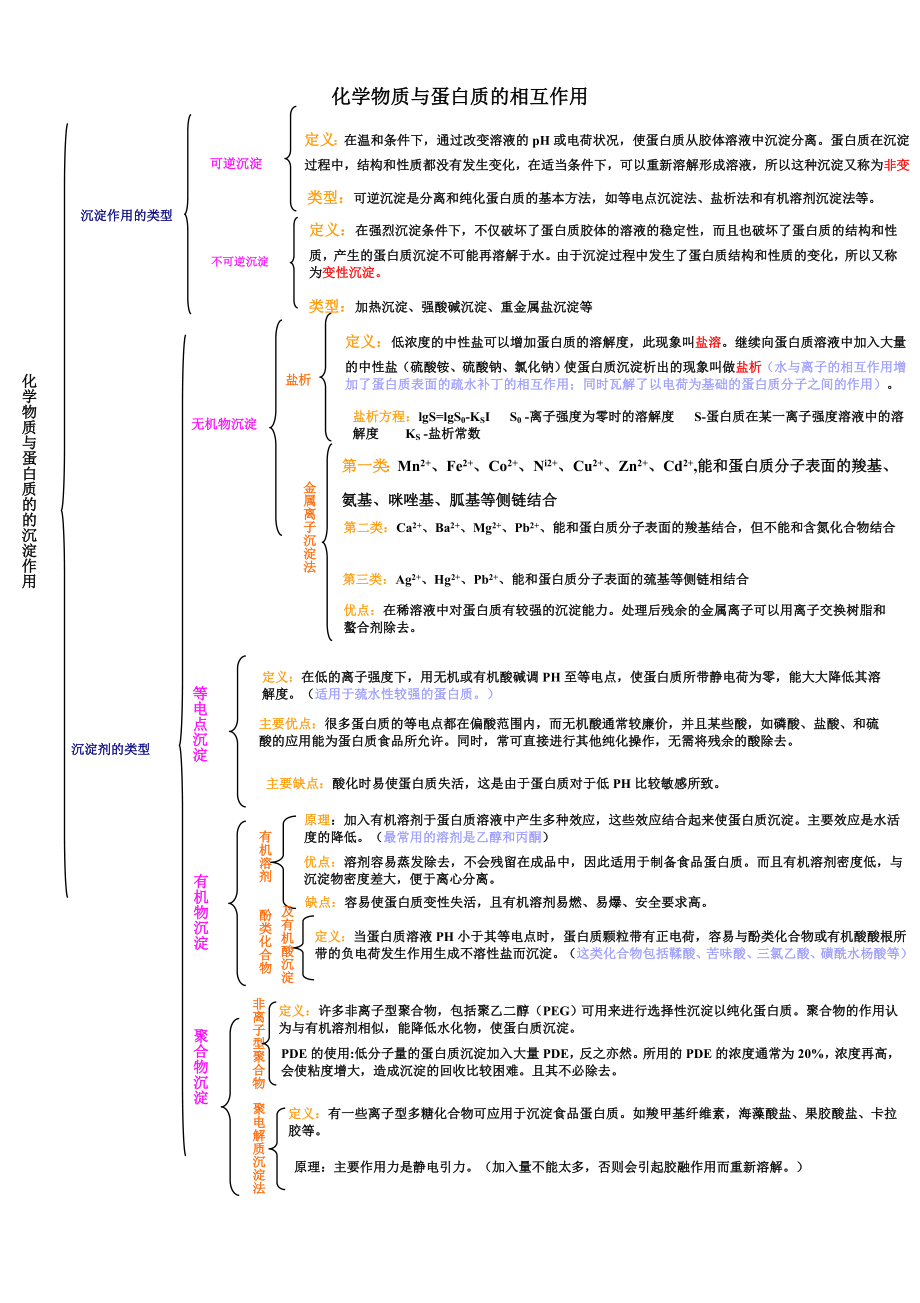
1、化学物质与蛋白质的相互作用定义:当蛋白质溶液PH小于其等电点时,蛋白质颗粒带有正电荷,容易与酚类化合物或有机酸酸根所带的负电荷发生作用生成不溶性盐而沉淀。(这类化合物包括鞣酸、苦味酸、三氯乙酸、磺酰水杨酸等)缺点:容易使蛋白质变性失活,且有机溶剂易燃、易爆、安全要求高。原理:主要作用力是静电引力。(加入量不能太多,否则会引起胶融作用而重新溶解。)定义:有一些离子型多糖化合物可应用于沉淀食品蛋白质。如羧甲基纤维素,海藻酸盐、果胶酸盐、卡拉胶等。聚电解质沉淀法酚类化合物非离子型聚合物PDE的使用:低分子量的蛋白质沉淀加入大量PDE,反之亦然。所用的PDE的浓度通常为20%,浓度再高,会使粘度增大,
2、造成沉淀的回收比较困难。且其不必除去。定义:许多非离子型聚合物,包括聚乙二醇(PEG)可用来进行选择性沉淀以纯化蛋白质。聚合物的作用认为与有机溶剂相似,能降低水化物,使蛋白质沉淀。及有机酸沉淀聚合物沉淀沉淀剂的类型 优点:溶剂容易蒸发除去,不会残留在成品中,因此适用于制备食品蛋白质。而且有机溶剂密度低,与沉淀物密度差大,便于离心分离。原理:加入有机溶剂于蛋白质溶液中产生多种效应,这些效应结合起来使蛋白质沉淀。主要效应是水活度的降低。(最常用的溶剂是乙醇和丙酮)有机溶剂有机物沉淀化学物质与蛋白质的的沉淀作用主要缺点:酸化时易使蛋白质失活,这是由于蛋白质对于低PH比较敏感所致。等电点沉淀主要优点:
3、很多蛋白质的等电点都在偏酸范围内,而无机酸通常较廉价,并且某些酸,如磷酸、盐酸、和硫酸的应用能为蛋白质食品所允许。同时,常可直接进行其他纯化操作,无需将残余的酸除去。定义:在低的离子强度下,用无机或有机酸碱调PH至等电点,使蛋白质所带静电荷为零,能大大降低其溶解度。(适用于巯水性较强的蛋白质。)类型:加热沉淀、强酸碱沉淀、重金属盐沉淀等优点:在稀溶液中对蛋白质有较强的沉淀能力。处理后残余的金属离子可以用离子交换树脂和螯合剂除去。第二类:Ca2+、Ba2+、Mg2+、Pb2+、能和蛋白质分子表面的羧基结合,但不能和含氮化合物结合第一类:Mn2+、Fe2+、Co2+、Ni2+、Cu2+、Zn2+、
4、Cd2+,能和蛋白质分子表面的羧基、氨基、咪唑基、胍基等侧链结合定义:在强烈沉淀条件下,不仅破坏了蛋白质胶体的溶液的稳定性,而且也破坏了蛋白质的结构和性质,产生的蛋白质沉淀不可能再溶解于水。由于沉淀过程中发生了蛋白质结构和性质的变化,所以又称为变性沉淀。第三类:Ag2+、Hg2+、Pb2+、能和蛋白质分子表面的巯基等侧链相结合金属离子沉淀法无机物沉淀盐析方程:lgS=lgS0-KSI S0 -离子强度为零时的溶解度 S-蛋白质在某一离子强度溶液中的溶解度 KS -盐析常数 定义:低浓度的中性盐可以增加蛋白质的溶解度,此现象叫盐溶。继续向蛋白质溶液中加入大量的中性盐(硫酸铵、硫酸钠、氯化钠)使蛋
5、白质沉淀析出的现象叫做盐析(水与离子的相互作用增加了蛋白质表面的疏水补丁的相互作用;同时瓦解了以电荷为基础的蛋白质分子之间的作用)。盐析不可逆沉淀沉淀作用的类型类型:可逆沉淀是分离和纯化蛋白质的基本方法,如等电点沉淀法、盐析法和有机溶剂沉淀法等。定义:在温和条件下,通过改变溶液的pH或电荷状况,使蛋白质从胶体溶液中沉淀分离。蛋白质在沉淀过程中,结构和性质都没有发生变化,在适当条件下,可以重新溶解形成溶液,所以这种沉淀又称为非变性沉淀。可逆沉淀强酸和强碱:强的无机酸碱以及有机酸碱都可以改变蛋白质的pH,引起蛋白质表面必须基团的电离;由于各氨基酸残基所带电荷的相互吸引或者相互排斥使蛋白质的空间结构
6、发生较大变化,造成蛋白质分子聚集,导致不可逆失活;在强酸、强碱条件下,肽键也容易发生断裂。氧化剂:各种氧化剂能够氧化芳香族侧链的氨基酸以及甲硫氨酸、半胱氨酸、和胱氨酸残基;分子氧、过氧化氢氧自由基等是最常见的氧化剂。在生物体内,蛋白质的失活主要是通过活性氧(羟基自由基、超氧离子、过氧化氢、过氧化物等来完成的。)阴离子:如SDS(十二烷基硫酸钠)离子表面活性剂:去污剂和活性表面剂:都具有长链疏水尾和亲水的极性头阳离子:癸基三甲基氯化铵、十六烷基三甲基氯化铵等,对蛋白质的变形能力比阴离子弱。蛋白质不可逆失活的化学因素非离子去污剂:通常不能使蛋白质变性。脲和盐酸胍:高浓度的脲(810mol/L)和盐
7、酸胍(6mol/L)与蛋白质多肽链作用,破坏蛋白质分子内维持其二级结构和高级结构的氢键,引起蛋白质不可逆失活。有机溶剂:取代蛋白质表面的结合水,并通过疏水作用与蛋白质结合,改变溶液的介电常数,从而影响维持蛋白质天然构想的非共价力的平衡。变性剂螯合剂:EDTA与金属离子形成配位聚合物,从而使酶失去金属辅助因子,从而导致酶或者蛋白质的构想发生较大的改变,导致蛋白质不可逆失活。化学物质对蛋白质的稳定作用重金属离子:(如Hg2+、Cd2+、Pb2+等)能与能与蛋白质分子中的半胱氨酸的巯基、组氨酸的咪唑基、色氨酸的吲哚基反应,使蛋白质不可逆失活。重金属离子和巯基试剂巯基试剂:(如巯基乙醇)通过还原蛋白质
8、分子内的二硫键使蛋白质失活(一般可逆)。低分子量的含二硫键的试剂可以与蛋白质分子中的的巯基作用,使蛋白质失活。固化法:将酶或者蛋白质多点连接于载体上。常用方法:添加剂:保护蛋白质不受氧化剂氧化,不受变性剂变性化学修饰:共价交联,使蛋白质构想固化。共溶剂:糖类、醇、氨基酸及其衍生物、无机盐、甘油、多聚物(如聚乙二醇)等被称为蛋白质共溶剂。其改变溶液的热力学性质,在蛋白质表面完全水化和共溶剂完全结合之间建立平衡,使天然蛋白质稳定性增强,理论上成为优先排阻作用。蛋白质的稳定抗氧化剂和还原剂:蛋白质表面的半胱氨酸极容易被空气中的氧缓慢氧化而变成次磺酸或者二硫化物,从而使蛋白质的电荷或者形状发生改变而失
9、活。(加入一些巯基试剂或者植物蛋白质课防止这种氧化。)添加剂底物、辅酶:一些酶可以被底物、辅酶或者竞争性抑制剂及反应产物所稳定。其可能是降低活性中心的能量水平,使酶趋于稳定。金属离子:如Ca2+的存在可以稳定枯草杆菌蛋白酶、灰色链丝菌蛋白酶和胰蛋白酶等,Ca2+与这些蛋白质的结合相当于与底物结合。重金属离子可能引起酶活性抑制。同行双功能试剂:两端具有相同的活性反应基团,如N-羟基琥珀酰亚胺酯,二硝基氟苯、双亚胺基酯等对氨基有专一性,戊二醛也可与羟基反应。可裂解型交联剂:化学交联剂异性双功能交联剂:一端与氨基作用,另一端与巯基作用(用碳二亚胺做交联剂,第二个反应基团是羧基)。具有两个反应活性部位
10、的双功能基团不可裂解型交联剂可被光活化的交联剂:一端先于蛋白质反应,经光照后,另一端再产生一个活性基团,如碳烯或者氮烯,他们具有较高反应性,没有专一性。共价结合:当外源化合物的活性代谢产物与细胞内重要生物大分子共价结合时,发生烷基化或芳基化,导致DNA损伤,蛋白质正常功能丧失,乃至细胞的损伤和死亡。外源化合物与生物大分子相互作用主要两个方式非共价结合可与蛋白质发生反应的化合物(课本148页表格):除少数烷化剂外,绝大多数外源化合物需经体内代谢活化,转为亲电子的活性代谢物再与细胞内生物大分子的亲核部位和基团发生共价结合。生物体内蛋白质加合物的形成蛋白质分子中的可反应基团:氨基酸分子中的氨基和羧基
11、、丝氨酸和苏氨酸特有的羟基、半胱氨酸分子中的巯基,精氨酸分子中的胍基、组氨酸分子中的咪唑基、酪氨酸分子内中的酚基、色氨酸分子中的吲哚基。这些部位与源化合物发生共价结合,会影响蛋白质的结构和功能。与蛋白质的共价结合:白蛋白是血液和组织间质中的主要蛋白质,也是脂肪酸、内源性(生物体内存在)化合物及外源性(非生物体内存在)化合物运输的主要载体,容易与终致癌物结合形成共价加合物。化学物质对蛋白质侧链基团的共价修饰作用与血红蛋白共价结合:外援化合物进入血液后,可与红细胞膜结合而进入红细胞内与血红蛋白发生共价结合。与细胞内蛋白质发生共价结合:进入体内的外源化合物或其代谢产物可与浆胞、质膜以及细胞核内的蛋白
12、质发生共价结合形成加合物。(如溴苯一种重要的肝脏毒物);有些非遗传毒性致癌物与浆胞蛋白或者核蛋白共价结合,对细胞造成不利影响。蛋白质侧链基团的修饰是通过选择性的试剂或亲和标记试剂与蛋白质分子侧链上特定的功能基团发生化合反应来实现的。修饰试剂的作用不专一,不但与蛋白质必须基团作用,也和非必须基团作用。烷基化试剂是一种重要的巯基修饰试剂,尤其是碘乙酸和碘乙酰胺,可用于多肽链氨基酸顺序分析过程中防止半胱氨酸的氧化。N-乙基马来酰亚胺:有较强的专一性,伴随光变化,容易通过光吸收变化确定反应程度。巯基化学修饰特定的氨基酸残基侧链基团的修饰5,5-二硫-2-硝基苯甲酸(DTNB):又称Ellman试剂,最
13、常用的巯基修饰试剂,可通过光吸收变化确定反应程度有机汞试剂:最常用对氯汞苯甲酸,溶于水中形成羟基衍生物,与巯基相互作用时在255nm处光吸收具有较大的增强效应。氨基化学修饰:赖氨酸残基可被选择性修饰,三硝基苯磺酸(TNBS)与赖氨酸残基发生反应,在420nm处和367nm处有光吸收羧基化学修饰:水溶性的碳化二亚胺类化学物可修饰蛋白质分子中的羧基基团咪唑基的化学修饰:组氨酸残基的咪唑基课通过氮原子的烷基化或碳原子的亲核取代来修饰,常用焦炭酸(DPC)二乙脂来修饰酚和脂肪族羟基的化学修饰:四硝基甲烷(TNM)可用于修饰络氨酸残基,产生离子化的发色基团3-硝基络氨酸衍生物。丁二酮和1,2-环己二酮与
14、胍基反应可逆生成精氨酸-丁二酮复合物,该物与硼酸结合稳定。胍基的化学修饰:苯乙二醛:两分子苯乙二醛与一份子精氨酸残基不可逆结合。精氨酸残旧修饰试剂(如4-羟基-3-硝基苯乙二醛)可使被修饰的精氨酸残基在405nm处具有光吸收。对硝基苯乙二醛修饰精氨酸残基可以得到唯一产物。亲和性标记:对于底物或者配体的结合部位具有一定亲和性,因而能够结合选择性的结合在蛋白质的表面上的特定部位;由于它们的化合反应性,这类类似物能够与蛋白质分子共价结合;这类反应试剂具有饱和性,与底物或者天然配体竞争蛋白质的结合位点。 主要有光亲和标记和自杀性抑制剂两种类型,自杀性抑制剂作为底物没有反应活性。双缩脲法:双缩脲与碱性溶
15、液中与二价铜离子生成紫红色化合物,具有2个和2个以上化合物都具有双缩脲反应,紫红色化合物可在540nm处测量吸光度常见的蛋白质荧光探针有:1-苯氨基-8-萘磺酸(ANS)、2-对甲苯胺基萘-6-磺酸(TNS)、1-(N-二甲胺)萘-5-磺酸(DNS)和荧光胺光散射探针分析的基础:试剂分子或络合物与蛋白质结合,导致体系的光散射信号明显增强。用作蛋白质分析的光散射探针与蛋白质的吸收光谱探针相类似,大多数探针属于三苯甲烷类,比如卟啉环、偶氮类、溴酚蓝、落天青等染料探针溴酚蓝:该试剂颜色对比度为160nm,反应在pH3.2左右进行,在600nm测量吸光度。溴甲酚绿:对比度约为170nm,反应在pH4.
16、2进行,628nm测量吸光度。考马斯亮蓝:在酸性条件下,考马斯亮蓝与蛋白质结合。其吸收高峰从465nm移至595nm,颜色由棕黄色转为深蓝色蛋白质荧光探针作为一个好的荧光探针满足的条件蛋白质吸光探针1.探针分子与蛋白质分子的某一微区必须有特异性的结合,并且结合比较牢固;2.探针的荧光必须对环境条件敏感3.蛋白质分子与探针结合后不影响其原来的结构和特性。蛋白质分子中存在络氨酸、色氨酸、苯丙氨酸残基,能够吸收270300nm的紫外光而发出紫外荧光。小分子配体能与蛋白质发生相互作用,导致蛋白质荧光的淬灭,利用小分子配体对蛋白质内源性荧光的淬灭这一现象可以确定蛋白质与小分子配体的作用类型及结合部位。蛋白质光散射探针原理:利用蛋白质和染料结合成沉淀或者改变结合燃料的光吸收特性,借助燃料颜色的颜色的减退或减退变化的程度来测定蛋白质的含量。双辛可宁酸法(BCA法):在碱性条件下,蛋白质分子中的肽键与铜离子反应生成Cu(I)、Cu(I)再与BCA反应形成紫色络合物,在565nm测量吸光度。Folin-Lowry法:Lowry等将双缩脲试剂和Folin酚试剂结合使用,在蛋白质发生双缩脲反应之后,再和Folin酚试剂反应,此试剂在碱性条件下被蛋白质中络氨酸的酚基还原,生成颜色更深的化合物,可在640nm处测量。金属探针蛋白质光谱探针
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
