 物理化学电子教案:07章_统计热力学基础
物理化学电子教案:07章_统计热力学基础


《物理化学电子教案:07章_统计热力学基础》由会员分享,可在线阅读,更多相关《物理化学电子教案:07章_统计热力学基础(113页珍藏版)》请在装配图网上搜索。
1、 物理化学电子教案第七章第七章 统计热力学基础7.1 概论7.5 各配分函数的求法及其对热力学函数的贡献*7.3 Bose-Einstein统计和Fermi-Dirac统计7.4 配分函数7.2 Boltzmann 统计 *7.6 晶体的热容问题7.7 分子的全配分函数7.8 用配分函数计算 和反应的平衡常数rmG7.1 概 论统计热力学的研究方法和目的统计系统的分类统计热力学的基本假定统计热力学的研究方法和目的 物质的宏观性质本质上是微观粒子不停地运动的客观反应。虽然每个粒子都遵守力学定律,但是无法用力学中的微分方程去描述整个系统的运动状态,所以必须用统计学的方法。 根据统计单位的力学性质(
2、例如速度、动量、位置、振动、转动等),经过统计平均推求系统的热力学性质,将系统的微观性质与宏观性质联系起来,这就是统计热力学的研究方法。统计热力学的基本任务根据对物质结构的某些基本假定,以及实验所得的光谱数据,求得物质结构的一些基本常数,如核间距、键角、振动频率等。利用这些数据可以计算分子配分函数。再根据配分函数求出物质的热力学性质,这就是统计热力学的基本任务。统计热力学的基本任务该方法的局限性:计算时必须假定结构的模型,而人们对物质结构的认识也在不断深化,这势必引入一定的近似性。另外,对大的复杂分子以及凝聚系统,计算尚有困难。该方法的优点: 将系统的微观性质与宏观性质联系起来,对于简单分子计
3、算结果常是令人满意的。不需要进行复杂的低温量热实验,就能求得相当准确的熵值。统计系统的分类目前,统计主要有三种:一种是Maxwell-Boltzmann统计,通常称为Boltzmann统计。1900年Plonck提出了量子论,引入了能量量子化的概念,发展成为初期的量子统计。 在这时期中,Boltzmann有很多贡献,开始是用经典的统计方法,而后来又有发展,加以改进,形成了目前的Boltzmann统计。统计系统的分类 1924年以后有了量子力学,使统计力学中力学的基础发生改变,随之统计的方法也有改进,从而形成了Bose-Einstein统计和Fermi-Dirac统计,分别适用于不同系统。 但这
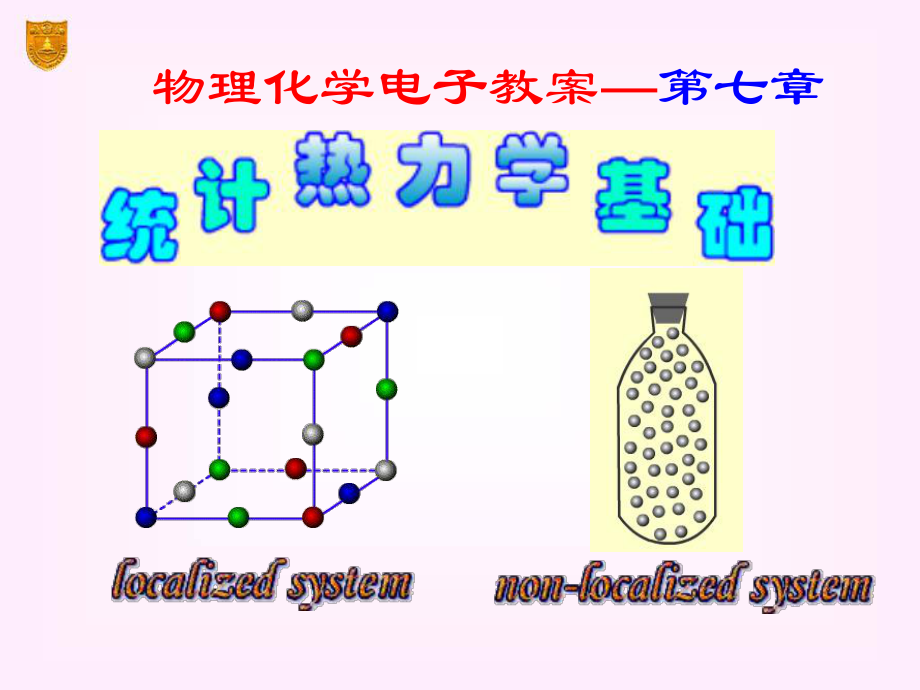
4、两种统计在一定条件下通过适当的近似,可与Boltzmann统计得到相同结果。统计系统的分类定位系统(localized system) 定位系统又称为定域子系统,这种系统中的粒子彼此可以分辨。例如,在晶体中,粒子在固定的晶格位置上作振动,每个位置可以想象给予编号而加以区分,所以定位系统的微观态数是很大的。 根据统计单位是否可以分辨,把系统分为定位系统和非定位系统 统计系统的分类非定位系统(non-localized system) 非定位系统又称为离域子系统,基本粒子之间不可区分。例如,气体的分子,总是处于混乱运动之中,彼此无法分辨,所以气体是非定位系统,它的微观状态数在粒子数相同的情况下要比
5、定位系统少得多。统计系统的分类 根据统计单位之间有无相互作用,又可把统计系统分为近独立粒子系统和非独立粒子系统独立粒子系统(assembly of independent particles) iiiUN E 独立粒子系统是本章主要的研究对象 粒子之间的相互作用非常微弱,因此可以忽略不计,所以独立粒子系统严格讲应称为近独立粒子系统。这种系统的总能量应等于各个粒子能量之和,即: 统计系统的分类非独立粒子系统(assembly of interacting particles) 1111,iiNNNiUN EUx y zxyz 非独立粒子系统又称为相依粒子系统,系统中粒子之间的相互作用不能忽略,系
6、统的总能量除了包括各个粒子的能量之和外,还包括粒子之间的相互作用的位能,即: 非理想气体就是非独立粒子系统统计热力学的基本假定概率(probability)热力学概率 指某一件事或某一种状态出现的机会大小 系统在一定的宏观状态下,可能出现的微观态的总数,通常用 表示。lnSk统计热力学的基本假定等概率假定例如,某宏观系统的总微态数为 ,则每一种微观状态 P出现的数学概率都相等,即:1P对于U, V 和 N 确定的某一宏观系统,任何一个可能出现的微观状态,都有相同的数学概率,所以这假定又称为等概率原理。7.2 Boltzmann 统计定位系统的最概然分布Boltzmann公式的讨论 非定位系统的
7、最概然分布撷取最大项法及其原理 值的推导, Boltzmann公式的其他形式定位系统的最概然分布一个由 N 个可区分的独立粒子组成的宏观系统(U,V,N为定值),在量子化的能级上可以有多种不同的分配方式。123123123 , , , iiiNNNNNNNN能级:, 一种分布方式:,另一种分布方式:,设其分配方式为:定位系统的最概然分布iiNN 但无论哪一种分布方式,都必须满足如下两个条件或10iiNNiiiNU或20iiiNU 这种分布的微态数相当于将N个不同的球在两个限制条件下分成若干不同的堆,根据排列组合公式,有:定位系统的最概然分布 这是一种分布,在满足这两个条件下,可以有各种不同的分
8、布,则总的微观状态数为:12! ! !iiNN NNN121NNNNNtCC111212!()!()!()!NNNNNNNNNN设有n个项进行求和,每一项都取最大值,则有!iiiii ii iiiiNNNNiiNUNUNtN 每种分配的 值各不相同,但Boltzmann认为其中有一项的值最大,即 ,在粒子数足够多的宏观系统中,可以近似用 来代表所有的微观数,这就是最概然分布。itmtmtmmtntmmlnlnlnlnttnmmlnlnlnlnttn由于mnt所以mlnlntnmlnlnt! !iiNtN求极值 问题在于如何在两个限制条件下,找出一种合适的分布 ,才能使 有极大值,在数学上就是求
9、条件极值的问题。即:iNt, iiiiiNNNU满足将上式取对数,并用Stirling公式展开! !iiNtN求极值lnln!ln!itNNlnlniiiNNNNNN再用Lagrange乘因子法,求得最概然的分布为: 式中 和 是Lagrange乘因子法中引进的待定因子。*iiNe *iiNe *iiiiNeNe先求值的推导, 已知*iiNN 所以iieeN或iiNee 或lnlniiNe最概然分布公式中已消去了值的推导, 已知mlnlnSkkt代入得*mlnlnlniiitNNNNNN*lnlniiiiiSk NNNNNN 再求 *lnln iiik NNNNNN*ln iiiik NNNN
10、e*ln ; iiik NNNUNNNUln lnlniikNek UNe值的推导, 根据复合函数的性质ln iSkNek U(,)SS N U(, )SS N U V,( , )SS N UU V,V NNV NU NSSSUUU,lniV NV NU NSkkNeUUU 可以证明上式中的方括号等于零,故而得值的推导, ln iSkNek U,V NSkU 因为dddUT Sp V,1V NSUT所以1kT /*/iikTikTeNNe这就是Boltzmann最概然分布公式值的推导, ln iSkNek U已知所以1kT /lnikTUSkNeT又因为AUTS所以/lnikTiANkTe 这
11、就是定位系统的熵和Helmholtz自由能的计算公式Boltzmann 公式的讨论简并度(degeneration) 量子力学中把能级可能有的微观状态数称为该能级的简并度,用符号 表示。简并度亦称为退化度或统计权重。ig 能量是量子化的,但每一个能级上可能有若干个不同的量子状态存在,反映在光谱上就是代表某一能级的谱线常常是由好几条非常接近的精细谱线所构成。例如,气体分子平动能的公式为:22222/3()8ixyzhnnnmV式中 分别是在 轴方向的平动量子数,xyzn nn和zyx和,当22/338ihmV1,1,1,xyznnn1ig 只有一种可能的状态,是非简并的,例如,气体分子平动能的公
12、式为:22222/3()8ixyzhnnnmV当22/368ihmV,xyzn n n可分别为:3ig 系统具有三种可能的状态,是简并的 xyznnn2 1 11 2 1 1 1 2121212 , , , , , , , , , iiigggNNN能级:各能级简并度:一种分配方式有简并度时定位系统的微态数设有 N 个粒子的某定位系统的一种分布为: 先从N个分子中选出N1个粒子放在 能级上,有 种取法;11NNC 但 能级上有 个不同状态,每个分子在 能级上都有 种放法,所以共有 种放法;11g11g11Ng 这样将N1个粒子放在 能极上,共有 种微态数。依次类推,这种分配方式的微态数为:11
13、1NNNCg11122112()()NNNNNNNtgCgC121121212()! !()!()!NNNNNggNNNNNNN121212i!NNNggNNN!iNiiigNN( , ,)!iNiiiigU V NNN 由于分配方式很多,所以在U、V、N一定的条件下,所有的总微态数为: iiiiiNNNU求和的限制条件仍为:再采用最概然分布概念,令:用 Stiring 公式和 Lagrange 乘因子法求条件极值,得到微态数为极大值时的分布方式 为:*iNmlnlnt/*/iikTiikTiig eNNg e与不考虑简并度的公式相比,只多了 项ig/lnikTiiUSkNg eT定位/lni
14、kTiiANkTg e 定位非定位系统的最概然分布1!, ,!iii iNiiNNiNUgU V NNNN 非定位系统由于粒子不能区分,它在能级上分布的微态数一定少于定位系统,所以对定位系统微态数的计算式进行等同粒子的修正,即将计算公式除以 。!N 则非定位系统在U、V、N一定的条件下,所有的总微态数为:/*/iikTiikTiig eNNg e(非定位) 同样采用最概然分布的概念,用Stiring公式和Lagrange乘因子法求条件极值,得到微态数为极大值时的分布方式 (非定位)为:*iN 由此可见,定位系统与非定位系统,最概然的分布公式是相同的。/ln!iNkTiig eUSkNT非定位/
15、ln!iNkTiig eAkTN 非定位 但熵和Helmholtz自由能计算式差一些常数项,但在计算变化值时可以消去。Boltzmann 公式的其他形式(1)将 i 能级和 j 能级上粒子数进行比较,用最概然分布公式相比,消去相同项,得:/*/*ijkTiikTjjNg eNg e(2)在经典力学中不考虑简并度,则上式成为*/*/exp()ijkTijikTjNekTNe*/*/exp()ijkTijikTjNekTNe 设最低能级为0在 能级上的粒子数为 ,略去 标号,则上式可写作:00N*0ii/0ikTiNN e 这公式使用方便,例如讨论压力在重力场中的分布,设各个高度温度相同,即得:/
16、0emgh kTpp撷取最大项法及其原理设为定位系统,其中一种分布方式的微态数为!iNiiigtNNlnlnlnlniiiiiiitNNNNgNNN取对数,得:, iiiNNNttt lnlnlniiiittNNNNNglniiiiiiiiNNNNNN将上面两式相减,得:lnlnln 1iiiiiiiNttNgNtN在上式中,*lnln0iiiiigNNN*m*mlnlnln 1lniiiiiiiiiiiNttNNNNNNtN*ln 1ln 1iiiiiiiiNNNNNN lniiiiiiNNNN0iN若是最概然分布,t 有极大值ln0t因是最概然分布,将t 换作mt因为23m*m1ln2ii
17、iiiiiiNNttNtNN 2m*m1ln2iiiNtttN *m*mlnln 1ln 1iiiiiiiiNNttNNtNN 1iiNN引用级数公式2311ln(1)23xxxx略去 及更高次项,3()iN又因0iiNmm()ttt在一个等分为二的长方形盒子中,均匀分布时,2m*m()1ln2iiiNtttN *910iN由于分子运动,发生1%偏离,即*0.01iiNN即15mmexp3 10ttt 1921921519191 (0.01 3 10 )( 0.01 3 10 )3 1023 103 10 这个数值很小,表示 是“尖锐的极大”mt(2) 能否用最概然分布的微观状态数代替总的微观
18、状态数?在粒子数足够大时,设2410N 可以用数学方法证明mlnlnt = l若某一能态的粒子数处于的间隔为(2)(2)22NNNN则所有可能分布的微态数为23122312(5 102 10 )(5 102 10 ) 即23234.99999999998 105.00000000002 10说明了最概然分布足以代表系统的一切分布。7.4配分函数配分函数的定义配分函数的分离配分函数与热力学函数的关系配分函数的定义根据Boltzmann最概然分布公式(略去标号 )*/iikTiikTiig eNNg e令分母的求和项为:/ikTiig eqq 称为分子配分函数,或配分函数(partition fu
19、nction)配分函数是量纲一的量,单位为1求和项中 称为Boltzmann因子。i/kTe 配分函数q是对系统中一个粒子的所有可能状态的Boltzmann因子求和,因此q又称为状态和。 配分函数q是属于一个粒子的,与其余粒子无关,故称为粒子的配分函数。将q代入最概然分布公式,得:/ijkTiikTjjNg eNg e/ikTiiNg eNq q中的任何一项与q之比,等于分配在该能级上粒子的分数,q中任两项之比等于这两个能级上最概然分布的粒子数之比,这正是q被称为配分函数的由来。配分函数与热力学函数的关系/(e)ln!ikTNiigAkTN 非定位先讨论粒子数为N的非定位系统的热力学函数(1)
20、Helmholz自由能A ln!NqkTN 配分函数与热力学函数的关系,()V NAST (2)熵 S,lnln()!NV NqqSkNkTNT非定位dddAS Tp V 或根据以前得到的熵的表达式直接得到下式:ln!NqUSkNT非定位配分函数与热力学函数的关系2,lnV NqNkTT(3)热力学能U或从 两个表达式一比较就可得上式。S非定位UATS2,lnlnln!NNV NqqqkTkTNkTNNT 配分函数与热力学函数的关系,ln()()T NT NAqpNkTVV (4)Gibbs自由能GGApV根据定义,dddAS Tp V ,lnln()!NT NqqGkTNkTVNV 非定位将
21、 A,p 代入,得:配分函数与热力学函数的关系2,lnlnV NT NqqHNkTNkTVTV非定位(5)焓HHUpV(6)定容热容CV2,ln()V N VVqCNkTTT非定位()VVUCT 根据以上各个表达式,只要知道配分函数,就能求出非定位系统的各热力学函数值。GTS定位系统配分函数与热力学函数的关系 根据非定位系统求配分函数与热力学函数关系相同的方法,得:lnNAkTq 定位,lnln()V NqSNkqNkTT定位l nUSNkqT定位或2,ln()V NqUNkTT定位定位系统配分函数与热力学函数的关系,()T NAGApVA VV定位HGTSUpV定位2,ln()V N VVq
22、CNkTTT定位,lnln()NT NqkTqNkTVV 2,lnln()()V NT NqqNkTNkTVTV定位系统配分函数与热力学函数的关系由上列公式可见,U,H 和CV的表达式在定位和非定位系统中是一样的;而A,S 和 G的表达式中,定位系统少了与 有关的常数项,而这些在计算函数的变化值时是可以消去的。!1N本章主要讨论非定位系统配分函数的分离 一个分子的能量可以认为是由分子的整体运动能量即平动能,以及分子内部运动的能量之和。 分子内部的能量包括转动能( )、振动能( )、电子的能量( )和核运动能量( ),各能量可看作独立无关。rventrven这几个能级的大小次序是:配分函数的分离
23、1r(42420) J mol平动能约为211t4.2 10 J mol,t,iii内分子的总能量等于各种能量之和,即:电子和核的能量 则更高en ,1v(4.242) kJ mol转动能约为振动能约为,t,r,v,e,niiiii配分函数的分离 各不同的能量有相应的简并度,t,r,v,e,n, , , , iiiiiggggg 当总能量为 时,总简并度等于各种能量简并度的乘积,即:i,t,iiiggg内,t,r,v,e,niiiiiggggg 根据配分函数的定义将 和 的表达式代入,得iig 从数学上可以证明,几个独立变数乘积之和等于各自求和的乘积,于是上式可写作:,t,r,v,e,n,t,
24、r,v,e,nexp()iiiiiiiiiiigggggkTexp()iiiqgkT,t,r,t,r,v,e,v,e,n,nexp() exp() exp() exp() exp()iiiiiiiiiiiiiiiqggkTkTggkTkTgkTtrvenqqqqq 比较定位系统和非定位系统Helmholtz自由能的表达式,lnANkTq 定位trvenlnlnlnlnlnNkTqNkTqNkTqNkTqNkTq t r v e nAAAAAln!NqAkTN 非定位trvenlnlnlnlnln!NqkTNkTqNkTqNkTqNkTqN 两者仅在平动项上差了ln!kTN今后的问题是如何计算各
25、种运动的贡献7.5 各配分函数的求法及其对热力学函数的贡献原子核配分函数电子配分函数平动配分函数转动配分函数振动配分函数单元子理想气体的热力学函数原子核配分函数n,0n,1nn,0n,1exp()exp()qggkTkT式中 分别代表原子核在基态和第一激发态的能量, 分别代表相应能级的简并度。n,0n,1,n,0n,1,ggn,0n,1n,1n,0n,0n,0exp()1exp()ggkTgkTn,0nn,0exp()qgkT由于化学反应中,核总是处于基态,另外基态与第一激发态之间的能级间隔很大,所以一般把方括号中第二项及以后的所有项都忽略不计,则: 如将核基态能级能量选为零,则上式可简化为:
26、nn,0n21qgs 即原子核的配分函数等于基态的简并度,它来源于核的自旋作用。式中 sn 是核的自旋量子数。nnnn,212121qsss总对于多原子分子,核的总配分函数等于各原子的核配分函数的乘积 由于核自旋配分函数与温度、体积无关,所以对热力学能、焓和等容热容没有贡献。n21iis 但对熵、Helmholtz自由能和Gibbs自由能有相应的贡献。 从化学反应的角度看,一般忽略核自旋配分函数的贡献,仅在计算规定熵时会计算它的贡献。电子配分函数e,0e,1ee,0e,1exp()exp()qggkTkTe,0e,1e,1e,0e,0e,0 exp()1exp()ggkTgkT 电子能级间隔也
27、很大, 除F, Cl 少数元素外,方括号中第二项也可略去。虽然温度很高时,电子也可能被激发,但往往电子尚未激发,分子就分解了。所以通常电子总是处于基态,则:-1e,1e,0()400 kJ mol ,e,0ee,0exp()qgkT电子配分函数若将 视为零,则e,0ee,021qgj 式中 j 是电子总的角动量量子数。电子绕核运动总动量矩也是量子化的,沿某一选定轴上的分量可能有 2j+1个取向。 某些自由原子和稳定离子的 是非简并的。如有一个未配对电子,可能有两种不同的自旋,如 它的e,00 , 1 ,jge,01 , 2 2jg。Na ,e,0ee,0exp()qgkT电子配分函数 电子配分
28、函数对热力学函数的贡献为ee,e0VUHCeelnANkTq eelnGNkTq eelnSNkq平动配分函数设质量为m的粒子在体积为的立方体内运动,根据波动方程解得平动能表示式为:cba2222,t222()8yxzinnhnm abc式中h是普朗克常数,分别是 轴上的平动量子数,其数值为 的正整数。,xyzn nnzyx, , 2 , 1,tt,texp()iiiqgkT将 的表示式代入:,ti2222t222111exp()8xyzyxznnnnnhnqm abc 因为对所有量子数从 求和,包括了所有状态,所以公式中不出现 项。0,tig22222211exp()exp()88xyyxn
29、nnnhhmkT amkT b2221 exp()8zznhnmkTct,t,t, xyzqqqt,xq 在三个轴上的平动配分函数是类似的,只解其中一个 ,其余类推。22t,21exp()8xxxnnhqmkT a22t,0exp()d xxxqnn因为 是一个很小的数值,所以求和号用积分号代替,得:2222221 exp() (8xxnhnmkTa设)引用积分公式:则上式得:201d2axexa12t,212()2xmkTqah32t22()mkTqa b ch 和 有相同的表示式,只是把a换成 b或 c,故t,yqt,zq3222 ()mkTVh22t20exp()d8xxhqnnmkTa
30、2220exp()d8yyhnnmkTb2220exp()d8zzhnnmkTcttln!NqAkTN 这就是Sackur-Tetrode公式,用来计算理想气体的平动熵3/ 222lnlnmkTNkTVNkTNNkTh ,ttV NTSA3/ 2225lnln2mkTNkVNht5ln2qNkN 平动配分函数对热力学函数的贡献 对于1 mol 理想气体,Sackur-Tetrode 公式为3/ 2t,mm325ln2mkTSRVRLh 根据UATS2tt,32lnV NqUNTkTNkTtt,32VVUTCNk 根据热力学函数之间的关系,可以得到tt, GH 根据热力学函数之间的关系,可以得到
31、tt, GHttHUpVttGApVNTVAp,)(代入相应的 表示式即得。tt,UA单原子理想气体热力学函数 由于单原子分子内部运动没有转动和振动,所以只有原子核、电子和外部的平动对热力学函数有贡献。 理想气体是非定位系统,所以它的一系列热力学函数用配分函数的计算式分别分列如下: (1)Helmholtz自由能 AnetAAAAtnelnlnln!NqNkTqNkTqkTN n,0n,0exp()NAkT gkTe,0e,0exp()NkT gkT3 23(2)lnlnlnmkTNkTNkTVNkTNNkThn,0e,0n,0e,0()lnNNNkTgg3 23(2)ln)lnlnmkTNk
32、TNkTVNkTNNkTh 第一项是核和电子处于基态时的能量,第二项是与简并度有关的项。在计算热力学函数变量时,这些都可以消去。,()V NAST 这公式也称为Sachur-Tetrode公式。(2)熵 S32n,0e,022lnln()lnln35 ln22mkNkggVNhT可用来计算但原子理想气体的熵2tt,ln()V NqUNkTUT因为对热力学能没有贡献,只有平动能有贡献,所以:ne , qq32NkT(3)热力学能 U(4)定容热容 CVt,t,3()2VVV NUCCNkT 这个结论与经典的能量均分原理的结果是一致的,单原子分子只有三个平动自由度,每个自由度贡献 ,则N个粒子共有
33、 12k32NkVTNA,)(对于理想气体, ,代入 A 的表示式,得:pNkTV 32n,0e,0n,0e,03(2)()lnln lnlnmkTkTggkThkTkTkTp(5)化学势 对1 mol气体分子而言,各项均乘以阿伏伽德罗常数 , , 则1 mol气体化学势为LkRL(5)化学势 32n,0e,0n,0e,03(2)()lnln) lnlnmkTLRTggRThRTkTRTp32n,0e,0n,0e,03(2)()lnln) lnlnmkTLRTggRThRTkTRTp当处于标准态时,则:pp从该式可看出, 一定时, 只是T的函数。两式相减得:p( , )( )ln(/)T pT
34、RTp p,d()dT NApV 将A的表示式代入,由于其它项均与体积无关,只有平动项中有一项与V有关,代入即得理想气体状态方程。,(ln)T NNkTVNkTpVV 用统计热力学的方法可以导出理想气体状态方程,这是经典热力学无法办到的。(6)状态方程式转动配分函数 单原子分子的转动配分函数等于零,异核双原子分子、同核双原子分子和线性多原子分子的 有类似的形式,而非线性多原子分子的 表示式较为复杂。rqrq(1)异核双原子分子的 ,设其为刚性转子绕质心转动,能级公式为:rq2r2(1) 0 1 28hJ JJI, ,式中J是转动能级量子数,I是转动惯量,设双原子质量分别为 ,r为核间距,则:1
35、2 , mm21212()m mIrmm转动配分函数 转动角动量在空间取向也是量子化的,所以能级简并度为:,r21 igJ220(1)(21)exp()8JJ JhJIkT,r,rrexp() iiigTqk2r28hIk令Q称为转动特征温度,因等式右边项具有温度的量纲。将 代入 表达式,得:rQrQrqrr0(1)(21)exp()JJ JqJTQ在常温下, ,因此用积分号代替求和号r1TQ从转动惯量 I求 得rQ除H2外,大多数分子的 很小rQrr0(1)(21)exp()d J JqJJTQ(1) , d(21)dxJ JxJJ令:代入上式后,得:rr0expdxqxTrTQrr0exp
36、TxT 228IkTh对于转动特征温度较高的分子,应该使用下式rrr13TqT2r28IkTqh 对于同核双原子和线性多原子分子,还要除以对称数对于非线性多原子分子,转动配分函数为32212r38(2)()xyzkTqIIIh分别为三个轴上的转动惯量。 xyzIII,和振动配分函数双原子分子的vqv1() 0,1,2,2vhv设分子作只有一种频率 的简谐振动,振动是非简并的,其振动能为:,v1igv,012h式中v为振动量子数,当v=0时, 称为零点振动能v,0,vv,vexp()iiiqgkT01()2expvvhkT135expexpexp222hhhkTkTkT12exp1 expexp
37、2hhhkTkTkT令vhkQ 称为振动特征温度,也具有温度量纲,则上式为v Qvvvv35exp()exp()exp()222TqTTQQQvvv2 exp() 1 exp()exp()2TTTQQQ 振动特征温度是物质的重要性质之一, 越高,处于激发态的百分数越小, 表示式中第二项及其以后项可略去不计。vQvq 也有的分子 较低,如碘的 ,则第一激发态项就不能忽略。vQv310 KQ在低温时, ,则 ,引用数学近似公式:v1TQvexp()1TQ211 11xxxx 时,则 的表示式为:vqv/11exp21hkThqkTe0,1,2,v expvvhkTq将零点振动能视为零, 即 则:v
38、,010 ,2h 2 (1)hhkTkTee1 1hkTevtr3fnff多原子分子振动自由度vf 多原子分子的vq 为平动自由度, 为转动自由度tfrf因此,线型多原子分子的 为:vqn 为分子中原子总数352v1()1iihnkThikTeqe线型非线型多原子分子的 为:vq362v1()1iihnkThikTeqe非线型abxzy图图 7.1 7.1 双原子分子在空间中的取向双原子分子在空间中的取向7.7 分子的全配分函数 根据配分函数的定义及可分离的性质,分子的全配分函数应该由5个部分组成,即:expiiiqgkT总n,e,t,r,v,n,e,t,r,v,expiiiiiiiiiig
39、g g g gkTn,e,t,n,e,t,expexpexpiiiiiigggkTkTkTr,v,r,v, expexpiiiiggkTkTnetrvqqqqq7.7 分子的全配分函数对于单原子分子3/2n,0e,0n,0e,032expexp mkTqggVkTkTh 总对于双原子分子3/2n,0e,0n,0e,032expexpmkTqggVkTkTh总221exp82 1 exphIkTkThhkT7.7 分子的全配分函数对于线型多原子分子3/2n,0e,0n,0e,032expexp mkTqggVkTkTh 总235211exp82 1 expiniihIkTkThhkT7.7 分子
40、的全配分函数对于非线型多原子分子3/2n,0e,0n,0e,032expexpmkTqggVkTkTh总3/22361/2311exp822 () 1 expinxyziihkTkTIIIhhkTlnNAkTq 定位ln!NqAkTN 非定位7.8 用配分函数计算 和反应的平衡常数化学平衡系统的公共能量标度从自由能函数计算平衡常数热函函数从配分函数求平衡常数rmG化学平衡系统的公共能量标度粒子的能量零点 对于同一物质粒子的能量零点,无论怎样选取,都不会影响其能量变化值的求算。通常粒子的能量零点是这样规定的: 当转动和振动量子数都等于零时 的能级定为能量坐标原点,这时粒子的能量等于零。(0,0)
41、J公共能量标度 化学平衡系统中有多种物质,而各物质的能量零点又各不相同,所以要定义一个公共零点 通常选取0 K作为最低能级,从粒子的能量零点到公共零点的能量差为 00(A)0(B)A0, 0, 0JB0, 0, 0JAB粒子的能量零点和公共能量零点的关系000(A)0(B)A0, 0, 0JB0, 0, 0JAB00按公共的能量零点计算的分子能量为按公共能量标度计算的配分函数为0j0()/jkTjjqg e0/jkTkTjjeg e0/kTeq 按公共能量零点用非定位系统的配分函数计算的热力学函数的表示式为式中0ln!ln!NNqkTNqAkTUN 非定位00UN,lnln!V NAqqSNk
42、NkTTNT 非定位22,0,lnlnV NV NqNqUNkTUkTTT非定位2,lnV NVVqNkTTCT,非定位,T NAVNkTpV GApV非定位0ln!NqkTUNkTN 2,lnV NVqNkTTT0lnqNkTUN 20,lnV NqHNUkTUpVNkTT非定位 采用公共零点后, A,G,H,U的配分函数表达式中多了 项 00()UN0U而 和 p 的表达式不变。,VS C 在统计热力学中常选择0 K作为最低能级,因此 就是N个分子在0 K时的能量0U 当分子混合并且发生了化学变化时,必须使用公共的能量表度。从自由能函数计算平衡常数自由能函数(free energy fun
43、ction)称 为自由能函数0( )G TUT0lnqGNkTUN 因为0( )lnG TUqNkTN 所以在0K时 ,所以00UH0( )G THT也是自由能函数当 ,又设在标准状态下1molNNkR,mm( )(0)lnGTHqRTL 自由能函数可以从配分函数求得。各种物质在不同温度时的自由能函数值有表可查。求平衡常数DEGH设任意反应rm( )lnGTRTK rm( )lnGTRKTrmrmrm( )(0)(0)GTUUTTTmmrmBBB( )(0)(0)lnGTHURKTT 等式右边第一项是反应前后各物质自由能函数的差值 第二项中的 是0 K时该反应热力学能的变化值rm(0)U在0
44、K时rmrm(0)(0)HU 1已知 值和各物质的自由能函数值,倒算 值。rm(0)UKrmmmrmBB( )ln( )(0)(0) GTRKTGTUUTT求算 值的方法rm(0)U2从Gibbs自由能的定义式求GHTSrmrmrm( )( )( )GTHTTST mmm( )( )( )0GTHTT ST mmmmm( )(0)( )( )(0)GTHTSTHTHT 两边同时加一个、减一个 ,移项整理得:m(0)U等式左方易于求得,从而可得m(0)H3根据热化学中的Kirchhoff公式求rmrmr0rmK(0)( )0)dTpUHTCTH rmrmr0K( )(0)dTpHTHCT 等式右
45、方的值都可以从热化学中求得4由分子解离能D来计算设反应为:DEGHDrGmHE(0)()()DDDDUD 解离产物的基态反应物的基态生成物的基态DEDDGHDDrmU$用分子解离能来计算0K时的反应热力学能的变化值5由热函函数求mmrmBrmBB( )(0)( )(0)HTUHTTUT已知反应焓变和热函函数值,可求得 值。rm(0)U对于1 mol物质,在标准状态下,有mm,( )(0)lnV NHTUqRTRTT 等式左方称为热函函数。其数值可以通过配分函数求得。当T为298.15 K时, 值有表可查。 mm(298.15 K)(0)HU从配分函数求平衡常数设反应00DEDEG D E G0
46、 0 tNNttNNN分子之间的关系为0DDGNNN0EEGNNN01DGD0NNN02EGE0NNNDEGAAAADEGDEGDEGlnlnln!NNNqqqkTkTkTNNN DEGDEGDEGln!NNNqqqkTNNN 0exp()qqkT 是用分子数目表示的平衡常数,q是将零点能分出以后的总配分函数。NK*GG*DEDENNqKN Nq q 如果将平动配分函数中的V再分出,则配分函数用 f 表示0exp()qVfkT 在平衡时,A有极小值。利用Lagrange乘因子法,求出能使A有极小值的*GDE, , NNN*GDEGG000*DEDEexpNfVN Nf fV VkT*GG0*DEDEexp()cCfKC Cf fkT求出各配分函数 f 值,可得到平衡常数 值CK对于理想气体,pCkTBBBBG0DEexppCfKKkTkTf fkT若气体反应为2DEG*GG022*DEDEexpCCfKf fkTCC不难证明在平衡后有如下关系若气体反应为*GG22*DEDENNqKqqNN在配分函数中,浓度C的单位是:3m若单位用 3mol dm平衡常数值必须作相应的换算
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 新人版英语八年级下册Unit5总复习ppt课件
- 新人教部编版一年级语文上第五单元ppt课件(全套)
- 高鸿业经济学基础第十五章-总需求-总供给模型-授课-河北工大宋建林课件
- 新人教版高中数学《等差数列前n项和》课件
- 新人教部编版五年级语文上册第六单元测试卷课件
- 高鸿业微观经济学课件第4章生产论
- 高鸿业--微观经济学-第一章课件
- 新人教版部编本五年级下册语文13 人物描写一组 ppt课件
- 新人教版高中化学必修第一册——电解质的电离ppt课件
- 新人教版部编教材二年级下册第一单元3《贝的故事》优质课教学ppt课件
- 高风险作业培训讲义_002
- 新人教版语文三年级下册第五单元全套ppt课件部编版
- 新人教版英语八年级上册第二单元全部ppt课件
- 《走一步再走一步》重点课件
- 新人教版语文一年级上册:识字1《天地人》课件
